黄龙病菌感染对长春花SOD和POD活性的影响
2019-04-13余沁涵鲍敏丽陈燕玲邓晓玲
李 亚,余沁涵,鲍敏丽,陈燕玲,邓晓玲
(1.广东海洋大学农学院,广东 湛江 524088; 2.华南农业大学柑橘黄龙病研究室,广东 广州 510642)
【研究意义】柑橘黄龙病菌(CandidatusLiberibacter asiaticus,CaLas)为韧皮部内生的革兰氏阴性菌,属于根瘤菌科韧皮部杆菌属,是引起柑橘黄龙病的重要病原[1]。目前,所有柑橘栽培品种以及各个生长时期都能感染黄龙病菌,病树往往伴随着大量落叶和落果,一般植株通常会在感病几年后逐渐枯死[2],因此柑橘黄龙病严重影响了柑橘的产量和产业的健康发展。长春花(Catharanthus roseus)属于夹竹桃科长春花属植物,主要作为观赏和药用植物。Garnier 等研究证实夹竹桃科草本植物长春花可以通过嫁接的方式感染黄龙病菌[3]。而且长春花染病后叶片上的症状更明显,菌浓度更高,因此常用作研究黄龙病的指示植物和实验材料[4]。自然界中,植物在生长发育过程中经常受到各种潜在病原生物的侵扰,多数情况下并不表现出症状,这主要是因为在进化过程中,植物体内形成了复杂防御机制。植物可以由防御体系合成各种抗逆代谢物来抵抗各类病原菌的侵染[5]。研究表明,植物正常生长时,体内活性氧代谢处在一个低水平的动态平衡中,当植物受到病原菌的侵染时,植物体内活性氧产生和清除的代谢平衡被破坏,过量的活性氧引发细胞的过氧化,破坏细胞膜的结构与功能,导致植物细胞死亡[6]。在维持活性氧平衡的过程一系列细胞保护酶就起到了非常重要的作用,如超氧化物歧化酶(SOD,Superoxide dismutase)、过氧化物酶(POD,Peroxidase)、多酚氧化酶(PPO,Polyphenol oxidase)及脂氧合酶(LOX,Lipoxygenase)等。因此研究病原菌侵染后寄主植物的防御相关酶活性的动态变化是了解寄主与病原菌相互作用的机制、筛选病原感染的分子标记以及提高抗病品种选育的准确性和效率的重要途径。【前人研究进展】目前,在水稻(Oryza sativa)[7]、小麦(Triticum aestivuml)[8]、棉花(Gossypium hirsutum)[9]、丝瓜(Luffa cylindrical)[10]、苹果(Malus domestica)[11]等各种不同的寄主与稻瘟病,白粉病、棉枯萎病、霜霉病和轮纹病等多种原菌互作系统中,SOD和POD等酶活性的变化趋势虽然存在差异,但是其活性的变化规律仍然反应了植物对病原菌的抵抗能力。在柑橘黄龙病的研究中,病原菌侵染后寄主植物抗性形成的机制,是近年来研究的重点,也是解决柑橘黄龙病的根本途径。目前已经通过Affymetrix柑橘基因芯片[12]、转录组学[13-14]以及同位素标记的相对和绝对定量技术(iTRAQ)[15]研究了黄龙病菌侵染对柑橘体内SOD和POD等基因表达量的变化。有实验结果证实CaLas基因组中的原噬菌体SC2也能编码一类POD,从而增强CaLas对寄主植物的适应性,且其在长春花中的表达量比柑橘中要高,而在木虱中则被抑制[16-17]。【本研究切入点】本研究以长春花作为实验材料,跟踪检测CaLas感染后一段时间内,长春花叶、茎和根等不同部位SOD和POD的活性,通过比较不同感染时间和不同组织中SOD和POD活性的变化,来研究长春花中SOD和POD的活性与长春花抵抗CaLas侵染能力的关系。【拟解决的关键问题】长春花各组织在CaLas感染的不同时间,SOD和POD的活性变化与长春花抵抗CaLas侵染是否存在相关性。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 2014年3月,在华南农业大学长岗山网室内将长春花种子播种于育种盆中,待幼苗长到2~3 cm时移载至直径15 cm花盆内,保证每盆1株,隔天浇水1次。待植株长至20 cm时去顶嫁接病芽,同时以嫁接健康芽的长春花作为对照。嫁接后,将所有长春花苗放置阴凉处避免阳光直射,保持嫁接口处芽条湿润,1周后将嫁接苗从阴凉处取出,转移至网室内,隔天浇水1次。
1.1.2 病原材料 华南农业大学柑橘黄龙病研究室保存于长岗山网室内,经检测CaLas阳性的长春花枝条(病原可通过菟丝子从染病柑橘上获取)作为嫁接用病芽条。经检测CaLas阴性的长春花枝条作为嫁接用健康芽条。
1.2 试验方法
1.2.1 取样方法 嫁接病芽后14 d开始,隔天取嫁接点下方叶片,以叶中脉提取DNA,进行常规PCR检测,以确定染病植株作为阳性样品。最后按嫁接后20、25、30、35、40、45 d共6个时间取样,每个时间点所取样品包含3棵阳性植株、3棵健康植株,每棵植株的叶(主茎分枝以上部分)、主茎(茎基部-分枝处)和根(茎基本以下)3个部分作为独立的样品,液氮冷冻后-80℃保存,用于酶活力测定。
1.2.2 SOD活性测定 取植物组织0.5 g于预冷的研钵中,液氮研磨后,加0.05 mol/L预冷的磷酸缓冲液(pH 7.8)研磨匀浆,将匀浆全部传移至离心管中,至终体积5 mL。提取和测定参照朱海生等的方法[18]。每克鲜重每分钟内吸光度的变化值表示酶活性大小(U/g·min,FW)。
1.2.3 POD 活性测定 取植物组织0.5 g于预冷的研钵中,液氮研磨后加0.05 mol/L的磷酸缓冲液(pH 6.0)研磨成浆,将匀浆全部传入离心管中,至终体积5 mL。具体提取和测量方法参照黄相玲等的方法[19]。每克鲜重每分钟内吸光度的变化值表示酶活性大小U/g·min,FW)。
1.3 数据分析
应用SPSS13.0软件,采用ANOVA的Duncan多重差异分析对试验数据进行统计分析,Excel 软件进行数据处理及图表绘制。
2 结果与分析
2.1 不同组织间SOD的活性比较
从嫁接后20 d,可以从长春花叶片中检测到黄龙病菌后,开始测定健康和染病长春花中SOD含量。从表1可以看出,实验周期内,健康叶、茎和根中SOD 酶的活性波动不大,叶片中SOD酶的活性都要略高于根茎中SOD酶的活性,而根茎中的SOD 酶活性比较接近。受病原感染的长春花中SOD 酶活性则表现出不一样的趋势,嫁接后20 d,叶片中的SOD酶活性为559.73 U/g·min(FW),显著低于茎和根的720.27、702.24 U/g·min(FW)。但随后根茎中的SOD酶活性逐渐下降,嫁接后30、35 d叶片中SOD酶活性显著高于茎和根;嫁接后40 d 3个组织间SOD酶活性均存在显著差异,叶片中SOD酶活性最高达564.29 U/g·min(FW),其次为茎447.39 U/g·min(FW),根中SOD酶活性最低为365.12 U/g·min(FW);嫁接后45 d根中SOD酶活性为349.93 U/g·min(FW)显著低于叶和茎。

表1 长春花叶、茎和根中SOD活性比较(U/g·min,FW)Table 1 The activities of SOD in leaves, stems and roots of Catharanthus roseus
2.2 病原感染对长春花叶、茎和根SOD活性的影响
从图1可以看出,与健康对照相比,染病长春花叶、茎和根中SOD活性严重偏低。病原感染时间越长,叶片SOD活性越低,嫁接后20、25、30 d,叶SOD活性约为对照的65%,差异显著,嫁接后45 d SOD活性下降为对照的61%,差异极显著。感病长春花茎部SOD活性除了嫁接后20 d与对照差异不显著外,其他各时期均差异极显著,嫁接后35 d时,酶活性最低,为对照的55%。根部SOD活性的变化规律与茎部相同,嫁接后20 d与对照差异不显著,随后逐渐下降,从嫁接后25 d开始差异极显著,到嫁接后45 d酶活性只有对照的47%。
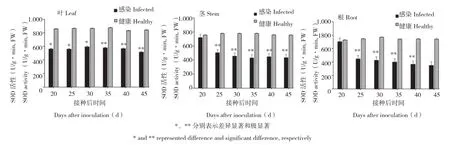
图1 染病长春花叶、茎和根SOD活性Fig. 1 The activity of SOD in leaves, stems and roots of infected Catharanthus roseus
2.3 不同组织间POD酶活性比较
试验结果(表2)表明,健康长春花的叶、茎和根中,POD活性均呈现逐渐上升趋势,叶和根POD活性显著高于茎中POD活性。在染病长春花的叶、茎和根中,POD活性均呈现先增加后下降的趋势,叶片中酶活性最高出现在嫁接后30 d,酶活性为1 022.5 U/g·min(FW);茎和根中酶活性最高均出现在嫁接后35 d,酶活性分别为1 008.33、1 129.17 U/g·min(FW),嫁接后30、35 d 3个组织间POD活性差异显著;嫁接后40、45 d,根POD活性分别为829.17、732.50 U/g·min(FW),是3个组织中最高的,显著高于叶和茎。

表2 长春花叶、茎和根中POD活性比较(U/g·min,FW)Table 2 The activities of POD in leaves, stems and roots of Catharanthus roseus
2.4 病原感染对长春花叶、茎和根POD活性的影响
从图2可以看出,与健康对照相比,染病长春花叶片嫁接后25、30 d POD活性分别为756.94、1 022.5 U/g·min(FW),为对照的159%和205%,差异显著;嫁接后45 d酶活性为497.5 U/g·min(FW),为对照的70%,差异显著。染病茎和根中POD活性在整个试验周期内基本高于健康对照,茎POD活性嫁接后30、40 d分别为602.5、691.5 U/g·min(FW),为对照的181%和171%,嫁接后35 d POD活性最高为1 008.33 U/g·min(FW),为对照的254%,差异极显著。根POD活性嫁接后25、30 d分别为822.5、876.67 U/g·min(FW),为对照的145%和154%,差异显著;嫁接后35 d POD活性最高为1 129.17 U/g·min(FW),为对照的194%,差异极显著。

图2 染病长春花叶、茎和根POD活性Fig. 2 The activities of POD in leaves, stems and roots of infected Catharanthus roseus
3 讨论
植物在长期的进化过程中可以通过增加防御相关酶(SOD、POD和PPO等)的活性来提高对各种逆境的抵抗能力,增强植物的抗病性[20-22]。大量研究结果证实SOD和POD活性的增加能够明显提高寄主植物抵抗生物胁迫的能力[23-24],尤其是病原菌侵染后,抗病品种的SOD和POD的活性往往上升比较快[25-26]。在甘蔗(Saccharum officinarum)与黑穗病[27]、香蕉(Musa nana)与枯萎病[28]的研究中均发现抗性品种中SOD和POD的活性明显高于感病品种。
本研究发现试验周期内健康叶、茎和根中长春花SOD活性均变化不大,叶片中SOD活性较茎和根部的SOD的活性要高。李玉坤等[29]通过亚细胞定位发现SOD 系中主要的组成成分Cu/ZnSOD 蛋白定位于叶绿体,主要在植物的绿色组织中表达,所以东方山羊豆的叶中Cu/ZnSOD表达量最多, 茎中次之, 根中最少,与本研究结果一致。黄龙病菌感染之后,茎根中SOD活性逐渐下降,而叶片中相对波动较小,可能与叶片是植物的光合作用中心,代谢活动最活跃有关,病原感染造成植物叶片黄化,整株衰退,光合作用减弱,有机物合成量下降,茎根所需营养不足。分别比较健康和染病植株的叶、茎和根的SOD活性发现,染病植株3个组织中SOD的活性均显著低于健康对照,说明病原感染对植物的基础代谢影响非常大,染病后期随着叶片黄化程度增加,植株衰退,整体基础代谢减弱,所有组织中SOD的活性相对于健康组织均显著下降。大量实验结果认为病原菌的感染会导致SOD活性的增加[30-32],有研究利用Affymetrix柑橘基因组芯片比较抗病和感病柑橘染病后的差异表达基因发现在SOD基因在抗病品种中高比例上调表达,在感病品种中则被抑制[12-13], 在土壤调理剂对缓解染病砂糖橘的研究中,也发现SOD表达量的上升[33]。而本试验3个组织中毫无另外的都是病原感染导致SOD活性的下降,这可能与取样时间有密切关系,由于黄龙病菌不能够人工培养,在研究黄龙病菌与长春花的互作中,经常通过人工嫁接染病芽条的方式让健康长春花染病,嫁接后到能够检测到病原菌的时间最快是嫁接后20 d,而在此之前,由于不能确定病原感染是否成功,往往不具备取样条件,当已经确定能够采样的时候,病原菌已经成功感染,寄主植物已经过了应激期,基础代谢受到严重影响。
健康长春花中POD活性试验周期内逐渐增加,其中根中POD的活性较叶和茎中的高,程华等[20]研究银杏POD基因的表达发现POD基因在银杏的各组织中都有表达, 在茎中的相对表达量最高, 其次为根和果, 而叶部位表达水平最低。而张丽丽等[34]研究发现香蕉谷胱甘肽过氧化物酶基因在香蕉的根、球茎、叶片、花和果实中均有所表达,其中在花和根中表达量较高,而在叶片中的表达量最低。在盐、涝害、干旱和枯萎病胁迫下MaGPX表达量升高,说明该基因表达具有器官差异性和受胁迫的诱导,不同的植物以及不同器官POD的活性变化规律会有所不同。分别比较健康和染病植株的叶、茎和根的POD活性发现,染病植株3个组织中POD的活性均表现出先升高后下降的趋势。大部分作物的抗性品系中POD的活性也较感病品系的高这与大部分研究结果一致[35-37]。在黄龙病的研究中,多项研究结果证明CaLas感染后,柑橘寄主体内的POD基因表达被上调[14-15]。表明黄龙病菌的感染早期,寄主确实会通过提高体内POD的活性来增加对病原菌的抗性。只是病原菌感染的后期由于植株整体衰退,导致所有基础代谢下降,POD的活性随之下降。
4 结论
本研究从防御相关酶(SOD和POD)活力的变化方面对长春花不同组织抵抗黄龙病菌的侵染能力进行了探讨。在CaLas的胁迫下,长春花不同的组织,染病不同的时期,SOD和POD的活性变化表现出不同的规律,SOD活性随感染时间的增加,逐渐下降,叶片中SOD活性最高,茎部又比根部高,POD的活性随感染时间的增加呈现先上升后下降的趋势,根部POD活性总体较叶、茎部高。说明染病不同时间,长春花不同部位对抗CaLas侵染能力和方式也有所不同,叶片和根部分别通过增加SOD和POD活性来抵抗CaLas侵染,而茎部无论是SOD还是POD活性都处于叶、根之间,这一结果是由植物部位间的结构差异还是各组织抵抗CaLas侵染的机制不同而导致的,还需要进一步深入细致的研究,以便为柑橘抵御黄龙病菌的侵染机制及防控研究提供更多、更有价值的参考。
