花生中致敏蛋白的检测方法研究进展
2019-04-12刘胜男孟继秋曹金博李燕虹
刘胜男,孟继秋,曹金博,李燕虹,王 耀,卫 星
(1.三门峡出入境检验检疫局,河南三门峡 472000;2.河南科技大学食品与生物工程学院,食品加工与安全国家级实验教学示范中心,河南洛阳 471023;3.三门峡市检验检疫中心,河南三门峡 472000)
花生具有很高的营养价值,富含不饱和脂肪酸及优质蛋白质,可促进人体的生长发育、抗老化,对胃肠功能起到保护的作用[1]。但是花生也是一种重要的致敏食物,有关学者统计,食品过敏的发病率很高,达到了2%,在成年人中更是高达4%~8%[2-4]。1995年,联合国粮食与农业组织(FAO) 认定的8种最常见的致敏食物中,花生就包括在内。因此,为了保障消费者的安全,大部分发达国家的食品包装标签中强制要求标识过敏原成分[5]。然而,当今国际上并未给出明确统一的标准,对包装食品中过敏原进行标识和限量[6-9]。而且到目前为止,针对花生过敏症状没有快速有效的治疗方法。因此,避免食用含有花生致敏蛋白的食物是对花生过敏人群最好的保护。为了更好地保障广大消费者的食品安全,对花生致敏蛋白的检测研究和探索也就变得非常有意义。
1 花生致敏蛋白概述
花生中能引起人体发生过敏反应的物质是蛋白质,所以称为致敏蛋白,其致敏原理就是通过有选择性的激活机体的免疫细胞,诱导机体产生特异性免疫球蛋白,引起I型超敏反应。目前,已被认可的花生致敏蛋白有13种(Ara h1到Ara h13),其中Ara h1,Ara h2和Ara h3能被大部分的过敏患者血清识别,是重要的致敏蛋白,也是检测研究的重点对象。
花生过敏原的种类及其特征见表1。
1.1 花生中的主要致敏蛋白
1.1.1 Ara h1
Ara h1占花生蛋白总量的12%~16%,是含量最多的致敏蛋白。其单体是分子量约为64 kD的糖蛋白[10];Ara h1的三聚体形式决定了其稳定性极高的特性,胃肠道的消化作用和加热都不会破坏其致敏性,不容易破坏,过敏反应非常强[11]。
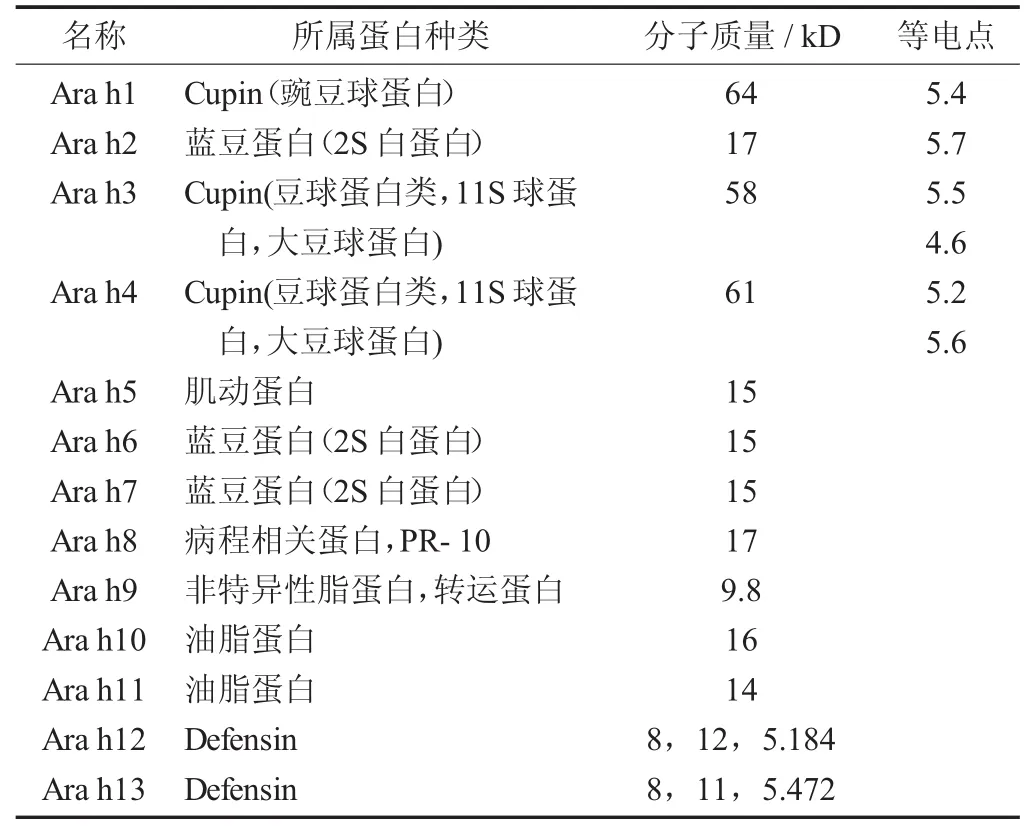
表1 花生过敏原的种类及其特征
1.1.2 Ara h2
Ara h2占花生蛋白总量的5.9%~9.3%[12];Ara h2包含Ara h2.01和Ara h2.02这2种遗传变异体[13],分子量范围在17~20 kD。Ara h2.02比Ara h2.01缺失了12个氨基酸[14]。由于Ara h2中二硫键较多,结构稳定,并且耐酶解。通过破坏其二硫键可降低其稳定性[15-16]。Ara h2易与 Ara h1,Ara h3引起交叉反应[17]。Ara h2可作为胰蛋白酶抑制剂,因为它们在结构上有很高的相似度,并且加热会使Ara h2蛋白的抑制剂活性显著提高[18]。
1.1.3 Ara h3
Ara h3具有低聚态稳定结构[19],属于双Cupin类型[20]。Ara h3.01和Ara h3.02是其2个遗传变异体。Ara h3存在4个与IgE结合的表位[21]。大部分花生过敏患者的血清都能识别Ara h1和Ara h2,而只有半数的亚洲患者和欧美患者的血清可以识别Ara h3,研究人员认为Ara h3蛋白不容易被识别的原因可能是抗原表位序列被深埋在高级结构内部,也可能与IgE抗原结合位点的不保守序列有关[22]。Ara h3免疫结合位点四级结构比较完整,不易被蛋白酶彻底水解。Ara h3最高能耐受70~92℃的温度,但前提是在适宜的离子强度下[23]。Ara h3在被水解为酸性碱性片段后,仍可导致机体发生过敏反应[24]。
1.2 其他致敏蛋白
Ara h1~Ara h3这3种致敏蛋白可被大部分过敏患者血清识别,相关研究相对较多。Ara h4~Ara h13只能被少数过敏患者的血清识别,相关的研究相对较少,下文主要介绍Ara h4~Ara h13目前已知的一些基本信息。
Ara h4不再被认为是一个独特的致敏蛋白,其本质就是Ara h3.02[25]。Ara h5是一种肌动蛋白,几乎存在于所有真核细胞。Ara h6和Ara h7在花生中含量很低,Ara h6与Ara h2有59%的同源性,而且热稳定性好,耐酶解[26];Ara h7与Ara h2有35%的同源性。Mittag D等人[27]认为花生蛋白Ara h8是一种非常重要的致敏蛋白,它不光可以引起花生过敏,还会使桦树花粉过敏患者过敏,但是Ara h8热稳定性差,不耐酶解[28]。Ara h9是一种非特异性的脂转运蛋白,具有耐酶解、耐高温的特性[29]。Ara h10,Ara h11是从花生油脂中提取出来的,属于油脂蛋白。Rabjohn P等人[30]首次开发了一种新型的花生3种油脂蛋白(14,16,18 kD) 表达和纯化系统,发现重组表达的油脂蛋白与天然的油脂蛋白非常类似。Ara h12的分子量有8,12,5.184 kD 3种,Ara h13同样有8,11,5.472 kD 3种,都属于防卫素。
2 主要致敏蛋白的检测方法
目前,检测花生致敏蛋白的方法分为2个方面:一是基于致敏蛋白的检测方法,如酶联免疫吸附试验(ELISA)、免疫印迹(IB)、高效液相色谱技术(HPLC) 及质谱分析技术(MS);二是基于致敏蛋白成分基因的检测方法,如聚合酶链反应(PCR)、实时荧光聚合酶链反应(RT-PCR)[31]。
2.1 基于致敏蛋白的检测方法
2.1.1 酶联免疫吸附试验
酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)是利用抗原抗体的特异性反应来检测被测物质,具有检测灵敏度高、特异性强、时间短的特点。ELISA法有夹心法、间接法和竞争法,其中双抗夹心ELISA法和竞争ELISA法适合花生致敏蛋白的检测。闫飞等人[32]使用ELISA方法检测了花生致敏蛋白Ara h6,IC50为414.6 ng/mL,在16.5~10 000 ng/mL的范围内有很好的线性关系,并且精确度和重复性很好。但是加热过程会改变致敏蛋白的一级结构,使抗体无法正确识别被检测过敏原,产生假阴性现象[33]。除此之外,ELISA这种抗原抗体的检测模式也会出现交叉反应,会出现检测值偏高和假阳性现象,影响试验结果准确性。
2.1.2 免疫印迹
免疫印迹(Immunoblotting,IB)又称蛋白印迹,是分子生物学、生物化学中分析蛋白质的常用技术,类似于ELISA,都属于免疫标记技术,具有操作简单、灵敏度高、特异性强等优点。其原理是利用SDS-PAGE凝胶电泳,将蛋白质按分子量大小分离,再将分离好的蛋白质固定在固相载体上,然后以抗体作为“探针”去检测蛋白质,用标记的二抗“显色”。
Burks[34]运用免疫印迹的方法,通过对过敏患者的血样进行检测。结果表明,致敏蛋白为一种分子量为17 kD,等电点为5.2的蛋白质。根据试验数据和其氨基酸顺序最终断定此种致敏蛋白是Ara h2。目前,这种方法已经很成熟,许多公司设计出特异性抗体用于检测蛋白质,但是试剂盒的价格比较昂贵,可以通过回收未参与反应的抗体并重复利用,可以在一定程度上降低检测成本。
虽然免疫印迹的方法在检测花生致敏蛋白试验中有很多优势,但是因为试验操作的原因容易出现多条带、没有条带、背景有黑色斑点、凝胶染色不均匀等现象,影响试验的准确性,所以免疫印迹大多用于致敏蛋白的定性分析。
2.1.3 高效液相色谱与质谱分析
高效液相色谱技术(High pressure liquid chromatography,HPLC)是在经典液相色谱的基础上,加入气相色谱理论与技术而发展起来的一项新技术。质谱检测花生致敏蛋白主要是根据不同致敏蛋白分子在均匀电场中停留时间不同,进而达到分离鉴定的目的。
液相色谱-质谱联用(LC-MS/MS)是将复杂样品经过液相色谱分离后,再用质谱仪进行检测定性的技术。将二者的分离功能和定性功能结合起来,对于复杂的混合物也可以很好地进行定性和定量。并且样品的前处理过程简化了,能够快速检测样品,操作也比较简单。洪宇伟等人[35]运用液相色谱-质谱联用技术检测花生中Ara h2致敏蛋白,其检测限可达6.23 μg/g,回收率达到107.0%~113.2%。
此方法可对花生致敏蛋白实现快速定性、定量分析,检测结果准确可靠,但是由于对样品和操作的要求比较高,仪器比较昂贵,使得其应用受到限制。
2.1.4 表面等离子共振
表面等离子共振(Surface plasmon resonance,SPR)是一种物理光学现象,是根据金属纳米粒子表面附着不同物质导致折射率发生变化,其折射率的变化和待分析物质量呈一定线性关系,利用此原理可实现对待分析物质准确的定性、定量分析。与其他检测方法相比,SPR具有体积更小、成本更加低廉、响应速度较快和抗干扰能力强等优点,可以实现对样品的实时在线检测[36]。Pollet J等人[37]结合SPR法与纳米磁珠抗体提取技术,快速准确检测巧克力中花生过敏原Ara h1,其检测限为0.09 μg/mL。由于SPR也采用免疫学抗原抗体特异性结合的原理,所以也会出现假阳性、假阴性等影响试验准确性的结果。
2.2 基于致敏原成分基因的检测方法
2.2.1 聚合酶链反应
一些花生致敏蛋白虽然由于结构的原因,可以在高温环境下保持活性,但是在花生实际的加工生产过程中会经过一系列复杂的加工方式,可能会使花生致敏蛋白的结构受到破坏,免疫活性降低,此时再用抗原抗体特异性结合的传统方法将会使试验结果出现偏差,但普通的加工处理不能破坏花生致敏蛋白的DNA,因此可以通过PCR法来检测花生致敏蛋白的基因。应用PCR技术扩增食品中花生源性物质的DNA片段,通过凝胶电泳得到DNA图谱,最后通过对比来判断扩增结果。经过多年的研究发展,传统PCR技术已经很成熟,近年来新研发的Real-time PCR更加方便快捷,在检测花生致敏蛋白方面有着广泛的应用,且灵敏度高、特异性强等[38]。
Houhoula D等人[39]采集了152份样品,采用实时PCR方法进行分析。结果表明,花生样品中有125份(83%)呈阳性。因此,实时PCR技术是快速检测和定量食品致敏蛋白的重要手段。另外,也有研究人员采用复合引物技术设计了一个竞争性内扩增控制,建立了花生致敏蛋白Ara h1 DNA的实时PCR检测方法,其检出限为0.005%,表明该方法对食品中花生成分的检测具有较高的灵敏度。
目前使用PCR检测花生过敏原由于容易出现假阴性和假阳性的现象,对于PCR技术在检测花生致敏蛋白的推广还具有一定的局限性。
2.2.2 实时荧光聚合酶链反应
实时荧光聚合酶链反应技术就是在原本的PCR反应体系中加入荧光物质,其中Taqman探针法和SYBR Green I荧光染料法是常用的荧光标记方法。此方法通过荧光信号量的积累来实现监测PCR进程,以达到检测花生致敏蛋白特异性基因的目的。陈家杰等人[40]利用SYBR Green I实时荧光PCR法检测花生致敏蛋白。对8种花生食品进行检测,结果8种食品中的成分均与标签相符,证明此方法可用于食品中花生致敏蛋白的检测。
基于基因方面的检测具有极高的灵敏度和准确度,但是,一些试验证明某些加工处理可除去花生中的部分致敏蛋白,但残留的致敏基因仍能使试验结果呈阳性,出现错误的检测结果,这是基因检测手段存在的弊端。
3 结语
食品导致过敏的事件越来越多,并且复杂的加工生产方式使得致敏物质更加难以检测。因此,建立食品中花生致敏蛋白检测技术,对保障花生过敏人群生命安全具有重要性。介绍了花生中的主要致敏蛋白和常见的检测方法,但这些方法或多或少都存在一些不足之处。近年来,上转换材料、荧光量子点、碳点等新型标记材料的广泛使用给花生致敏蛋白检测方法研究提供了新的研究方向。这些新型材料与目前检测技术相结合,能够在一定程度上提高检测方法的灵敏度和特异性,为食品中花生过敏原的检测提供广阔的发展前景。
