含酸敏感化学键的pH敏感性脂质体在肿瘤治疗中研究进展
2019-04-12龚晨廉明明张大鹏王娜彭海生
龚晨,廉明明,张大鹏,王娜,彭海生
含酸敏感化学键的pH敏感性脂质体在肿瘤治疗中研究进展
龚晨,廉明明,张大鹏,王娜,彭海生
150076 黑龙江,哈尔滨商业大学生命科学与环境科学研究中心(龚晨);163319 黑龙江,哈尔滨医科大学大庆校区药学院(廉明明、张大鹏、王娜、彭海生)
化学药物治疗简称化疗,是癌症治疗的有效手段之一,阿霉素(doxorubicin,DOX)、紫杉醇(paclitaxel,PTX)等用于化疗的细胞毒性物质可显著改善癌症患者的生活质量[1]。但多数成药的细胞毒性成分对肿瘤细胞选择性差,且存在非靶向性的全身副作用。迄今为止,这些问题仍然是化学治疗的主要瓶颈[2]。为了提高肿瘤细胞选择性,改善抗癌疗效,多功能纳米系统研发受到了普遍关注[3]。常见的药物递送系统包括:胶束[4]、脂质体[5]、金属纳米粒子[6]、二氧化硅粒子等[7]。
脂质体是一种粒径分布在 100 nm 左右,具有磷脂双分子层结构,用于药物递送和成像应用的超分子纳米载体[8]。脂质体递送药物的优点有以下几点:①能够提高包封药物的溶解度;②能够提高药物稳定性,防止药物发生降解;③具有被动靶向能力(enhanced permeability and retention effect,EPR效应),减少包封药物的非特异性副作用和毒性,提高其疗效及治疗指数;④通过化学修饰,在脂质体表面连接特异性配体,使药物具有主动靶向性;⑤与多种生物材料有较高的相容性。基于脂质体的以上性质,使得其在临床试验中有广泛应用,脂质体制剂通过使用被动和主动靶向策略,增加癌细胞中药物的细胞内浓度,同时最小化正常细胞中的毒性,从而增强抗癌作用并降低全身毒性[9]。
正常组织与血液的 pH 值在 7.0 ~ 7.4 之间,而癌细胞在需氧或厌氧条件下都有很高的糖酵解速率,糖酵解使葡萄糖转化为乳酸,从而导致肿瘤细胞周围的 pH 低于正常组织呈现酸性。已经证明肿瘤组织具有 5.7 ~ 7.0 的酸性 pH 值,内体和溶酶体则具有更低的 pH 值,在 4.5 ~ 5.5 范围内。用于癌症治疗的药物和载体通过胞吞作用内化进入肿瘤细胞,随后被内体和溶酶体捕获,因此常常设计 pH 敏感的药物递送系统应用于抗癌药物的肿瘤细胞递送[10]。通常基于以下两种策略设计并制备 pH 敏感性脂质体。
首先,在脂质体制备过程中,引入可质子化或可去质子化的脂材,常用的可质子化基团包括氨基、咪唑基等,可去质子化基团包括磺酸酯和羧基等。以酸性基团为例,在生理 pH 条件下,脂材中酸性基团保持阴离子化状态,而在弱酸性条件下,阴离子转变为游离酸,导致脂材的溶解性、空间构象、排列方式等发生转变,最终使脂质体的结构通过磷脂双分子膜转变,释放包封药物,实现药物对肿瘤组织的靶向释放。例如,最为常见的可质子化脂材胆固醇半琥珀酸酯(cholesteryl hemisuccinate,CHEMS),与含不饱和双键的二油酰磷脂酰乙醇胺(dioleoyl phosphoethanolamine,DOPE)共同构建的脂质体就具有酸敏感下触发释放特性[11]。
另外,酸敏感化学键已被广泛用于制备具有酸敏感特性的纳米药物递送系统。例如,Liu 等[12]综述了相关研究进展,这种基于化学键断裂的药物释放,具有稳定性高,释放速度快等优点,常见的可断裂结构见表 1。其中 pH 敏感性的腙键、醚键和原酸酯结构在 pH 敏感性脂质体中的应用已有报道。这些化学键或结构在中性和碱性环境中稳定,在酸性环境下易水解断裂,应用该化学变化实现脂质体的触发释放。按触发策略的不同主要分为两类:一类是利用酸敏感化学键触发调控预留在脂质体表面的肽类细胞活性物质,如细胞穿透肽,最终提高包载药物的靶向性;另一类是在制备脂质体脂材结构中引入酸敏感化学键,通过脱除聚乙二醇保护链或改变脂材构象等方式,提高肿瘤对药物的摄取。本综述将根据以上两种分类方式介绍含酸敏感化学键的 pH 敏感性脂质体研究进展。
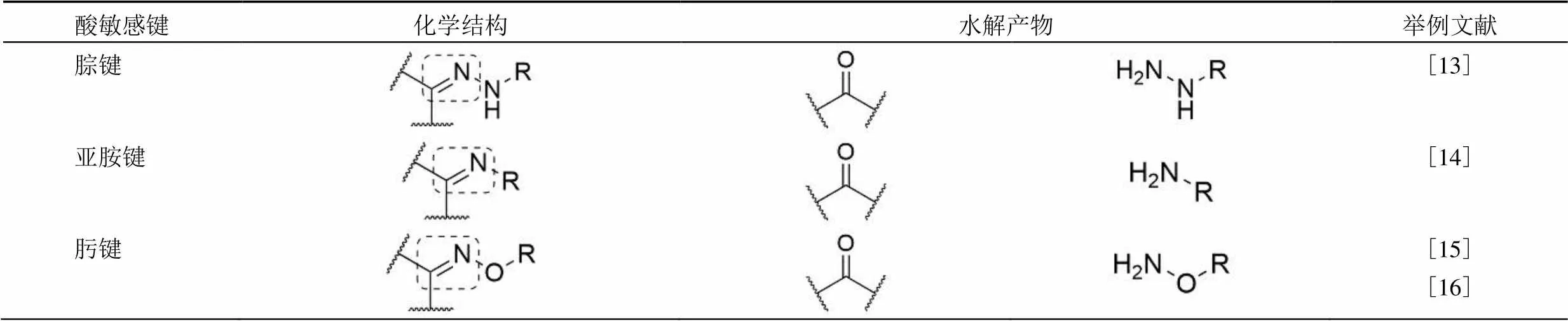
表 1 酸敏感化学键及其水解产物
续表 1
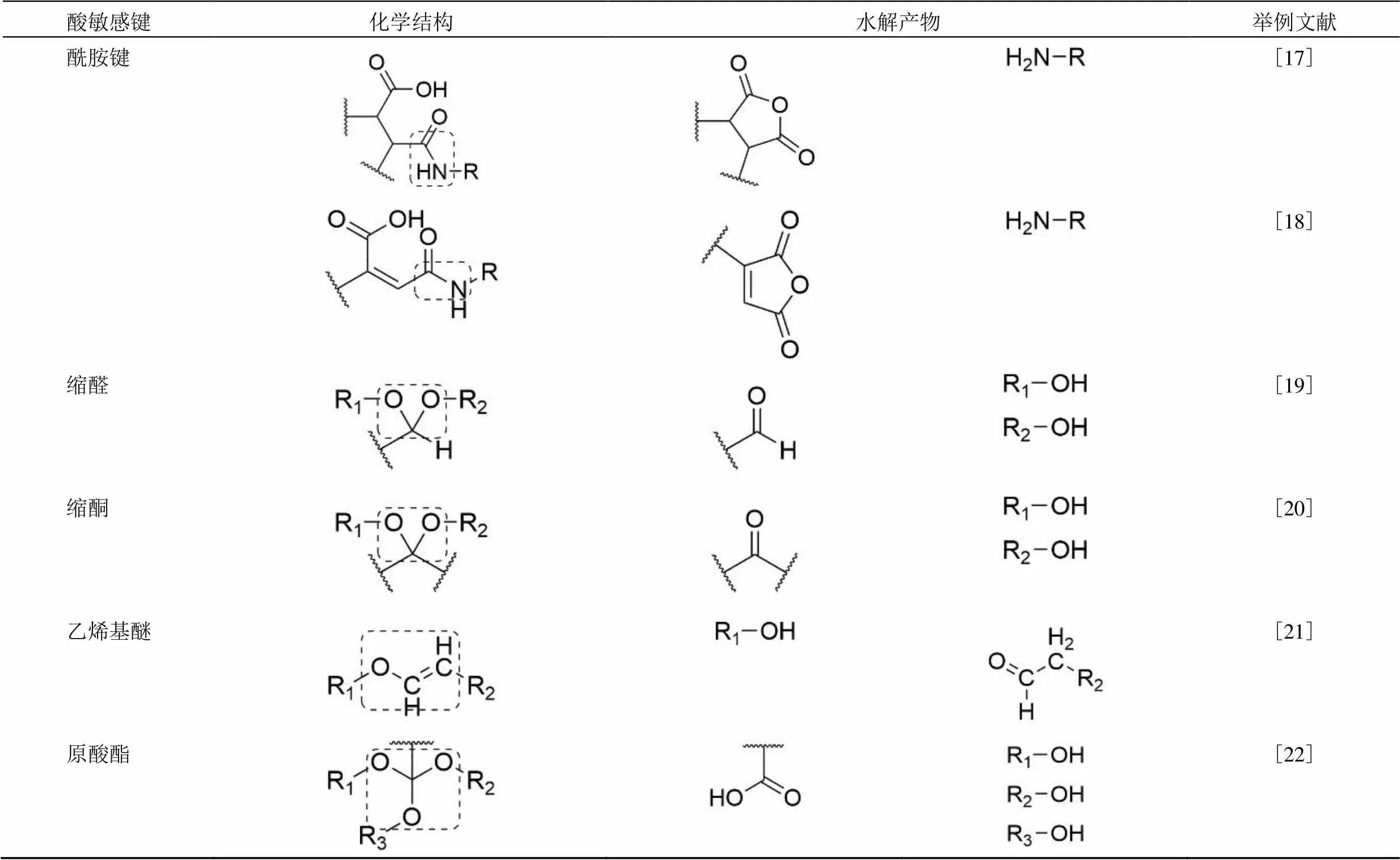
酸敏感键化学结构水解产物举例文献 酰胺键[17] [18] 缩醛[19] 缩酮[20] 乙烯基醚[21] 原酸酯[22]
1 含酸敏感化学键的肽类修饰脂质体
细胞穿透肽(cell penetrating peptides,CPP)是一类能够穿过细胞膜被细胞吸收的相对短的阳离子或两亲性肽,CPP 修饰的脂质体可提高细胞对纳米颗粒的摄取,是药物载体在输送过程中,克服细胞障碍的有效修饰方法之一[23]。然而 CPP 的细胞穿透性并不对肿瘤细胞具有特异性,使得 CPP 促进肿瘤细胞药物摄取的有效性受到限制。为了提高 CPP 修饰脂质体的靶向性,可通过某种方式使 CPP 片段在到达肿瘤部位前,一直处于屏蔽状态,降低其穿透正常组织细胞产生的不良反应。当脂质体到达肿瘤部位后,应用肿瘤的酸性微环境,触发酸敏感化学键断裂实现 CPP 去屏蔽。最终载药纳米粒子被表面修饰的活性 CPP 带入细胞内部,实现靶向给药[24]。
1.1 通过长链聚乙二醇调节脂质体表面细胞穿透肽活性
Koren 等[25]设计并验证了一种多修饰的脂质体纳米载体,其表面装载了肿瘤特异性抗体 mAb(2C5)、具有细胞穿透活性的 TAT 肽(transcription activator,TAT),以及通过 pH 敏感腙键连接的长链聚乙二醇(polyethylene glycol,PEG)(图 1)。其中 mAb(2C5)抗体通过 PEG3400与脂质体相连接,TAT 肽通过 PEG1000与脂质体相连接,而酸敏感化学键连接的 PEG 分子则为 PEG2000。PEG 连接臂最长的 mAb(2C5)抗体暴露在脂质体粒子最外层,能够特异性识别肿瘤细胞表面对应抗原,实现脂质体的靶向作用。与酸敏感腙键相连的 PEG2000 可以延长脂质体的血液循环,并在非肿瘤环境下通过物理方式屏蔽最内层的 TAT肽,使得该纳米粒子在体内循环过程中,不表现出细胞穿透活性。当该纳米粒子通过 mAb(2C5)抗体锚定到肿瘤细胞后,由于肿瘤的酸性微环境,腙键水解使长链 PEG2000 与脂质体断开,裸露的 TAT 肽发挥细胞穿透活性,促进脂质体进入肿瘤细胞。在体外细胞实验中通过流式细胞仪和荧光显微技术观察到修饰后的脂质体有更强的细胞摄取能力。此外,还发现预暴露于较低 pH 环境中的包载阿霉素的脂质体的细胞毒性增加,证实 TAT 肽的去屏蔽的有效性。
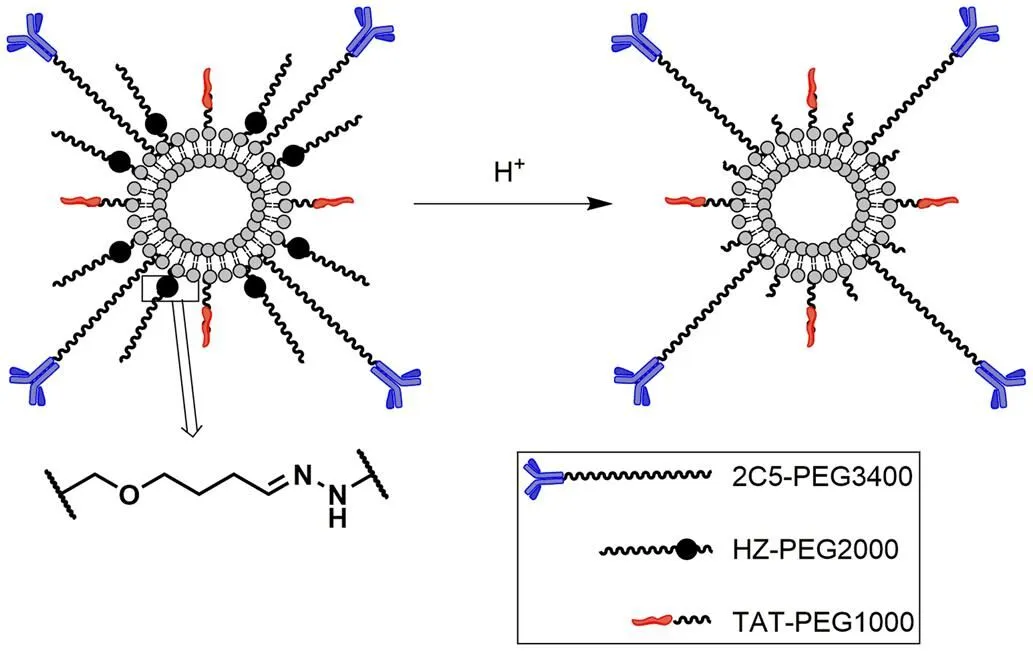
图 1 含酸敏感化学键和 TAT 肽的多功能 PEG 化脂质体
胶原蛋白 I 通过细胞基质与肿瘤细胞连接,是功能性纳米颗粒的固有运输屏障。在治疗前破坏胶原蛋白 I 可改善纳米颗粒在肿瘤中的渗透。Zhang 等[26]利用肿瘤酸性环境构建了pH 敏感性脂质体药物递送系统(Cl-Lip),其表面修饰了具有细胞穿透活性的 R8 肽(通过 PEG2000 与脂质体相连),以及通过 pH 敏感腙键与脂质体连接的 PEG5000(图 2)。在治疗乳腺癌前先使用能降解胶原蛋白 I 的游离氯沙坦,在氯沙坦显著消耗具有肿瘤保护作用的胶原蛋白 I 后,再给药 pH 敏感性脂质体,随后脂质体通过 EPR 效应蓄积到肿瘤组织时,长链 PEG 由于腙键的水解而与脂质体断开,同时将 R8 肽暴露在肿瘤细胞外,脂质体通过 R8 肽的介导而内化到肿瘤细胞中。随后验证了附载紫杉醇的 Cl-Lip 对 4T1 乳腺癌荷瘤小鼠有高肿瘤靶向性和细胞内化能力,这使其在乳腺癌治疗中具有更好的抗肿瘤效果。
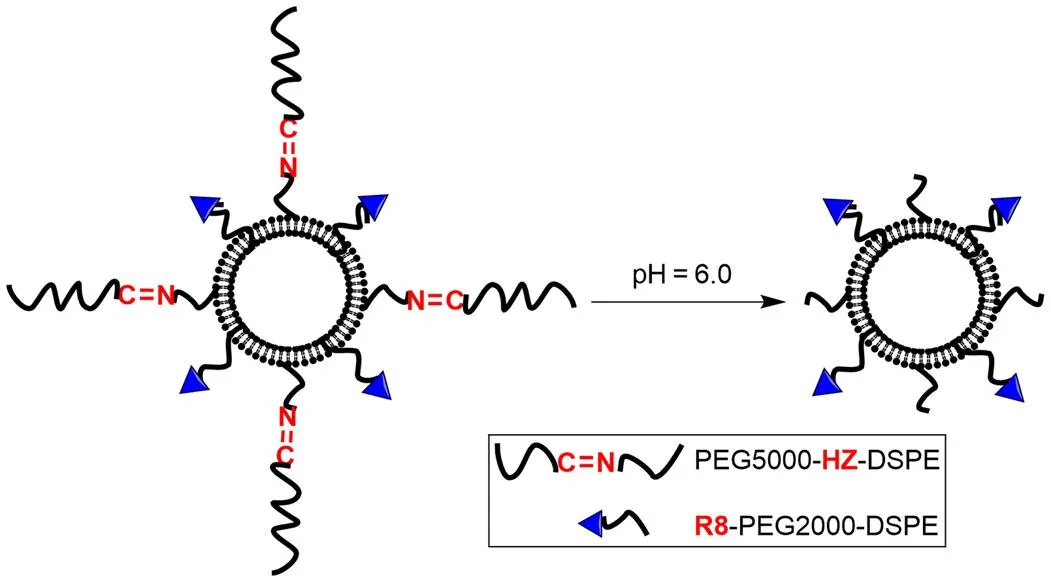
图 2 具有酸敏感键的 PEG 和 R8 肽修饰的脂质体
1.2 通过复合肽调节脂质体表面细胞穿透肽活性
Xiang 等[27]设计了一种 pH 敏感的可控制激活的细胞穿透肽复合物(activatable cell-penetrating peptide,ACPP),它由具有细胞穿透活性的 R8 肽、酸敏感腙键以及聚阴离子抑制肽相互连接而成(图 3)。将 ACPP 修饰在包裹有小干扰 RNA(small interfering RNA,siRNA)的脂质体表面,可以增强 siRNA 的生物稳定性及细胞摄取。在体循环 (pH = 7.4)中,聚阴离子抑制肽中存在酸性氨基酸残基,如谷氨酸和组氨酸残基,由于其较低的 pKa 值而带负电,导致 R8 肽表面碱性氨基酸(精氨酸)的聚阳离子部分被静电相互作用屏蔽。脂质体通过 EPR 效应在 pH 降低的肿瘤组织中累积后,脂质体表面的 ACPP 由于酸催化的腙键水解而发生断裂,抑制肽与 R8 肽分离。此外,从 ACPP 上断裂下来的抑制肽由于具有组氨酸残基,可捕获酸性环境中的质子,提高了屏蔽域阴离子浓度,这会进一步促进 ACPP 上的腙键水解,加速激活 R8 肽活性。随后去屏蔽的 R8 肽将促进脂质体的细胞膜穿透和溶酶体逃逸。在 MCF-7 和 A549 细胞中均观察到 siRNA 的溶酶体逃逸和有效的细胞质释放。鉴于其酸敏感性和治疗效力,这种新开发的 pH 敏感性 ACPP 介导的脂质体系统可作为基于 siRNA 治疗癌症的有效药物递送平台。
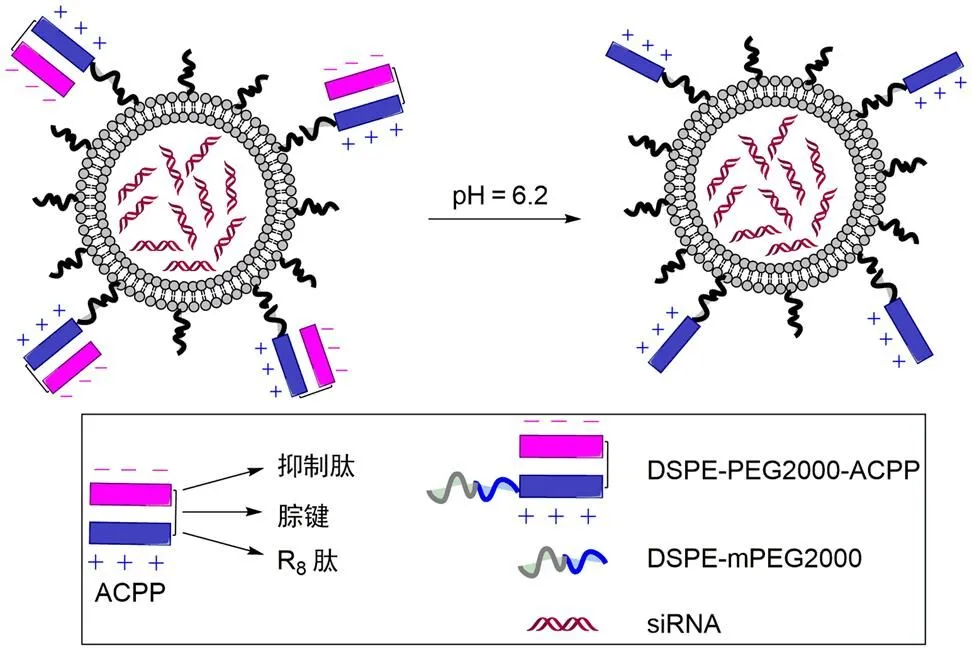
图 3 用于递送 siRNA 的 pH 敏感性可控制激活的细胞穿透肽修饰的脂质体
1.3 通过释放脂质体表面肽激活肽活性
内吞作用是脂质体进入肿瘤细胞的重要方式之一,进入细胞后,脂质体会被内体包裹,影响载药释放。要进一步发挥药效,脂质体需从内体中逃脱。蜂毒肽是来自于天然蜂毒的含 26 个氨基酸的多肽,具有很高的生物膜裂解活性。Oude Blenke 等[28]发现蜂毒肽的 N 端与脂质体通过不可断裂化学键相连后,肽的膜裂解活性被显著抑制。应用该抑制现象,设计制备了一种对正常细胞膜安全,但可逃逸内体膜的表面肽修饰脂质体(图 4)。该脂质体表面通过腙键与蜂毒肽的 N 端连接,连接的蜂毒肽在体内运输过程中并无膜裂解活性。但被肿瘤细胞摄取进入内体后,由于内体 pH = 5.6 的酸环境,腙键水解使蜂毒肽从脂质体表面脱落,裂解内体膜,完成脂质体的内体逃逸。
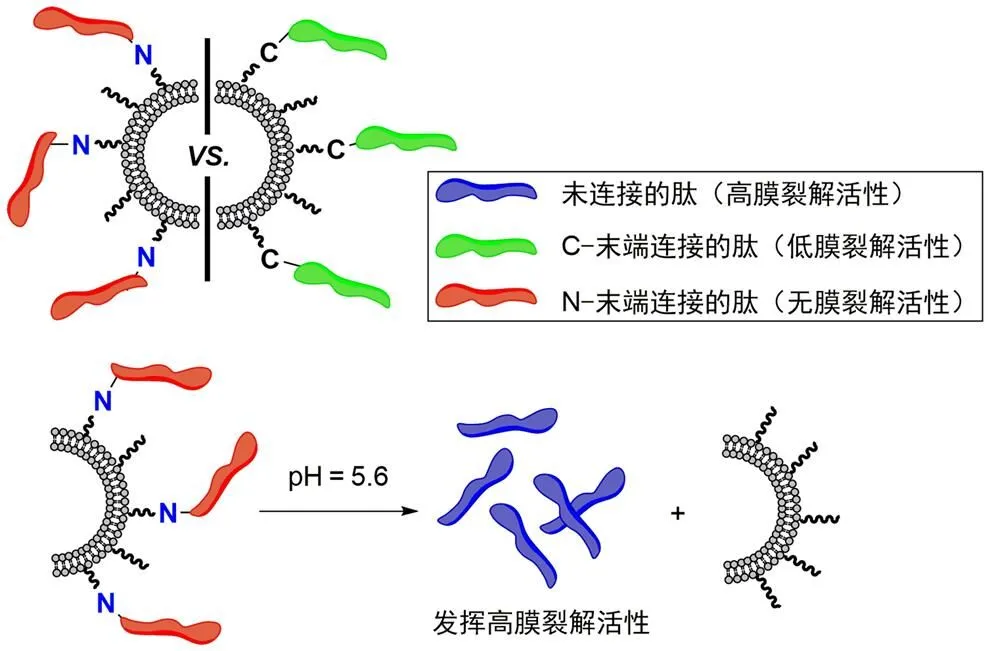
图 4 以酸性 pH 为触发条件从脂质体表面激活并释放蜂毒肽
2 用含酸敏感化学键的脂材构建pH 敏感性脂质体
在磷脂或胆固醇等脂材结构中插入酸敏感化学键,酸性环境中,组成脂质体的脂材由于酸敏感化学键的断裂,会导致磷脂双分子层结构被破坏,或者脱除对脂质体表面具有保护作用的聚乙二醇链,促进药物释放或增强细胞摄取。在脂质体制备中,最常用的酸敏感化学键包括原酸酯、腙键和醚键。
2.1 原酸酯结构
原酸酯是羧酸的水合物形成的酯类,即在同一碳原子上连有三个烷氧基的有机化合物。其在酸性条件下会分解为羧酸和醇类。Huang 等[29]以原酸酯为原料合成了原酸酯磷酸胆碱(OEPC),这种脂材在 pH = 8.5 的缓冲液中可以自发形成脂质体(图 5)。在酸性环境中,原酸酯的酸水解会将 OEPC 从双链两亲物转化为单链溶血磷酸胆碱(溶血 PC),将 OEPC 脂质体转化为溶血 PC 胶束。随着 OEPC 脂质体的崩解,释放载药。应用 8-氨基萘-1,3,6-三磺酸(ANTS)与对二甲苯双吡啶鎓溴化物(DPX)之间的荧光淬灭特性证实了 OEPC 脂质体的 pH 敏感性。并随后指出 OEPC 脂质体的酸水解主要分为延迟阶段和爆发阶段。延迟时间阶段的裂解速度随着 pH 的降低而缩短;爆发阶段的裂解速度快,不受 pH 的影响。
Guo 等[30]将聚乙二醇通过原酸酯键与二硬脂酰甘油连接,制备了酸敏感脂材(POD),并与 DOPE 联用制备脂质体(图 6)。由于相邻的 DOPE 之间,亲水性氨基头部与另一分子 DOPE 上的磷酸基之间会因正负电荷产生强烈的相互作用,使 DOPE 分子头部互相聚集而难于形成磷脂双分子层结构。混有 POD 的 DOPE 脂质体,在中性 pH 下,POD 能提供空间位阻以防止 DOPE 之间的相互接触。当 pH 降低时,原酸酯水解使得 POD 结构断裂,丧失空间间隔作用,导致 DOPE 发生形变从而引发脂质体内容物渗漏。随后使用 ANTS/DPX 渗漏测定和脂质混合测定研究了 pH 引发的 POD/DOPE 脂质体去稳定化的动力学。当酸催化水解导致脂质体表面 POD 的摩尔百分比降低,引发囊间脂质混合,导致内容物释放爆发。
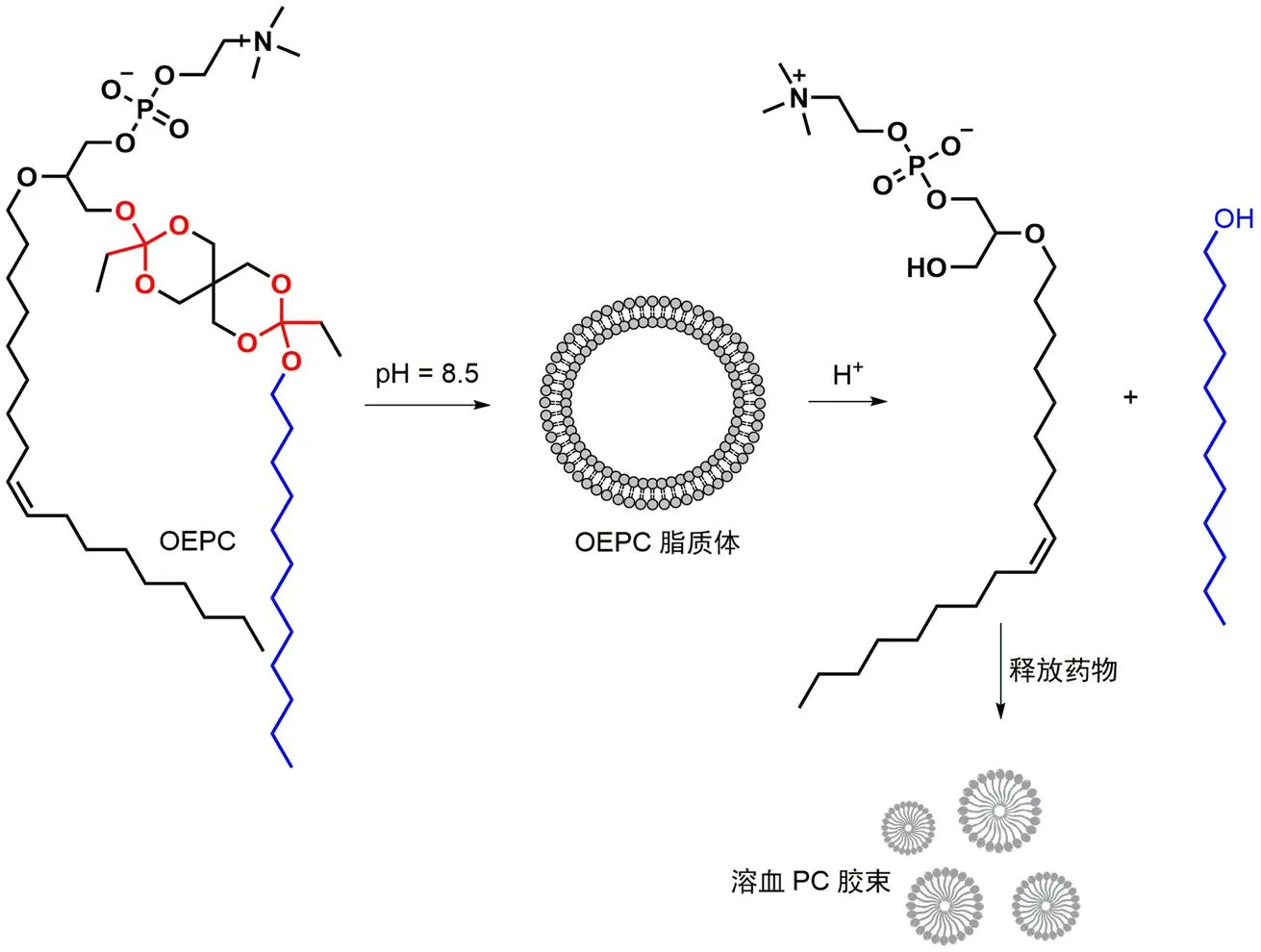
图 5 OEPC 脂质体的酸敏感转化
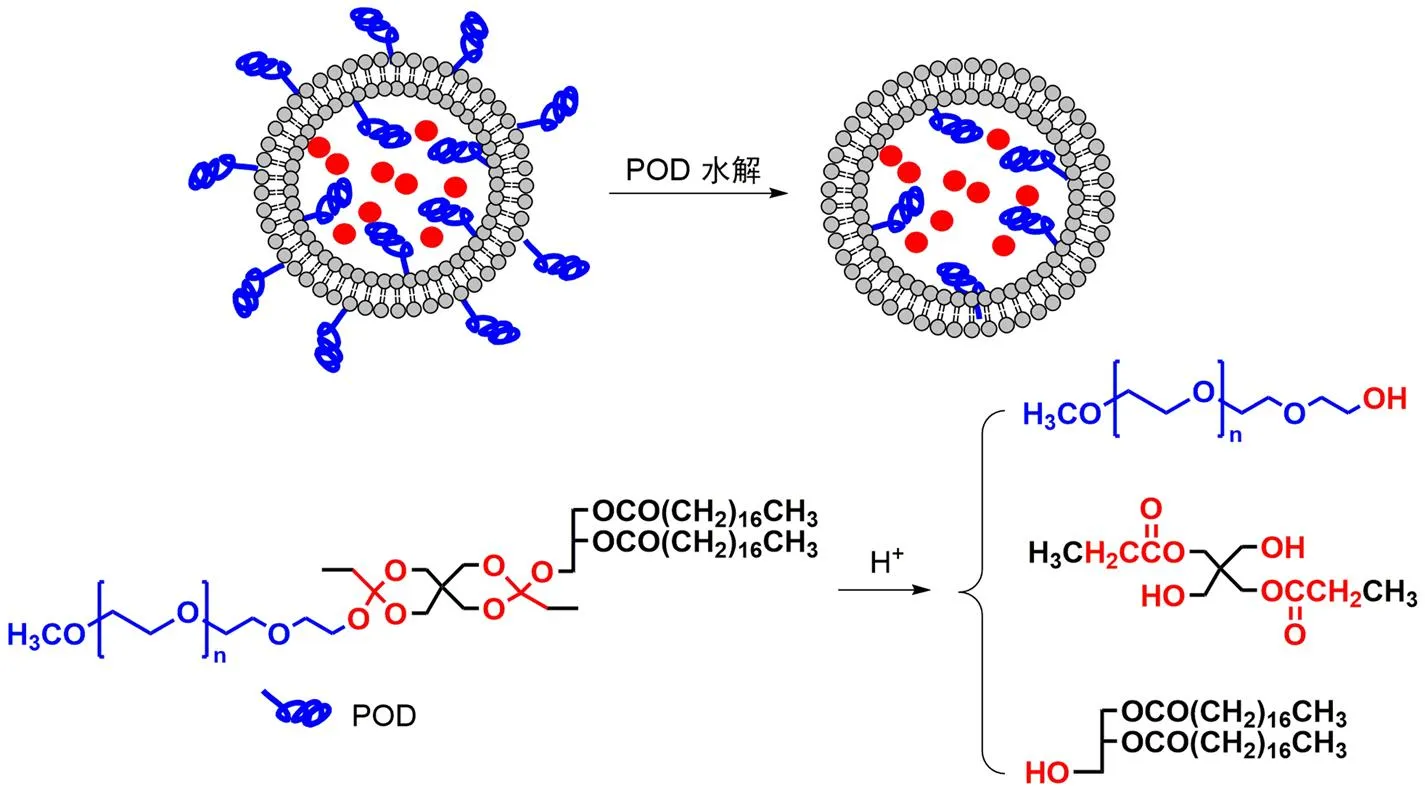
图 6 POD/DOPE 脂质体的 pH 敏感性机制
2.2 腙键
聚乙二醇化的脂质体具有长循环特性,但该保护链的存在限制了肿瘤细胞对脂质体的后期摄取。当 PEG 修饰脂质体通过被动或主动策略安全到达肿瘤部位后,周围酸性微环境水解脂质体表面的酸敏感化学键,剥离保护的聚乙二醇,可实现肿瘤细胞对脂质体的高效吸收。
腙(hydrazone,HZ)是肼与醛或酮缩合产生的一类化合物,其 C=N 键具有酸性易水解特性。Kanamala 等[31]设计合成了一种 pH 敏感性脂材,将聚乙二醇通过腙键与胆甾醇半琥珀酸酯(PEG-HZ-CHEMS)连接,并与 DOPE 制备了双重 pH 敏感性脂质体(图 7)。当脂质体通过 EPR 效应被动靶向到肿瘤细胞后,腙键由于酸性 pH 而发生水解,使 PEG 脱离脂质体表面,增强了肿瘤细胞对脂质体的细胞摄取。酸性环境随后导致余下的 CHEMS 发生质子化,使 CHEMS 与 DOPE 组成的脂质体双层结构被破坏,引起脂质体的裂解,进而释放包封药物。与不具备 PEG 断裂功能的一般 DOPE/CHEMS 脂质体相比,双重 pH 敏感性脂质体在 pH = 5 时药物释放速度更快,能更有效地释放其荧光负载,细胞毒性实验显示其有更强的细胞毒性。
Nie 等[32]通过吡啶基腙键将巯基吡啶聚乙二醇(OPSS-PEG)与胆固醇(CHOL)偶联,制备了包载聚乙烯亚胺(PEI)和 DNA 的 pH 敏感性脂质体(图8)。PEG-HZ-CHOL 的结构中另含有吡啶基二硫键,可与含巯基的荧光染料或靶向性基团相连,实现对脂质体的监测及给药靶向性。利用酸性环境中腙键水解特性使脂质体在肿瘤周围脱去对其有保护作用的 PEG 链,从而增强细胞对脂质体的摄取,提高基因转染效率。通过流式细胞术和共聚焦扫描显微镜,证实了增强的转染效率是由于脂质体表面的 PEG 分离所致。
2.3 醚键
乙烯基醚键(vinyl ether,VE)在酸性条件下饱和 C-O 键一侧会发生水解断裂,生成对应的醇和醛。应用该化学特性,Shin 等[33]将 PEG 与双油酸甘油酯通过乙烯基醚键相连,根据 PEG 链长度和乙烯基醚键连接位点的不同,设计合成了 4 种酸敏感脂材(ST302、ST305、ST352 及ST355),并利用这 4 种脂材分别与 DOPE 联用制备脂质体(图 9)。通过钙黄绿素释放动力学实验发现,ST352、ST355 构建的脂质体更利于钙黄绿素的释放。由于 ST352、ST355 结构中的磷酸基团加速了乙烯基醚氧原子的质子化速率,使该结构更易于酸性条件下释放聚乙二醇的保护链,从而增加肿瘤细胞对脂质体的摄取。这项研究证明在脂质体膜表面存在负电荷可以加速酸催化乙烯醚基水解,提高药物的靶向性。
Kim 等[34]将聚乙二醇单甲醚(mPEG)与 1,3-双十八烷基外消旋甘油(DOG)通过苯基取代的乙烯基醚(PIVE)连接,并利用这种 pH 敏感性脂材,与 DOPE 共同制备用于基因递送的脂质体(图 10)。合成 6 种在苯环上含有不同取代基的 mPEG-PIVE-DOG,在 pH 4.2、5.4 和 7.4 三种条件下,对这 6 种脂材的水解研究表明 PIVE 的水解速率受苯环上取代基的电子效应影响。体外转染实验发现甲氧基取代的 PIVE 在 HEK 293 和 COS-7 细胞上显示出更高的转染效率。
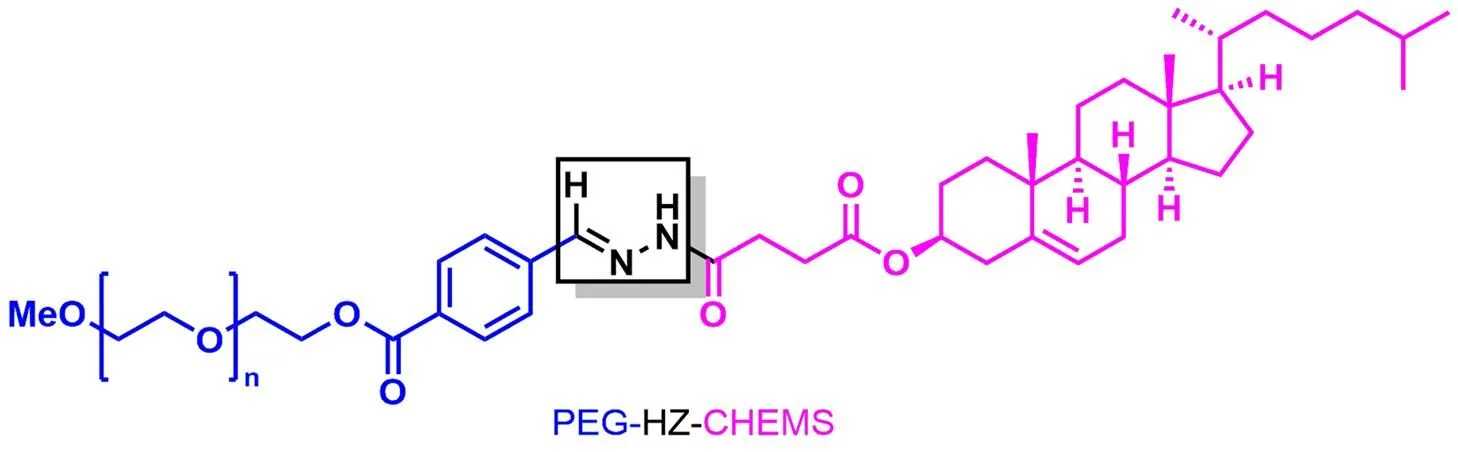
图 7 PEG 通过腙键与 CHEMS 连接合成 pH 敏感性脂材
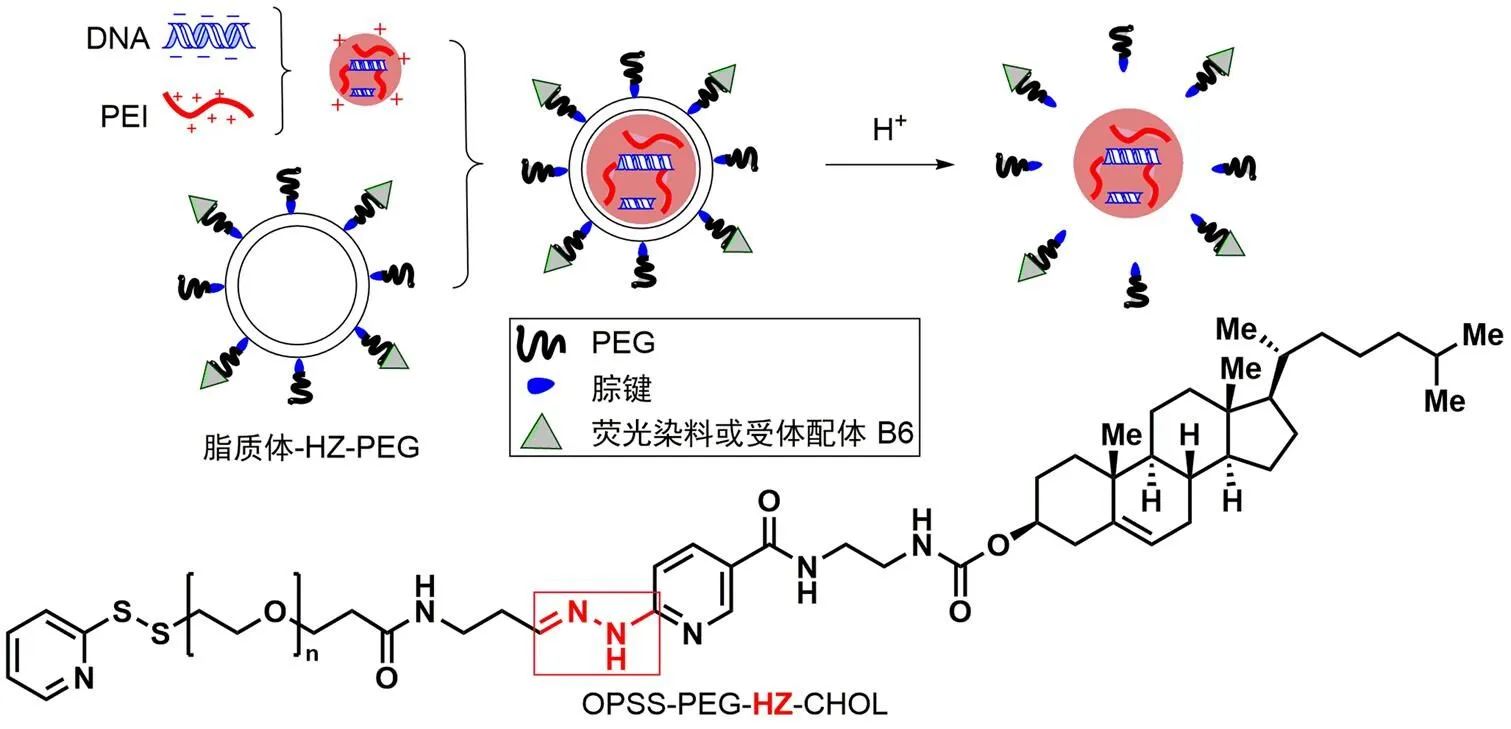
图 8 基于吡啶基腙键的 PEG 化 pH 敏感性脂质体

图 9 4 种酸敏感脂材:ST302、ST305、ST352、ST355
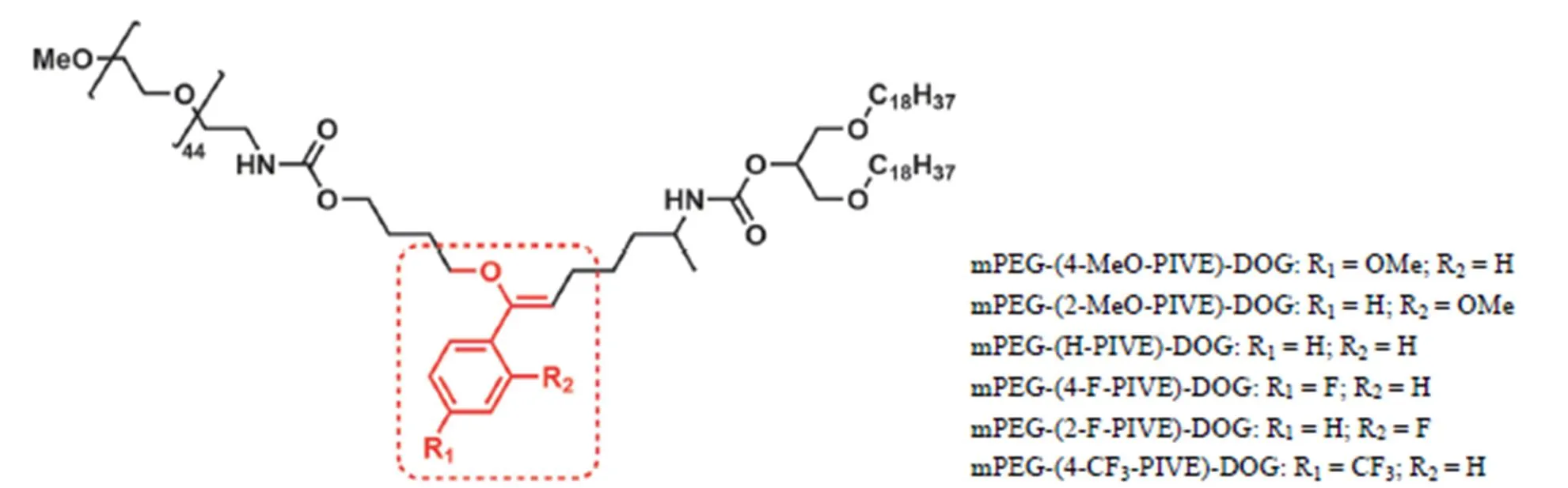
图 10 mPEG-PIVE-DOG 不同取代基的化学结构
3 结语
本综述通过介绍含酸敏感化学键的肽类修饰的脂质体,及非肽类修饰脂质体两个方面,详细介绍了酸敏感化学键在 pH 敏感性脂质体中的应用。pH 敏感性脂质体作为一种药物载体,具有对正常细胞伤害小,持续作用时间长,在肿瘤组织能保持较高的药物浓度,治疗效果显著,靶向性高等特征。但也存在脂质体包封的药物稳定性差和分散度低等问题。除 pH 这种触发因素外,国内外已经研究了内源性刺激如酶活性[35]或氧化还原特性[36]以触发纳米载体的释放。另一方面,外源性刺激例如温度[37]、超声[38]、光[39]、磁[40]和电化学[41]触发,也被用作纳米载体的触发因素。随着科研技术水平的提高,相信会有更多更有效的药物递送系统用作临床使用,肿瘤的靶向治疗水平也能达到新的高度。
[1] Cao Y, DePinho RA, Ernst M, et al. Cancer research: past, present and future. Nat Rev Cancer, 2011, 11(10):749-754.
[2] Rothenberg ML, Carbone DR, Johnson DH. Improving the evaluation of new cancer treatments: challenges and opportunities. Nat Rev Cancer, 2003, 3(4):303-309.
[3] Haley B, Frenkel E. Nanoparticles for drug delivery in cancer treatment. Urol Oncol, 2008, 26(1):57-64.
[4] Kim S, Shi YZ, Kim JY, et al. Overcoming the barriers in micellar drug delivery: loading efficiency, in vivo stability, and micelle-cell interaction. Expert Opin Drug Deliv, 2010, 7(1):49-62.
[5] Sercombe L, Veerati T, Moheimani F, et al. Advances and challenges of liposome assisted drug delivery. Front Pharmacol, 2015, 6:286.
[6] Li JC, Rao JH, Pu KY. Recent progress on semiconducting polymer nanoparticles for molecular imaging and cancer phototherapy. Biomaterials, 2018, 155:217-235.
[7] Castillo RR, Colilla M, Vallet-Regí M. Advances in mesoporous silica-based nanocarriers for co-delivery and combination therapy against cancer. Expert Opin Drug Deliv, 2017, 14(2):229-243.
[8] Pattni BS, Chupin VV, Torchilin VP. New developments in liposomal drug delivery. Chem Rev, 2015, 115(19):10938-10966.
[9] Wang X, Wang Y, Chen ZG, et al. Advances of cancer therapy by nanotechnology. Cancer Res Treat, 2009, 41(1):1-11.
[10] Karve S, Bandekar A, Ali MR, et al. The pH-dependent association with cancer cells of tunable functionalized lipid vesicles with encapsulated doxorubicin for high cell-kill selectivity. Biomaterials, 2010, 31(15):4409-4416.
[11] Monteiro LOF, Malachias Â, Pound-Lana G, et al. Paclitaxel-loaded pH-sensitive liposome: new insights on structural and physicochemical characterization. Langmuir, 2018, 34(20):5728-5737.
[12] Liu J, Huang Y, Kumar A, et al. pH-Sensitive nano-systems for drug delivery in cancer therapy. Biotechnol Adv, 2014, 32(4):693-710.
[13] Sun TM, Wang YC, Wang F, et al. Cancer stem cell therapy using doxorubicin conjugated to gold nanoparticles via hydrazone bonds. Biomaterials, 2014, 35(2):836-845.
[14] Jain NK, Tare MS, Mishra V, et al. The development, characterization and in vivo anti-ovarian cancer activity of poly(propylene imine) (PPI)-antibody conjugates containing encapsulated paclitaxel. Nanomed-Nanotechnol, 2015, 11(1):207-218.
[15] Szabó I, Manea M, Orbán E, et al. Development of an oxime bond containing daunorubicin-gonadotropin-releasing hormone-III conjugate as a potential anticancer drug. Bioconjug Chem, 2009, 20(4):656-665.
[16] Jin Y, Song L, Su Y, et al. Oxime lnkage: a robust tool for the design of pH-sensitive polymeric drug carriers. Biomacromolecules, 2011, 12(10):3460-3468.
[17] Deng H, Liu J, Zhao X, et al. PEG-b-PCL copolymer micelles with the ability of pH-controlled negative-to-positive charge reversal for intracellular delivery of doxorubicin. Biomacromolecules, 2014, 15(11):4281-4292.
[18] Zloh M, Dinand E, Brocchini S. Aconityl-derived polymers for biomedical applications. Modeling study of cis-trans isomerisation. Theor Chem Acc, 2003, 109(4):206-212.
[19] Gillies ER, Goodwin AP, Fréchet JM. Acetals as pH-sensitive linkages for drug delivery. Bioconjug Chem, 2004, 15(6):1254-1263.
[20] Heffernan MJ, Murthy N. Polyketal nanoparticles: a new pH-sensitive biodegradable drug delivery vehicle. Bioconjug Chem, 2005, 16(6): 1340-1342.
[21] Shin JH, Shum P, Grey J, et al. Acid-labile mPEG-vinyl ether-1,2-dioleylglycerol lipids with tunable pH sensitivity: synthesis and structural effects on hydrolysis rates, DOPE liposome release performance, and pharmacokinetics. Mol Pharm, 2012, 9(11):3266- 3276.
[22] Masson C, Garinot M, Mignet N, et al. pH-sensitive PEG lipids containing orthoester linkers: new potential tools for nonviral gene delivery. J Control Release, 2004, 99(3):423-434.
[23] Farkhani SM, Valizadeh A, Karami H, et al. Cell penetrating peptides: efficient vectors for delivery of nanoparticles, nanocarriers, therapeutic and diagnostic molecules. Peptides, 2014, 57:78-94.
[24] Jiang T, Zhang Z, Zhang Y, et al. Dual-functional liposomes based on pH-responsive cell-penetrating peptide and hyaluronic acid for tumor-targeted anticancer drug delivery. Biomaterials, 2012, 33(36): 9246-9258.
[25] Koren E, Apte A, Jani A, et al. Multifunctional PEGylated 2C5-immunoliposomes containing pH-sensitive bonds and TAT peptide for enhanced tumor cell internalization and cytotoxicity. J Control Release, 2012, 160(2):264-273.
[26] Zhang L, Wang Y, Yang Y, et al. High tumor penetration of paclitaxel loaded pH sensitive cleavable liposomes by depletion of tumor collagen I in breast cancer. ACS Appl Mater Interfaces, 2015, 7(18): 9691-9701.
[27] Xiang B, Jia XL, Qi JL, et al. Enhancing siRNA-based cancer therapy using a new pH-responsive activatable cell-penetrating peptide- modified liposomal system. Int J Nanomedicine, 2017, 12:2385-2405.
[28] Oude Blenke E, Sleszynska M, Evers MJ, et al. Strategies for the activation and release of the membranolytic peptide melittin from liposomes using endosomal pH as a trigger. Bioconjug Chem, 2017, 28(2):574-582.
[29] Huang Z, Guo X, Li W, et al. Acid-triggered transformation of diortho ester phosphocholine liposome. J Am Chem Soc, 2006, 128(1):60-61.
[30] Guo X, MacKay JA, Szoka FC Jr. Mechanism of pH-triggered collapse of phosphatidylethanolamine liposomes stabilized by an ortho ester polyethyleneglycol lipid. Biophys J, 2003, 84(3):1784- 1795.
[31] Kanamala M, Palmer BD, Ghandehari H, et al. PEG-benzaldehyde-hydrazone-lipid based PEG-sheddable pH-sensitive liposomes: abilities for endosomal escape and long circulation. Pharm Res, 2018, 35(8):154.
[32] Nie Y, Günther M, Gu Z, et al. Pyridylhydrazone-based PEGylation for pH-reversible lipopolyplex shielding. Biomaterials, 2011, 32(3): 858-869.
[33] Shin J, Shum P, Thompson DH. Acid-triggered release via dePEGylation of DOPE liposomes containing acid-labile vinyl ether PEG-lipids. J Control Release, 2003, 91(1-2):187-200.
[34] Kim HK, Thompson DH, Jang HS, et al. pH-responsive biodegradable assemblies containing tunable phenyl-substituted vinyl ethers for use as efficient gene delivery vehicles. ACS Appl Mater Interfaces, 2013, 5(12):5648-5658.
[35] Scomparin A, Florindo HF, Tiram G, et al. Two-step polymer- and liposome-enzyme prodrug therapies for cancer: PDEPT and PELT concepts and future perspectives. Adv Drug Deliver Rev, 2017, 118: 52-64.
[36] Luo Z, Cai K, Hu Y, et al. Mesoporous silica nanoparticles end-capped with collagen: redox-responsive nanoreservoirs for targeted drug delivery. Angew Chem Int Ed Engl, 2011, 50(3):640-643.
[37] Berndt I, Popescu C, Wortmann FJ, et al. Mechanics versus thermodynamics: swelling in multiple-temperature-sensitive core-shell microgels. Angew Chem Int Ed Engl, 2006, 45(7):1081-1085.
[38] Yan F, Li L, Deng Z, et al. Paclitaxel-liposome-microbubble complexes as ultrasound-triggered therapeutic drug delivery carriers. J Control Release, 2013, 166(3):246-255.
[39] Ercole F, Davis TP, Evans RA. Photo-responsive systems and biomaterials: photochromic polymers, light-triggered self-assembly, surface modification, fluorescence modulation and beyond. Polym Chem, 2010, 1:37-54.
[40] Zhang CY, Wu D, Lu LJ, et al. Multifunctional hybrid liposome as a theranostic platform for magnetic resonance imaging guided photothermal therapy. ACS Biomater Sci Eng, 2018, 4(7):2597-2605.
[41] Zhang WL, Choi HJ. Fast and facile fabrication of a graphene oxide/titania nanocomposite and its electro-responsive characteristics. Chem Commun (Camb), 2011, 47(45):12286-12288.
国家自然科学基金面上项目(81671814);国家自然科学基金青年基金(21506044);黑龙江省自然科学基金重点项目(ZD2016013);黑龙江省自然科学基金青年基金(QC2015016)
彭海生,Email:fisher1688@163.com
2019-01-14
10.3969/j.issn.1673-713X.2019.02.010
