氮掺杂MnCo2O4/N-KB的制备及氧还原催化性能
2019-04-12吴剑波张晓玲彭超群王日初
冯 艳 吴剑波 张晓玲 彭超群 王日初
(中南大学材料科学与工程学院,长沙 410083)
随着化石能源的枯竭,越来越多的国家开始开发新能源,其中由于金属空气电池的阴极是利用空气中的氧气作为反应物,其作为一种可再生的绿色环保的新能源,受到广泛的研究和关注。金属空气电池在放电过程中最为重要的是起催化氧还原反应的阴极材料。到目前为止,贵金属铂类催化剂仍然是比较常用且活性最好的氧还原阴极催化剂,但是金属铂价格昂贵、数量稀缺、稳定性差等缺点限制了电池的商业性发展。因此,开发廉价的高性能高稳定性的新型氧还原催化材料已经成为空气电池产业开发的一个重要课题。
过渡金属氧化物类催化剂由于其成本相对低廉、稳定性较好,被视为理想的空气阴极材料。金属氧化物中最为常见的为锰氧化物(MnOx)[1-3],此外还包括钴氧化物[4-5]、镍氧化物[6]、铁氧化物[7]、铜氧化物[8]等。制备特殊形态的金属氧化物以提高电催化性能一直是研究热点,如核壳结构的尖晶石金属氧化物。Hua等[9]通过水热-热处理的方法制备出具有微纳米结构和浓度梯度的核壳结构椭圆状的MnCo2O4,其独特的形态和结构使该催化剂具有优异的耐久性。Bai等[10]使用一种种子介导的金属有机骨架的化学配位方法合成了十二面体的MnCo2O4.5中空纳米笼,该催化剂在碱性介质中表现出高ORR和OER催化活性和高稳定性。
除了单一的金属氧化物,尖晶石型金属氧化物与导电性良好的碳材料如碳纳米管,石墨烯等结合,表现出高的稳定性和高的氧还原反应(ORR)活性,对氧还原反应有更高的催化效率。Zhou等采用简单的共沉淀然后热处理的方法合成中空微球形态的ZnMn2O4[11]以及双壳层的中空的微立方体状CoMn2O4[12],其独特的结构特征与石墨烯载体产生强烈的耦合作用,改善了电催化性能和稳定性。Ning等[13]通过两步水热法合成尖晶石CuCo2O4纳米颗粒与N-rGO的复合材料,拥有比商业Pt/C电极更好的活性和持久性。Liang等[14]制备出Mn-Co尖晶石与氮掺杂的石墨烯复合的MnCo2O4/N-rGO,在相同的负载量下,其在中间过电位的电流密度优于Pt/C催化剂,半波电位比Pt/C低20 mV。与传统的石墨烯、碳纳米管、XC-72等碳材料相比,导电碳KB具有低成本、高导电性、高比表面积、独特的物理结构、良好的柔韧性和低密度等优点,是一种性能优良的空气阴极添加剂。Li等[15]以三聚氰胺,乙酸钴四水合物和KB作为原料,通过可扩展的热解方法制备出一种新型Co3O4/Co-N-C改性的KB催化剂,拥有高的比表面积和高的导电性。此外,Nam[16]使用KB和明胶建立了一种易于拓展的氮掺杂碳纳米片层无规则堆叠的结构,与商用导电碳Vulcan-72碳负载的Pt催化剂相比拥有相近的催化活性和更好的稳定性。
目前,氧还原催化材料的主要合成方法有CVD[17]、模板法[18]、溶剂热或水热反应、传统的共沉淀法等。Khilari[19]采用原位沉积的方法制备MnCo2O4纳米管/聚吡咯并用于微生物燃料电池(MFC)的电性能研究,结果表明其ORR催化活性、稳定性与商用Pt/C相当,表现出良好的商业应用潜力。Xia等[20]采取新型的原位封装方法合成了一种Co@Co3O4@CCM(CM指高度有序多孔碳基体)双壳结构的复合材料,该催化剂甚至表现出比商用Pt/C更加优秀的ORR催化活性。尽管这些催化剂已经展示了优秀的催化性能,但在样品的制备工艺中往往涉及复杂的技术、昂贵的原材料和环境污染等问题,如氧化石墨烯的制备、NH3气氛中碳化等,限制了其进一步的工业化应用。
本文在前人的研究基础上,用Mn(Ac)2和Co(Ac)2作为前驱体,以廉价的导电碳KB作为负载碳源,同时以氨水为氮源在KB中进行掺氮,通过简单的水解-水热两步法制备氮掺杂的MnCo2O4/N-KB,得到N-KB骨架上生长MnCo2O4纳米结构的复合材料,通过研究不同比例碳的复合以及N元素的掺杂,对阴极的氧还原催化性能的影响,并分析其作用机制。
1 实验部分
1.1 试剂与仪器
Co(CH3COO)2·4H2O,分析纯,广东华光科技股份有限公司;Mn(CH3COO)2·4H2O,分析纯,上海美心化工有限公司;Ketjenblack炭黑(KB),分析纯,上海瑞邦新能源有限公司;68%~69%(w/w)浓硝酸(HNO3),分析纯,上海美心化工有限公司;30%(w/w)氨水(NH3·H2O),分析纯,广东华光科技股份有限公司。实验用水均为去离子水。
Nova NanoSEM230场发射扫描电子显微镜(SEM,Nova NanoSEM230, 加速电压设为 20 kV);JEM-2100F场发射透射电子显微镜(TEM,日本电子株式会社,加速电压200 kV);ESCALAB250Xi型X射线光电子能谱仪(XPS,美国ThermoFisher-VG Scientific,使用Mg靶Kα辐射,功率为250 W,分析面积为0.8 mm2,样品室真空度为1.6×10-6Pa,元素的结合能用表面吸附碳的C1s峰标定);Advance D8 X射线全自动衍射仪(XRD,瑞士布鲁克公司,Cu靶作为射线发射源,管电压为40 kV,管电流为150 mA,扫描角度为 10°~80°,扫描速度为 8°·min-1);旋转圆盘电极CHI-660E型电化学工作站 (上海辰华仪器股份有限公司)。
1.2 催化剂的制备
碳粉的预处理:称取2.000 g KB,加入50.00 mL浓硝酸中,80℃水浴温度下搅拌处理8 h,过滤、洗涤至中性,110℃下真空干燥12 h,移除部分杂质并增加碳粉表面的含氧官能团。
MnCo2O4/N-KB的合成:称取一定量的KB分散至48.0 mL的无水乙醇(EtOH)中(EtOH),超声0.5 h。第一步,2.2 mL 0.6 mol·L-1Co(OAc)2溶液和 4.3 mL 0.6 mol·L-1Mn(OAc)2溶液加入至48.0 mL含KB的EtOH分散液中,随后,依次加入2.4 mL蒸馏水和4.0 mL 30%(w/w)氨水,于80℃水浴温度下搅拌20 h;将混合物转移至不锈钢反应釜中,150℃下反应3 h,将得到的产物通过离心分离,用去离子水和无水乙醇清洗3遍,80℃真空干燥。初始的反应物中MnCo2O4与 KB 的质量比分别设置为 10∶90、20∶80、30∶70、40∶60、50∶50。产物依次记为 x%MnCo2O4/N-KB(x=10,20,30,40,50)。 后续为了对比,没有负载 KB的MnCo2O4制备方法和上面相同,只是乙醇溶液中不加碳粉,记为MnCo2O4;未掺N的样品制备过程与10%MnCo2O4/N-KB一致,只是不加入氨水,记为MnCo2O4/KB; 将KB和MnCo2O4按质量比90∶10在乙醇溶液中搅拌混合,得到物理混合的MnCo2O4/KB,记为mix-MnCo2O4/KB。图1为MnCo2O4/N-KB的合成原理示意图。
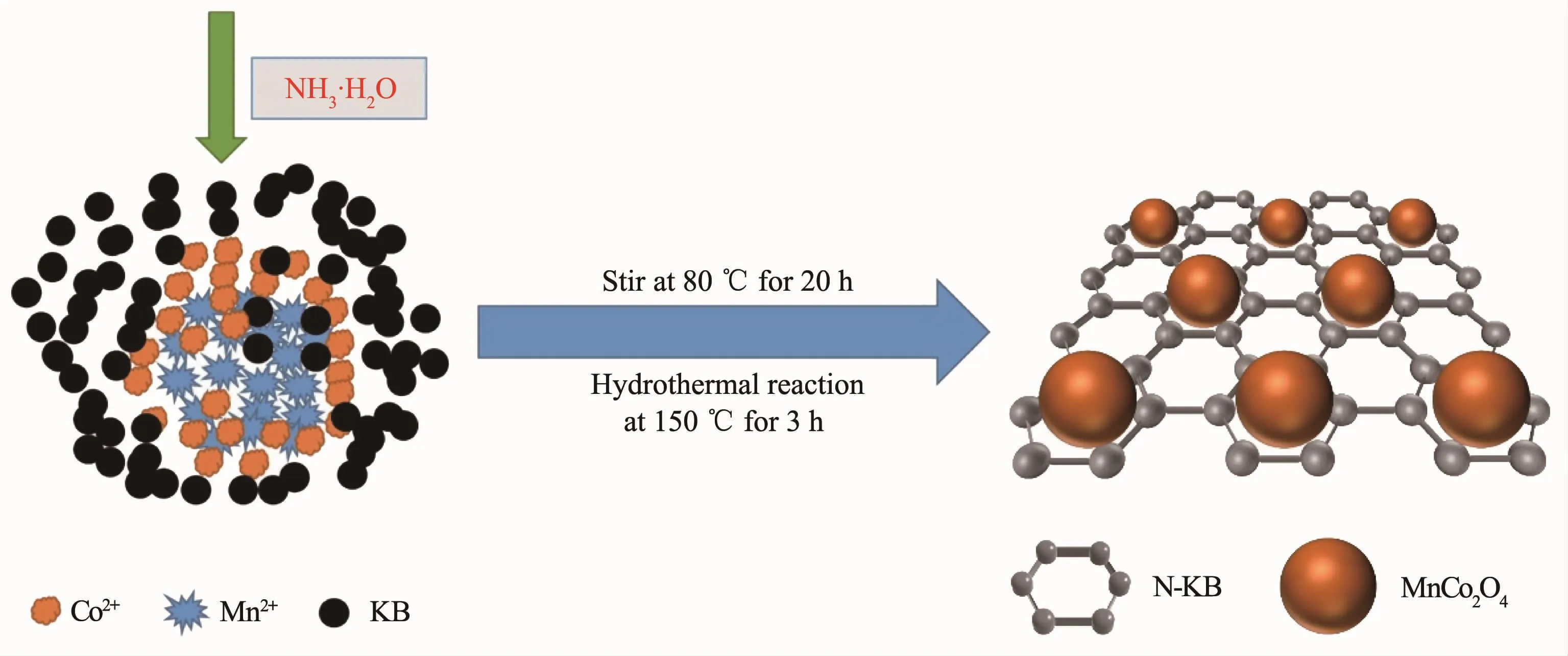
图1 MnCo2O4/N-KB的合成过程示意图Fig.1 Schematic diagram of the synthesis of MnCo2O4/N-KB
1.3 电化学测试
电化学测试在25℃下进行,采用三电极体系,参比电极为饱和甘汞电极(SCE),辅助电极为直径为1 mm的铂丝,工作电极为玻碳电极,电解液为0.1 mol·L-1KOH溶液。循环伏安曲线(CV)测试分别在Ar和O2饱和的0.1 mol·L-1KOH溶液中进行,扫描速度为50 mV·s-1。采用旋转圆盘电极(RDE)测试催化剂的氧还原性能。在称量管中加入6 mg碾磨均匀的催化剂粉末,加950μL的无水乙醇超声20 min使之分散均匀;取50μL 5%(w/w)Nafion溶液加入上述溶液中,超声30 min,取超声完的溶液5 μL滴于玻碳圆盘电极上,室温下风干。RDE测试、线性极化曲线(LSV)测试和稳定性测试均在O2饱和的0.1 mol·L-1KOH溶液中进行,电压范围为-1.2~0.4 V(vs RHE),扫描速度为 10 mV·s-1,电极转速为1 600 r·min-1。
2 结果与讨论
2.1 形貌分析
图2为10%MnCo2O4/N-KB催化剂的形貌分析图。图2(a)的SEM图表明复合物是均匀的颗粒,疏松多孔,呈不规整粒状,而且其表面有很多区域呈现中空的结构。图2(b)的TEM图中深黑色的区域表明MnCo2O4均匀的分布在KB碳的表面,平均粒径为50 nm,与相关文献描述的一致[21]。从图2(c,d)的HRTEM图中看出,MnCo2O4具有清晰的晶格条纹,(311)、(220)、(111)晶面对应的晶面间距分别为 0.25、0.29、0.48 nm,旁边不规则的区域则为无定型的碳。这表明MnCo2O4颗粒与KB表面接触良好。
2.2 结构分析

图2 (a)10%MnCo2O4/N-KB的SEM图,TEM图和(c,d)HRTEM图Fig.2 (a)SEM,TEM and HRTEM imageSof 10%MnCo2O4/N-KB
图 3为 10%MnCo2O4/N-KB的 XRD、EDS图和XPS图谱。由图3(a)所示的XRD图中可见MnCo2O4的典型衍射峰(PDF No.23-1237),分别对应MnCo2O4的(111)、(220)、(311)、(400)、(511)和(440)晶面[14]。
KB的XRD图中在2θ=24°处有1个宽峰,这是典型的石墨碳的特征峰,而在2θ=45°处是一个相对较小的宽峰,属于无定型的结构[22-23]。在10%MnCo2O4/N-KB的XRD图中也在24°有一个明显的石墨碳的特征峰,说明MnCo2O4与KB共存于制备的10%MnCo2O4/N-KB复合物中,标志着MnCo2O4成功负载在无定型的KB碳上。由图3(b)中10%MnCo2O4/N-KB样品的EDS元素分析可知,Co/Mn原子比值约为2,与设计的比例一致。
图 3(c~h)的 XPS图谱给出 10%MnCo2O4/N-KB复合材料的表面化学成分及价态分布。图3(c)全谱图显示材料中存在Mn、Co、O、C、N五种元素,同时在400.0 eV附近的峰也证明了N元素的成功掺杂。图3(d)可知,高分辨率的C1s峰位于284.7 eV,主要是sp2杂化的石墨化碳[24-25],表明10%MnCo2O4/N-KB纳米材料中活化碳的存在,石墨化碳的存在可以很好的克服MnCo2O4导电性差的缺陷。图3(e)是O1s的XPS谱图,分别拟合为3个特征峰533.3、531.5、530.5 eV,分别记为OⅠ、OⅡ、OⅢ。其中,在533.3 eV处对应于表面的物理和化学结合氧,531.5 eV处对应小尺寸颗粒材料的大量的低氧配位缺陷位点,530.5 eV处则是典型的金属氧键[26-29]。图3(f)为N1s的XPS谱图,表1列出了XPS测得的元素含量。由表1可知,XPS测得的N元素掺杂量为~1.69%(n/n),且N与C原子比例为~0.019,结合图3(f)的图谱分析,NⅠ对应吡咯氮,NⅡ属于硝基类官能团,NⅢ则为卫星振动峰[30-33]。对Co2p图谱(图3(g))和Mn2p图谱(图3(f))分峰拟合,可知在Co2p图谱中有Co2+和Co3+两个自旋轨道特征对,797.3和781.7 eV结合能处的拟合峰对应于Co3+,在795.5和780.5 eV处的峰为Co2+[34-36]。Mn2p图谱中在结合能为642.3和653.7 eV处的2个峰属于Mn3+离子,在645.4和656.3 eV对应的是Mn4+离子[21-23]。位于尖晶石结构的八面体位点的Mn4+/Mn3+氧化还原对通常被认为ORR的活性位点,并且相比于Co有更高的活性[10,21,37]。以上XPS结果分析表明,固态的氧化还原反应对Co3+/Co2+和 Mn4+/Mn3+共存于尖晶石MnCo2O4中。

表1 XPS测得的元素含量分布Table 1 Element content distribution measured by XPS
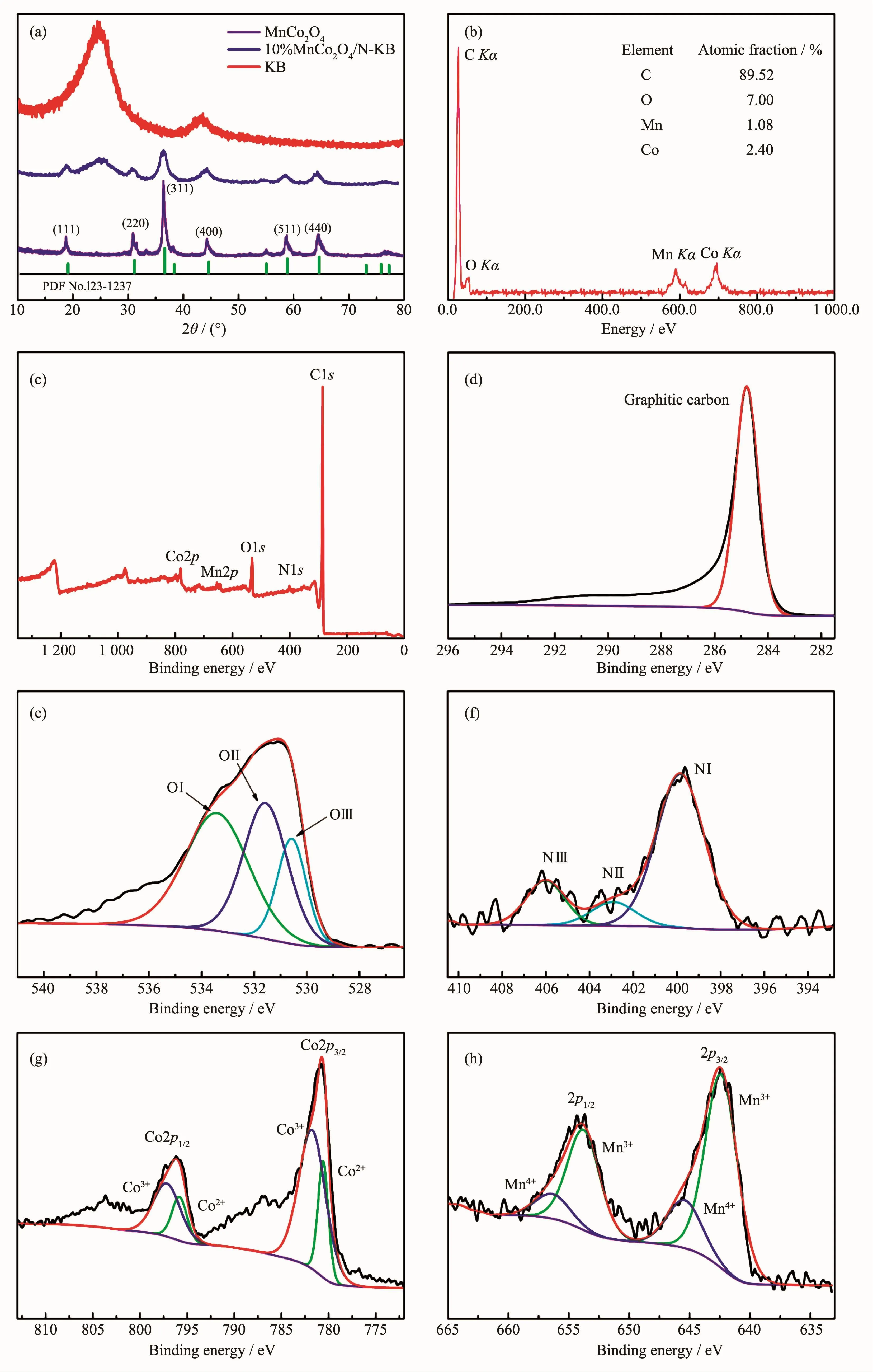
图3 (a)KB、MnCo2O4和10%MnCo2O4/N-KB复合物的XRD图;(b)10%MnCo2O4/N-KB复合物的EDS图;MnCo2O4/N-KB复合物的XPS图谱:(c)全谱,(d)C1s,(e)O1s,(f)N1s,(g)Co2p和(h)Mn2pFig.3 (a)XRD patterns of KB,MnCo2O4 and 10%MnCo2O4/N-KB complexes;(b)EDSspectra of 10%MnCo2O4/N-KB complexes;XPSspectra of(c)survey spectrum,(d)C1s,(e)O1s,(f)Co2p,(g)Mn2p for 10%MnCo2O4/N-KB complexes
2.3 吸附-脱附曲线
图 4(a)所示为 MnCo2O4和 10%MnCo2O4/N-KB的N2吸附-脱附曲线,10%MnCo2O4/N-KB的等温线为Ⅳ类型,滞后环为H3类型,表明10%MnCo2O4/NKB催化剂中存在介孔结构[38],计算出Brunauer-Emmett-Teller(BET)比表面积为 522 m2·g-1。由图 4(b)的孔径分布图可知,10%MnCo2O4/N-KB的孔径主要分布在0~20 nm之间,通过Barrett-Joyner-Halenda(BJH)法计算出的平均孔直径为3.2 nm。纯MnCo2O4的N2吸附-脱附曲线如图4(a)所示,没有明显的回滞环,BET 比表面积为 126 m2·g-1,BJH 计算的孔直径为3.2 nm。可知,MnCo2O4与KB混合后的10%MnCo2O4/N-KB复合材料有更高的比表面积和更多的孔结构,说明KB的加入并没有减小催化剂的孔直径,反而提供了中空的内部结构,能够提供大量的电化学活性位,使O2更轻易的渗入介孔中,和催化剂的活性位点有更好的接触,从而改善材料的电化学性能。

图4 (a)MnCo2O4和10%MnCo2O4/N-KB的N2吸附-脱附曲线;(b)10%MnCo2O4/N-KB的孔径分布图Fig.4 (a)N2 adsorption-desorption and(b)pore diameter distribution curves of MnCo2O4 and 10%MnCo2O4/N-KB
2.4 电化学测试
图5 (a)为不同比例KB掺杂的催化剂负载在玻碳电极上在1 600 r·min-1的转速下O2饱和的0.1 mol·L-1KOH溶液中测试的LSV曲线。由图可知,不同KB掺杂量的催化剂都有接近的起始电位和电流密度,但10%MnCo2O4的催化剂明有更高的半波电位,因此,后文的研究都取10%MnCo2O4/N-KB的催化剂为研究对象。图5(b)为5种催化剂MnCo2O4、KB、mix MnCo2O4/KB、MnCo2O4/KB 和 10%MnCo2O4/N-KB在相同条件下测试的LSV曲线。10%MnCo2O4/N-KB催化剂相对MnCo2O4/KB表现出更高的起始正电位和更高的极限电流密度。同时,10%MnCo2O4/N-KB的半波电位比KB、MnCo2O4/KB以及物理混合的mix MnCo2O4/KB更正。在碱性电解液中10%MnCo2O4/N-KB催化ORR的半波电位(0.81 V)较商业 20%(w/w)Pt/C(0.83 V)只负约 20 mV,而 MnCo2O4/N-KB的极限电流密度达5.7 mA·cm-1,超过了Pt/C(5.2 mA·cm-1)。N元素成功掺杂到KB中,在10%MnCo2O4/N-KB催化剂中形成含氮官能团(吡咯氮和吡啶氮),其平面边缘由于孤对电子的存在可能为催化过程提供更多的活性位点[22]。另一方面,10%MnCo2O4/N-KB中的KB碳拥有优异的导电性、低密度和高的比表面积[39],MnCo2O4和N-KB的交联使得二者产生强烈的协同作用[34,40],在相同负载量条件下10%MnCo2O4/N-KB表现出大于Pt/C的电流密度,展现出优良的ORR催化活性。
图5(c)为不同碳含量MnCo2O4/N-KB复合材料中的CV曲线,测试电压范围为-0.5~1.5 V(vs RHE)。如图所示,在饱和Ar气氛下,所有催化剂电解液中的CV曲线都没有明显的氧还原峰,然而,当处于O2饱和的电解液中时,出现明显的氧还原峰,确定了催化剂的氧还原活性。不同催化剂的氧还原能力强弱可以从峰电位和峰电流比较,峰电位越正,峰电流越负,表明催化剂的ORR催化活性越高。由图可知10%MnCo2O4/N-KB催化剂在O2中的CV曲线展现了一个~0.81 V(vs RHE)的还原峰电位,随着碳含量的减少,氧还原的峰电位逐渐负移并减弱,证明10%MnCo2O4/N-KB催化剂还原性能更好,这与LSV数据测试结果一致。图5(d)为5种催化剂 MnCo2O4、KB、mix MnCo2O4/KB、MnCo2O4/KB 和10%MnCo2O4/N-KB在相同条件下测试的CV曲线,可以看出10%MnCo2O4/N-KB(~0.81 V)的氧还原峰电位明显比 MnCo2O4(~0.517 V)、KB(~0.779 V)、mix MnCo2O4/N-KB(~0.789 V)、MnCo2O4/KB(~0.784 V)更正,比 Pt/C 催化剂(~0.890 V)稍负。MnCo2O4/N-KB 的氧还 原峰 位 相 比 于 MnCo2O4、KB、mix MnCo2O4/NKB、MnCo2O4/KB的正移,再一次表明了氮元素成功掺杂到KB碳中,以及MnCo2O4与N-KB之间协同作用的存在。

图5 在O2饱和的0.1 mol·L-1 KOH溶液中于10 mV·s-1的扫描速率和1 600 r·min-1下(a)MnCo2O4/N-KB复合材料中不同MnCo2O4含量的LSV曲线和(b)MnCo2O4、KB、mix MnCo2O4/KB、MnCo2O4/KB和10%MnCo2O4/N-KB的LSV曲线;在氧气饱和的0.1 mol·L-1 KOH溶液中于50 mV·s-1扫描速率下(c)不同MnCo2O4含量的MnCo2O4/N-KB复合材料的 CV 曲线和(d)MnCo2O4、KB、mix MnCo2O4/KB、MnCo2O4/KB、10%MnCo2O4/N-KB 及 20%Pt/C 的 CV曲线;(e)20%Pt/C催化剂的CV曲线放大图;(f)MnCo2O4催化剂的CV曲线放大图Fig.5 (a)LSV curves for different MnCo2O4 contents in MnCo2O4/N-KB composites and(b)LSV curves for MnCo2O4,KB,mix MnCo2O4/KB,MnCo2O4/KB and MnCo2O4/N-KB in O2 saturated 0.1 mol·L-1 KOH solution at 1 600 r·min-1 at a scan rate of 10 mV·s-1;(c)CV curves of MnCo2O4/N-KB composites with different MnCo2O4 contents,(d)CV curve of MnCo2O4 KB,mixed MnCo2O4/KB,MnCo2O4/KB,10%MnCo2O4/N-KB and 20%Pt/Cin O2 saturated 0.1 mol·L-1 KOH solution at a scan of 50 mV·s-1;(e)Enlarged view of the CV curve of the 20%Pt/C catalyst;(f)Enlarged view of the CV curve of the MnCo2O4 catalyst
为了进一步研究10%MnCo2O4/N-KB催化剂的ORR动力学信息,实验测定了多种催化剂在不同电压下的LSV曲线,结果如图6所示。图7为根据此结果作的J-1与ω-1/2的关系曲线图,根据Koutecky-Levich(K-L)方程式计算氧还原反应过程中的电子转移数(n)和相应的动力学电流[41-43]:



图6 各种催化剂在O2饱和的0.1 mol·L-1 KOH溶液中于10 mV·s-1的扫描速率下在不同的转速(400~1 600 r·min-1)中的 LSV 极化曲线Fig.6 LSV polarization curves of various catalysts in O2 saturated 0.1 mol·L-1 KOH solution at different rotating speeds(400~1 600 r·min-1)at a scan rate of 10 mV·s-1

图7 各种催化剂在0.1~0.5 V电压下的K-L曲线Fig.7 K-L plots of differrent catalysts at 0.1~0.5 V
式中,j表示实验测得的电流密度,jL表示扩散电流密度,jK表示动力学电流密度;ω是工作电极旋转角速度(rad·s-1);F 是法拉第常数(F=96 485 C·mol-1),n是单位氧分子的电子转移数,D0是氧分子在0.1 mol·L-1KOH 溶液中的扩散系数(1.9×10-5cm2·s-1);ν是氧分子在0.1 mol·L-1KOH溶液中的动力学粘度(0.01 cm2·s-1);C0为氧分子在 0.1 mol·L-1KOH 溶液中的溶解度(1.2×10-3mol·L-1)。
结果表明,不同电位下催化剂的K-L曲线均表现出良好的线性关系,说明氧还原反应速度与氧溶解速度遵循一级反应动力学关系。由图7(e)计算10%MnCo2O4/N-KB催化剂的电子转移数(n)在0.1~0.5 V范围内经计算约为4,表明了其4e-的ORR转移通道。10%MnCo2O4/KB和20%Pt/C的电子转移数也是约等于4,表明了在形成OH-离子的过程中四电子转移途径的存在(式(3)),电子转移效率高。在碱性电解质中,ORR还有另一种效率很低的两电子途径,该途径中氧气分子O2先被还原成HO2-(式(4)),而后通过捕获两个电子或发生歧化反应进一步被还原成OH2-(公式(5))[44-46]。HO2-具有很强的腐蚀性,可以导致电池过早退化。所以直接的四电子氧还原途径是十分必要的,它能保证电池的高效性和稳定性。

根据图 7(a,b)的 K-L直线斜率计算得单独MnCo2O4催化剂的电子转移数n在0.1~0.5 V范围内接近2,是典型的两电子转移途径。计算在低电位下单独KB催化剂的电子转移数n约等于3,说明此时O2的还原存在两电子和四电子混合过程,而单独MnCo2O4催化剂和单独KB催化剂的电子转移效率低下。与10%MnCo2O4/N-KB催化剂的计算结果对比可知,MnCo2O4与N-KB碳材料的复合产生良好的协同作用,提高ORR的电子转移效率。
由XPS分析可知,10%MnCo2O4/N-KB催化剂中Co2+/Co3+和 Mn4+/Mn3+同时存在,Co3+离子可以作为捐助-受体还原位点[47],Co2+/Co3+的比例可以决定ORR通道[48]。反应开始后,O2进入催化剂的多孔结构中,并与表面的Co3+活性位点结合[49],在碱性电解液中发生氧化还原反应(式(6~8)[50]。 Mn4+/Mn3+可以催化HO2-的加速反应[51],促进ORR四电子转移反应,同时催化剂中KB的高导电性提供了更高电子转移效率,提高了催化性能。

由LSV数据得到的MnCo2O4/KB、10%MnCo2O4/N-KB和20%Pt/C的Tafel曲线如图8(a)所示。Tafel曲线斜率越小,说明在相同动力学电流密度或表观电流密度下,该催化过程的过电势越低,反应越完全,性能越好。经计算,10%MnCo2O4/N-KB的Tafel斜率为 103.1 mV·dec-1,在 0.1 mol·L-1KOH 的电解液中,0.8~1.0 V的过电势范围内,与MnCo2O4/KB(130.3 mV·dec-1)相比有着更小的Tafel斜率,也表明10%MnCo2O4/N-KB的ORR动力学过程接近于商用Pt/C(107.1 mV·dec-1)。通过计时电流法对催化剂进行稳定性测试,其结果如图8(b)所示。由图可知,初期,10%MnCo2O4/N-KB和20%Pt/C催化剂放电的电流密度接近,放电40 000 s后,10%MnCo2O4/NKB催化剂的电流密度衰减到69.1%,而20%Pt/C的电流密度衰减至35.9%,衰减速率明显大于10%MnCo2O4/N-KB催化剂。由此可知10%MnCo2O4/NKB催化剂的稳定性明显优于20%Pt/C。这是由于MnCo2O4纳米颗粒固载在KB上,两者之间紧密的结合方式使得活性位不易脱落。其具有的中空多孔的结构强化了氧气的传递,为催化剂提供了充分的氧气,而且KB的高导电性使得电子转移效率更高,减少了电子在传递过程中的损失。

图8 (a)10%MnCo2O4/KB、MnCo2O4/N-KB和20%Pt/C的动力学电流Tafel曲线;(b)O2饱和0.1 mol·L-1 KOH溶液中10%MnCo2O4/N-KB与20%Pt/C的计时电流曲线Fig.8 (a)Tafel curves of kenetic current for MnCo2O4/KB,10%MnCo2O4/N-KB and 20%Pt/C;(b)Current-time chronoamperometric response of 10%MnCo2O4/N-KB and 20%Pt/Cin O2 saturated 0.1 mol·L-1 KOH solution
3 结 论
采用水解-水热法可制备MnCo2O4/N-KB阴极材料,N-KB骨架和纳米级MnCo2O4之间形成化学耦合,产生协同作用,高比表面积的结构提供了更多的活性位点,起到了强化氧气传递的作用,有效提高了MnCo2O4/N-KB催化剂的氧还原活性和稳定性。MnCo2O4与N-KB的质量比为1∶9时,10%MnCo2O4/N-KB催化剂在 O2饱和 0.1 mol·L-1KOH溶液中对氧还原反应的电催化性能最佳,反应的极限电流密度为5.7 mA·cm-2,半波电位接近0.81 V,电子转移数为4。在相同负载量下,10%MnCo2O4/NKB催化剂相比商用Pt/C(电流密度5.2 mA·cm-2,半波电位0.83 V)有着更高的极限电流密度和耐久性。
