鹿骨胶水解物抗氧化活性及对H2O2损伤PC12细胞保护作用的研究
2019-04-11郭冰洁苑广信安丽萍杜培革徐广宇
郭冰洁,苑广信,张 静,安丽萍,杜培革,徐广宇,韩 笑
(北华大学药学院,吉林吉林 132013)
鹿骨为鹿科动物梅花鹿(Cervushortulorum)或马鹿(Cervuselaphus)的骨骼,营养物质丰富,含有大量的蛋白质、磷脂质、磷蛋白、维生素,还含有钙、镁、铁、锌、钾等微量元素,参与人体的多种代谢,具有重要的药理作用[1]。《本草纲目》中记载:“鹿骨,甘,微热,无毒,续断伤,补骨除风;烧灰水服,治小儿洞注下痢[2]”。另有记载:“虎难捕,可用鹿骨代之。鹿食草,其骨性温良而悠长”。大量研究证实,鹿骨多肽可治疗骨质疏松,延缓衰老,且对人体无毒副作用,具有水溶性强、活性高等特点,可作为天然活性蛋白多肽的可靠来源。
大量研究证实,活性氧(ROS)自由基与衰老和许多慢性疾病有关[3],正常情况下,ROS自由基的产生和清除处于动态平衡,适量的自由基可促进代谢,过量会引起人体自身的氧化应激损伤,久之成疾[4]。·OH、O2·-自由基是机体有氧代谢的中间体,在体内存在状态不稳定[5],易引起周围组织脂质过氧化反应,破坏细胞的膜蛋白,损伤细胞器结构和功能,进而使蛋白质、脂质和DNA等生物大分子受到不同程度的损伤[6]。该研究采用热水抽提法提取鹿骨中的蛋白质,骨胶即为骨胶原蛋白的热提取产物,并用酶进行水解,对其体外抗氧化活性及对正常PC12细胞的影响和H2O2氧化损伤PC12细胞的保护作用进行探究。
1 材料与方法
1.1材料与试剂鹿骨购自吉林市龙潭山向阳鹿厂;PC12细胞,北华大学药理教研室赠送。胃蛋白酶(600~1 000 U/mg)、胰蛋白酶(250 U/mg),购自北京鼎国昌盛生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(DPPH)购自东京化成工业株式会社;VC购自天津市永大化学试剂有限公司;DMEM培养基购自HyClone公司;胎牛血清购自杭州天杭生物科技股份有限公司;BCA试剂盒、Folin-酚试剂盒均购自北京鼎国昌盛生物技术有限责任公司;其他试剂均为分析纯,水为实验室自制超纯水。
1.2仪器与设备ATY224型电子天平,日本SHIMADZU;Five Easy plus 型pH计,瑞士METTLER TOLEDO;冷冻干燥机,美国SP Scientific-Vritis BenchTop Pro;Infinite M200型酶标仪,瑞士TECAN; Thermo Mixer C型恒温振荡器,德国EPPENDORF; UV-2550型紫外分光光度计,日本SHIMADZU。
1.3方法
1.3.1工艺流程。新鲜鹿骨→粉碎→脱脂→脱钙→干燥→提取→鹿骨胶粗提液→胃酶酶解→胰酶酶解→碱性蛋白酶酶解→终止酶解→离心取上清→冻干得鹿骨胶水解物(HDBG)干粉。
1.3.2鹿骨胶水解物制备。
1.3.2.1预处理。将鹿骨剔去肉和筋膜,粉碎过40目筛,石油醚浸泡24 h,常温挥干,0.5 mol/L HCl脱钙,每3 h换一次酸液,干燥得脱脂脱钙骨粉。
1.3.2.2鹿骨多肽制备。①取预处理鹿骨,于121 ℃ 0.15 MPa ,料液比为1∶10条件下提取2 h,合并2次提取液,减压浓缩,冻干得鹿骨胶干粉。②鹿骨胶溶液(质量分数为4%),胃蛋白酶37 ℃,pH=2.0酶解4 h,胰蛋白酶酶解37 ℃,pH=8.0酶解4 h,酶底比均为1∶500(m∶V),碱性蛋白酶45 ℃,pH=10.0酶解2 h,酶底比为1∶200(m∶V),沸水浴10 min终止酶解,10 000 r/min离心20 min上清即为鹿骨胶水解液(HDBG),冻干得鹿骨胶水解物干粉。
1.3.3鹿骨蛋白含量测定。采用凯氏定氮法(参照GB/T 5009.5—2010)测定蛋白质,计算公式为:
X=[(V1-V2)×c×0.014 0]/(m×V3/100)×F×1 000
(1)
式中,X为蛋白质含量(g/kg);V1为样品消耗盐酸标准滴定液体积(mL);V2为空白组消耗盐酸标准滴定液体积(mL);V3为吸取样品消化液体积(mL);c为1.0 mL盐酸标准滴定液浓度(mol/L);0.014 0为1.0 mL盐酸标准滴定液相当的氮的质量;m为样品质量;F为换算系数。
1.3.4抗氧化试验。
1.3.4.1DPPH自由基清除率测定[3,7-9]。用95%乙醇配制0.2 mmol/L DPPH,避光保存,备用。吸取不同浓度的HDBG 100 μL样品于96孔板中,加入100 μL DPPH溶液,充分摇匀,25 ℃孵箱反应30 min,517 nm处测定吸光度值Ai,相同条件下,样品与95%乙醇吸光度值Aj,水与DPPH吸光度值A0,水与95%乙醇吸光度值A空白;VC为阳性对照;每样品平行测定3次,取均值。清除率公式为:
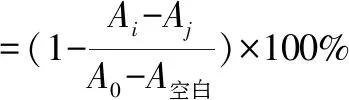
(2)
1.3.4.2羟自由基(·OH)清除率测定[9-10]。该研究采用Fenton体系,H2O2与Fe2+混合产生·OH,在体系内加入水杨酸产生·OH并生成有色物质,该物质在510 nm下有最大吸收。用95%乙醇配制10 mmol/L水杨酸溶液,避光保存;去离子水配制10 mmol/L FeSO4溶液,10 mmol/L H2O2溶液,备用。依次吸取各溶液50 μL于96孔板,加入50 μL不同浓度HDGB,避光摇匀10 min,加入50 μL H2O2启动反应,37 ℃孵箱反应30 min,510 nm处测定吸光度值Ai,相同条件下,样品+FeSO4+水杨酸+水吸光度值Aj;水+FeSO4+水杨酸+ H2O2吸光度值A0;VC为阳性对照;每样品平行测定3次,取均值。清除率公式为:
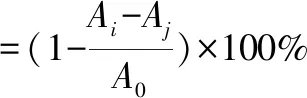
(3)
1.3.5HDBG对H2O2诱导PC12细胞氧化损伤的修复作用。
1.3.5.1样品配制。取HDBG冻干粉30 mg用DMEM培养基定容至2 mL,分别稀释至1 500、750 、250 μg/mL,备用。
1.3.5.2HDBG对正常PC12细胞的影响[11-12]。取对数生长期的PC12(8.0×104个/mL),接种到96孔板中,设置空白对照组、正常对照组和HDBG给药组(低剂量组250 μg/mL、中剂量组750 μg/mL、高剂量组1 500 μg/mL),HDBG给药组每孔加入100 μL单细胞悬液,空白对照组加100 μL培养液(含10%胎牛血清),每组设置5个复孔,37 ℃,5% CO2培养至细胞贴壁后,给药组加不同浓度的HDBG溶液100 μL,其他组每孔加入培养液100 μL。继续培养24 h后,利用MTT法,在490 nm处测定吸光度值OD,取平均值计算细胞活力。

(4)
式中,OD0为空白组OD值;OD1为试验组OD值;OD2为对照组OD值。
1.3.5.3H2O2诱导PC12细胞氧化损伤模型的构建[13-16]。将对数生长期的PC12细胞(8.0×104个/mL),接种到96孔板中,设置空白对照组、H2O2损伤组(终浓度为100、200、300、400 μmol/L)和正常对照组;正常对照组和不同浓度H2O2损伤组每孔加入100 μL细胞悬液,空白对照组加100 μL培养液,每组设置5个复孔,37 ℃,5% CO2培养24 h后向损伤组加不同浓度的H2O2溶液100 μL,其他组每孔加入培养液100 μL。在1、2、3、4 h时,吸出旧培养液,加入200 μL新培养液,继续培养24 h后。用MTT法,490 nm处测定吸光度值A,取平均值计算细胞活力。细胞存活力50%左右时的条件为最佳损伤条件。
1.3.5.4HDBG对 H2O2损伤PC12细胞的保护作用[17-20]。将对数生长期的PC12细胞接种于DMEM培养基中(含10%胎牛血清),37 ℃,5% CO2培养3 d,消化处理,稀释至8×104cell/mL,每孔100 μL接种于96孔板中,设置空白组、给药组、正常对照组,培养24 h至细胞贴壁,给药组加入损伤剂H2O2100 μL,终浓度为200 μmol/L,空白组加入100 μL培养液,恒温培养3 h后,吸出旧培养基,每孔加入100 μL 新培养液,每样品设置4个复孔,具体如下:①样品组。高剂量组,100 μL细胞+100 μL 1 500 μg/mL HDBG(经H2O2损伤);中剂量组,100 μL细胞+100 μL 750 μg/mL HDBG(经H2O2损伤);低剂量组,100 μL细胞+100 μL 250 μg/mL HDBG(经H2O2损伤)。②对照组,100 μL细胞+100 μL DMEM培养基(未经H2O2损伤)。③空白组,100 μL DMEM培养基+100 μL HDBG。
加好样品的96孔板置于细胞培养箱中培养24 h,每孔加入20 μL MTT(5 mg/mL)后,置于细胞培养箱孵育4 h,吸弃孔内所有培养基,然后每孔加入150 μL二甲基亚砜(DMSO)振荡溶解10 min,490 nm测定OD值。细胞活力公式为:

(5)
式中,OD0为空白组OD值;OD1为试验组OD值;OD2为对照组OD值。
1.4数据统计与分析每组试验平行测定3次,结果以“平均值±标准差”的形式表示。 试验结果用Graphpad Prism 6 进行统计分析。
2 结果与分析
2.1鹿骨胶水解物含量测定鹿骨胶是骨胶原蛋白的热提取产物,该试验中鹿骨胶干粉产率为10.3%,其中蛋白含量为51.2%。因此其水解物主要成分为鹿骨多肽,水解物肽纯度493 g/kg。
2.2鹿骨胶水解物对DPPH的清除作用由图1可知,HDBG可有效地清除试验体系中的DPPH自由基,不同浓度的HDBG对DPPH自由基的清除效果存在差别,当质量浓度小于10 mg/mL时,随HDBG浓度增加,清除率迅速升高;在10~30 mg/mL时清除率与HDBG浓度呈剂量依赖关系;30 mg/mL时,最大清除率为74.63%,当浓度大于30 mg/mL时,清除率增加趋于平缓,其IC50=10.05 mg/mL。

图1 鹿骨水解物对DPPH自由基的清除率Fig.1 The scavenging rate of DPPH free radicals by HDBG
2.3鹿骨胶水解物对·OH的清除作用由图2可知,HDBG对试验体系中的·OH自由基有显著的清除作用(P<0.05),不同浓度的HDBG对·OH自由基的清除效果存在差别,当质量浓度小于16 mg/mL时,清除率与HDBG浓度呈剂量依赖关系;当浓度大于16 mg/mL时,清除率无显著增加,在16 mg/mL时达最大清除率87.69%,其IC50=4.76 mg/mL。
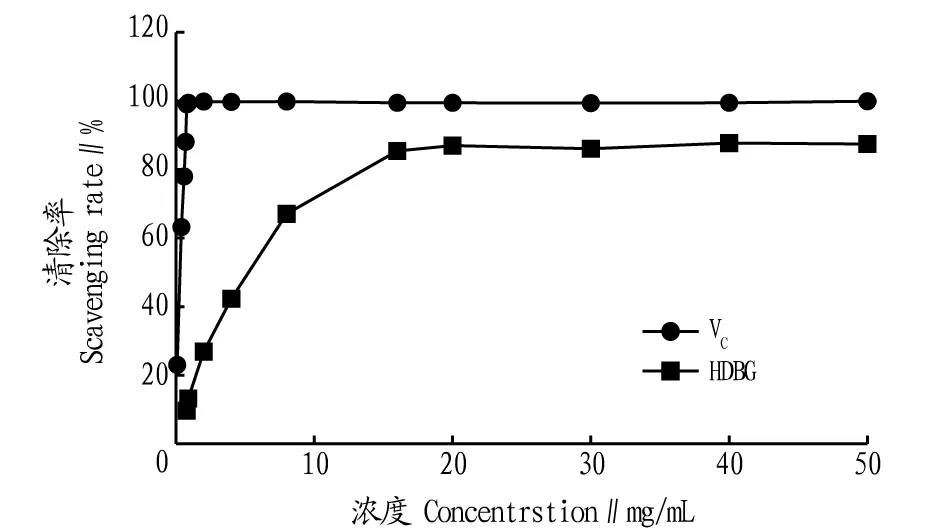
图2 鹿骨水解物对·OH自由基的清除率Fig.2 The scavenging rate of ·OH by HDBG
2.4HDBG对H2O2诱导PC12细胞氧化损伤的修复作用
2.4.1HDBG对正常PC12细胞的影响。由图3可知,当给药浓度为250 μg/mL时,48 h的细胞活力为111.31%(P<0.05),与对照组相比具有显著的差异。给药浓度为750、1 500 μg/mL时,与对照组相比,24 h、48 h的细胞活力均有极显著(P<0.01)的统计学意义。说明HDBG对PC12细胞无毒副作用,1 500 μg/mL时,48 h时,最大细胞活力达159.83%。
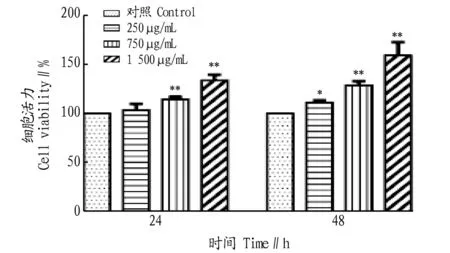
注:*、**表示与对照组相比,差异显著(P<0.05)、极显著(P<0.01)Note:*,** indicates that the difference is significant and extremely significant compared with the control group图3 HDBG对正常PC12细胞的影响Fig.3 Effect of HDBG concentration on normal PC12 cell
2.4.2H2O2诱导PC12细胞氧化损伤模型的构建。由图4可知,损伤随着H2O2浓度的升高及时间的延长,模型表现氧化损伤逐渐加重。当200 μmol/L的H2O2损伤3 h时,细胞活力为52.02%,与正常对照组相比,有显著性差异(P<0.05)。因此,模型选用200 μmol/L的H2O2处理PC12细胞3 h作为细胞氧化损伤条件。

图4 H2O2浓度对细胞活力的影响Fig.4 Effect of H2O2 concentration on cell activity
2.4.3鹿骨胶水解物对H2O2损伤PC12细胞的保护作用。由图5可知,经H2O2损伤后,细胞活力降为52.29%,与对照组相比具有显著(P<0.01)的统计学意义,表明氧化损伤细胞模型造模成功。当HDBG在250 μg/mL时,PC12细胞活力无明显升高;750 μg/mL的浓度下,使细胞活力增加至73.16%(P<0.05),对损伤的细胞具有显著的保护作用;当HDBG浓度为1 500 μg/mL 时,细胞活力升至82.43%(P<0.05)。综上所述,HDBG高、中、低剂量组均可增加细胞活力,表明不同浓度HDBG可对氧化损伤的PC12细胞具有不同程度的保护作用,且呈明显的剂量依赖性。

注:*表示t检验中,与损伤组比较差异显著(P<0.05);##表示与对照组相比差异显著(P<0.05)Note: * indicates significant difference compared with the injury group (P<0.05) in t test;## indicates significant difference compared with the control group (P<0.05)图5 HDBG对PC12的氧化损伤保护作用Fig.5 Protective effects of HDGB on oxidative injury in PC12
3 讨论与结论
ROS自由基过多能直接或间接地引起脂质过氧化反应,损伤细胞膜、酶、DNA等,使机体处于氧化应激状态,并引起衰老和各种慢性退行性疾病[21]。如今应用的合成抗氧化剂安全尚不可靠,因此,开发来源安全的食品抗氧化剂具有重要意义。鹿骨胶水解物的抗氧化试验结果表明,鹿骨胶水解物对DPPH和·OH均具有良好的清除能力。其中DPPH的IC50值为10.05 mg/mL,·OH的IC50值为4.76 mg/mL。该试验结果为鹿骨多肽的药物开发提供了理论依据。
PC12细胞由大鼠肾上腺嗜铬细胞瘤分离得到,在功能和形态上均与神经细胞相似[22],H2O2诱导PC12神经细胞损伤模型是模拟体内自由基诱导细胞凋亡的过程,因此,可作为多种神经性疾病的体外细胞模型[23-25]。H2O2诱导PC12神经细胞损伤试验结果表明,鹿骨胶水解物浓度在250 μg/mL时,细胞活力略高于损伤组,无显著增加。当浓度为750 μg/mL时,对氧化损伤的PC12细胞具有显著的保护作用,细胞活力由52.29%上升至73.16%(P<0.05),在浓度1 500 μg/mL时,细胞活力达82.43%(P<0.05),HDBG对正常的PC12细胞具有增殖作用,说明其无细胞毒性,对氧化损伤的PC12细胞具有保护作用,且与水解物浓度呈剂量依赖关系。
我国是畜牧大国,禽畜骨骼年产量巨大,多数因不能充分利用造成严重的浪费,因此动物骨胶原蛋白多肽的研究具有深远意义。骨骼中大量的优质蛋白及多肽,对人体无毒副作用,可作为天然活性蛋白多肽的可靠来源,随着科学技术的发展,骨多肽势必会成为研究热点。该研究为鹿骨多肽的功能产品开发提供依据,鹿骨胶水解物主要成分为多肽,具有良好的抗氧化活性,可预期鹿骨多肽在抗衰老、抗癌和神经退行性疾病相关的生命系统的氧化损伤中的重要保护作用, 为鹿骨多肽的进一步研究提供了新思路。
