纳米二氧化钛对IEC-6细胞炎症因子表达及JAK 2/STAT3蛋白磷酸化的影响
2019-04-11张小强苗歆雨卢晓星
刘 静,张小强,*,王 旭,苗歆雨,卢晓星
(1.东南大学公共卫生学院,江苏 南京 210009;2.东南大学环境医学工程教育部重点实验室,江苏 南京 210009)
近年来,用于食品的二氧化钛(titanium dioxide,TiO2)已被美国食品药品监督管理局(Food and Drug Administration,FDA)和欧洲食品安全局(European Food Safety Authority,EFSA)认定为是一种安全的食品添加剂[1]。然而,Kim等[2]在标注含TiO2的食品中检测出一定量的纳米二氧化钛(titanium dioxide nanoparticles,nano-TiO2)。肠道是大多数营养物质消化和吸收的场所,易与经口摄入的外来污染物相互作用。研究发现,经口暴露的nano-TiO2富集在肠道上皮细胞层[3],诱导肠道隐窝结构改变以及紧密连接蛋白和炎症相关基因表达异常[4-5]。上述病理表现提示肠道可能作为nano-TiO2的靶器官之一,出现不良反应。迄今为止,有关nano-TiO2肠道毒性的研究相对较少。考虑到人群每日经口暴露于nano-TiO2的机会增加,关于nano-TiO2肠道毒性效应及相关机制值得深入探讨。因此,本研究选择不同浓度的nano-TiO2刺激肠道上皮细胞(intestinal epithelial cells,IEC-6),观察 nano-TiO2对细胞活性和炎症因子表达的影响,探讨nano-TiO2是否导致IEC-6细胞炎症反应及相关分子机制。
1 材料与方法
1.1 实验材料
1.1.1 主要材料和试剂 大鼠小肠隐窝上皮细胞(IEC-6)购于中国科学院昆明细胞库;nano-TiO2粉末,购于德国Degussa公司;DMEM高糖培养基购于美国HyClone公司;胎牛血清购于美国Hyclone公司;0.25%胰蛋白酶-EDTA溶液购于美国Gibco公司;四甲基偶氮唑盐(MTT)购于美国Sigma公司;IL-1β、IL-6和TNF-α双抗体夹心酶联免疫吸附实验(ELISA)试剂盒购于南京森贝伽生物科技有限公司;BCA蛋白定量试剂盒购于北京康为世纪生物技术有限公司;JAK2、p-JAK2、STAT3、p-STAT3抗体、山羊抗兔二抗IgGHRP、Western blot鲁米诺试剂均购于美国Santa Cruz公司。
1.1.2 主要仪器 Olympus IX51倒置相差显微镜购于日本Olympus公司;Esco二氧化碳培养箱购于新加坡Esco公司;JEM-2100型透射电镜购于日本JEOL公司;Zetasizer Nano-ZS90型马尔文粒径分析仪购于英国马尔文仪器有限公司;RT-6000酶标分析仪购于美国Rayto公司;5417R高速冷冻离心机购于德国Eppendorf公司;Mini-Protein 3小型垂直电泳槽购于美国Bio-Rad公司;DYCZ-40D转印电泳槽购于北京六一仪器厂;JY600C电泳仪购于北京君意东方电泳设备有限公司;Tanon 5200化学发光成像系统购于上海天能科技有限公司。
1.2 实验方法
1.2.1 制备nano-TiO2染毒悬液 使用电子天平精确称量10.0 mg nano-TiO2粉末,120℃加热2 h杀菌处理,加入10 mL完全培养基配成1 mg/mL的母液,置于4℃冰箱保存待用。使用前100 Hz超声震荡30 min,根据实验需要稀释成相应浓度。
1.2.2 肠道上皮细胞的培养 将大鼠小肠隐窝上皮细胞(IEC-6)培养于含10%胎牛血清、100 U/mL青霉素与100 mg/mL链霉素的DMEM高糖培养基中,置于37℃、CO2体积分数为5%的培养箱中培养。每隔1 d换液1次,每3~4 d传代一次。当细胞培养至对数生长期时进行实验。
1.2.3 nano-TiO2颗粒表征 取nano-TiO2悬液滴加在铜网上并烘干,在样品表面镀上具有导电性的金膜,将样品放入透射电子显微镜(transmission electron microscope,TEM)样品仓,在加速电压200 kV下,观察nano-TiO2的粒径。取一定量的nano-TiO2染毒悬液,超声处理30 min,使用马尔文粒径分析仪检测nano-TiO2的平均水合粒径、分散系数(polydispersity,PDI)和Zeta电位。
1.2.4 MTT法测定细胞存活率 待IEC-6细胞培养至对数生长期,调整浓度为1×105个/mL,以每孔100μL接种于96孔培养板,在37℃、CO2体积分数为5%的培养箱中培养24 h。待细胞贴壁后分为调零组、对照组和nano-TiO2处理组(浓度分别为5.0、10.0、15.0、20.0μg/mL)培养24 h,每组5个复孔。每孔加入5 mg/mL的MTT溶液10μL继续培养4 h,弃上清。每孔加150μL的DMSO,震荡5~10 min,使结晶物充分溶解。酶标仪检测吸光度D(570)值,并计算细胞存活率。

1.2.5 ELISA法检测IL-1β、IL-6和TNF-α水平 将对数生长期的IEC-6细胞调整浓度为2×105个/mL,以每孔500μL接种于24孔培养板上,待细胞贴壁后,实验分组同1.2.4,处理24 h后取细胞培养液上清3 000 r/min离心20 min,收集离心后的培养液上清。各细胞因子水平应用ELISA双抗体夹心法测定,按照ELISA试剂盒说明书进行,操作完毕后用酶标仪测定吸光度D(450)值。根据标准曲线分别确定样品中IL-1β、IL-6和TNF-α含量。
1.2.6 Western blot法检测JAK2/STAT3蛋白表达及其磷酸化水平 将处于对数生长期的IEC-6细胞以浓度为6×105个/mL接种于直径为6 cm培养皿中,细胞贴壁后,分组同1.2.4,加入nano-TiO2。用RIPA裂解液提取蛋白,在4℃、12 000 r/min条件下,离心15 min,吸取上清,-80℃冰箱保存。用BCA蛋白定量试剂盒确定所得蛋白浓度后,在制备好的分离胶中加入样品,SDS-PAGE电泳,待溴酚蓝到达下层胶的底部停止电泳。蛋白转移至PVDF膜,将膜置于封闭液中37℃封闭2 h,加入成比例稀释的一抗,4℃孵育过夜,加入1∶5 000稀释的二抗室温孵育2 h,ECL显影,使用Image J软件扫描分析条带灰度值。
1.3 统计学方法
所有实验数据均以xˉ±s表示。应用SPSS 17.0软件进行统计学分析,多组之间比较采用单因素方差分析(One-Way ANOVA)。两两比较时,若方差齐则采用LSD-t检验;若不齐则选择Dunnett’s T3检验,以α=0.05为检验水准。
2 结果
2.1 nano-TiO2的表征
TEM检测结果见图1,显示分散在细胞培养基中的nano-TiO2形态不规则,颗粒团聚。粒径仪检测到颗粒的平均水合粒径为(64.59±2.05)nm,PDI为(0.23±0.01),Zeta电位为(-5.27±0.21)mV,上述结果提示nano-TiO2的混合分散体系较为稳定。
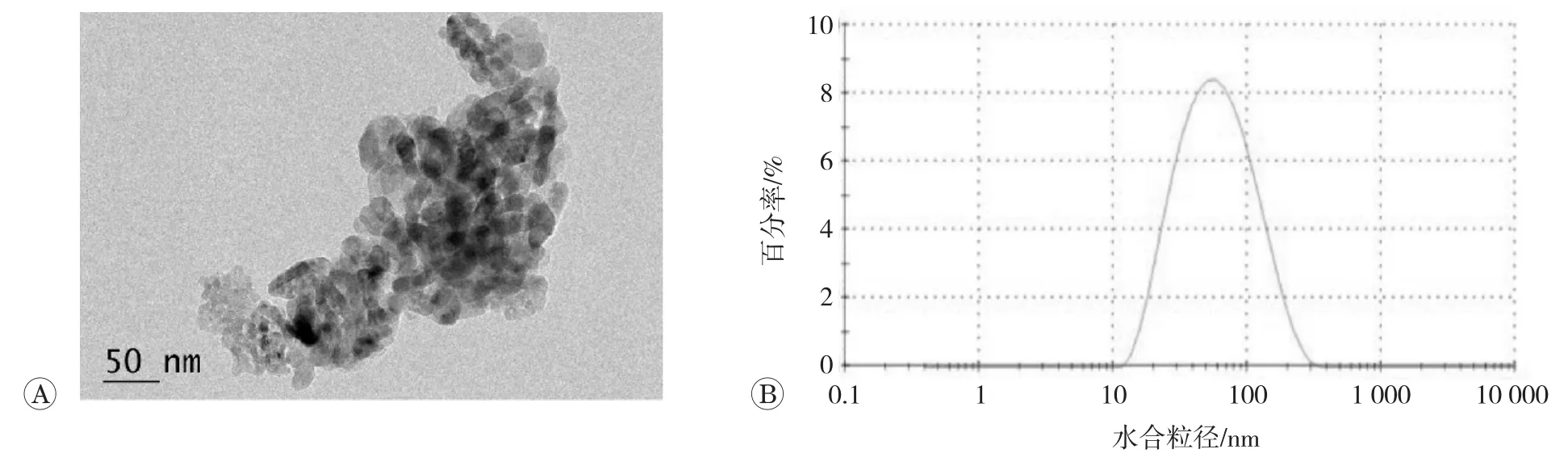
图1 nano-TiO2表征
2.2 nano-TiO2对IEC-6细胞存活率的影响
MTT法测定细胞存活率结果见图2,与对照组相比,各个nano-TiO2处理组(5.0、10.0、15.0、20.0μg/mL)IEC-6细胞活性差异无统计学意义(P>0.05),说明本试验浓度的nano-TiO2对IEC-6细胞活性未产生明显影响。
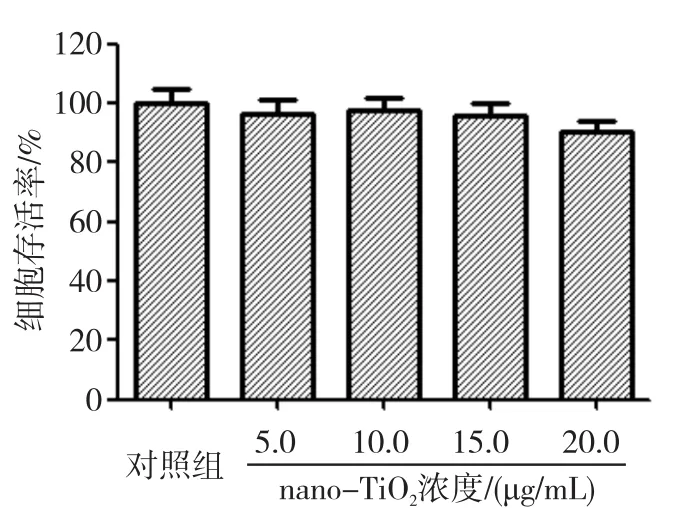
图2 nano-TiO2对IEC-6细胞存活率的影响
2.3 nano-TiO2诱导IEC-6细胞释放IL-1β、IL-6、TNF-α因子
ELISA法测定IEC-6细胞分泌炎症因子结果见图3,IEC-6 细胞给予 10.0、15.0、20.0 μg/mL nano-TiO2染毒处理后,与对照组相比,细胞IL-1β分泌增加(P<0.05);与对照组相比,nano-TiO2各个浓度(5.0、10.0、15.0、20.0 μg/mL)作用组中IEC-6细胞IL-6和TNF-α水平均明显升高(P<0.05),且nano-TiO2染毒剂量与上述促炎性因子分泌水平呈剂量依赖性增加(rIL-1β=0.870, P<0.01; rIL-6=0.938, P<0.01; rTNF-α=0.982,P<0.01)。
2.4 nano-TiO2引起IEC-6细胞JAK2/STAT3蛋白磷酸化
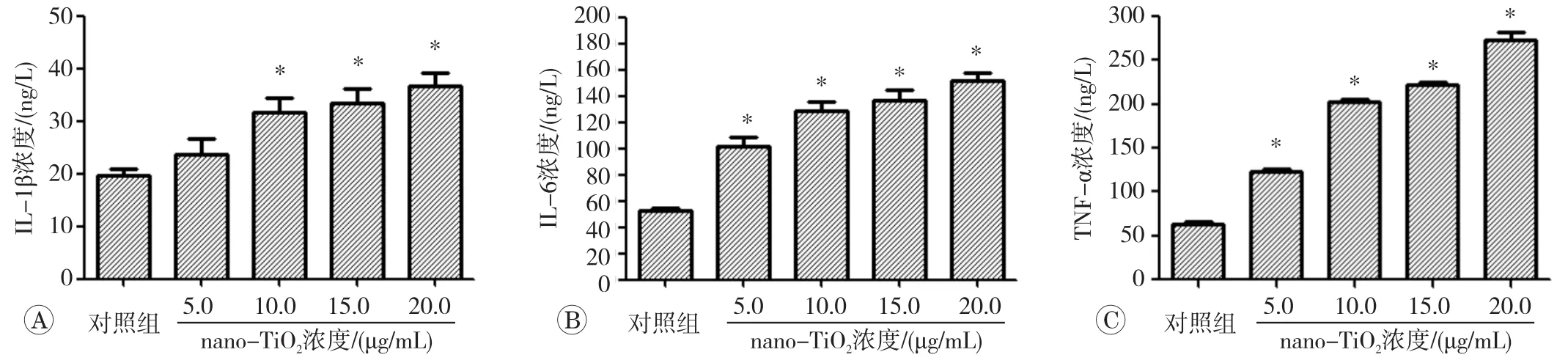
图3 nano-TiO2对IEC-6细胞IL-1β、IL-6和TNF-α水平的影响
Western blot实验的结果见图4,与对照组相比,在浓度为15.0和20.0μg/mL nano-TiO2作用下p-JAK2和p-STAT3蛋白表达水平明显增加(图4A),且p-JAK2和p-STAT3蛋白表达水平与炎症因子分泌水平呈正相关关系(rJAK2,IL-1β=0.561,P<0.05;rJAK2,IL-6=0.711,P<0.01;rJAK2,TNF-α=0.675,P<0.01;rSTAT3,IL-1β=0.782,P<0.01;rSTAT3,IL-6=0.532,P<0.05;rSTAT3,TNF-α=0.668,P<0.01)。灰度值分析结果(图4B和图4C)显示,IEC-6细胞在15.0和20.0μg/mL nano-TiO2作用下,JAK2和STAT3蛋白磷酸化水平明显增加,与对照组相比,差异具有统计学意义(P<0.05)。
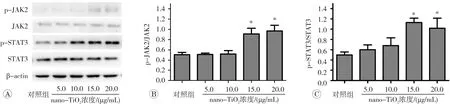
图4 nano-TiO2对IEC-6细胞JAK2/STAT3蛋白磷酸化水平的影响
3 讨论
纳米颗粒作为一种新兴材料,因其具有特殊的物理化学特性被使用于工业、生物医药[6]和食品行业[7]。随着应用途径多样化,纳米颗粒可随食品经口分布于机体肠道。肠道中的肠道屏障主要由肠道上皮细胞和细胞间的紧密连接构成,能有效隔离外源性有害物质到达机体内部。当肠道屏障遭到破坏,可能诱导肠道炎性疾病发生,进而导致结直肠癌[8]。因此,评价nano-TiO2对肠道上皮细胞的毒性效应对nano-TiO2的安全性评估具有重要意义。
本实验结果表明,nano-TiO2对体外培养的IEC-6细胞存活率无显著影响,这与YE等[9]的研究一致。一般来说,nano-TiO2的毒性具有时间和剂量依赖性[10-11]。而本研究的IEC-6细胞仅单次暴露于较低浓度的nano-TiO2且接触时间较短(24 h),可能尚未表现出nano-TiO2的细胞毒性。考虑到各年龄段人群每日经口摄入nano-TiO2的频率和用量的差异性[12],未来可能需要进行高剂量和长期染毒实验进一步确证重复暴露nano-TiO2对人体肠道的影响。
一项有关金属纳米毒性对比的研究发现,不同的金属纳米颗粒对细胞活性的影响差异较大,但是却都能引起细胞相关炎性因子分泌[13]。所以,本研究在发现nano-TiO2不影响IEC-6细胞活性后,我们对nano-TiO2能否引起肠道细胞炎症反应进行评估。本实验结果表明,较低浓度的nano-TiO2(5和10μg/mL)就能刺激细胞显著分泌炎性相关因子。这可能是因为细胞将纳米颗粒识别为外源性物质,极低浓度的nano-TiO2(1×10-3μg/mL)也可能引起细胞一系列炎性反应[14]。然而,Tada-oikawa等[15]发现高于25 μg/mL nano-TiO2浓度作用下,肠道细胞才开始分泌较高水平的IL-1β。出现相悖结果的原因可能是不同细胞种属对nano-TiO2敏感性不一[16],导致反应浓度出现差异。另外,根据晶型分类,常见的nano-TiO2主要来源有3种:锐钛矿、金红石和板钛矿。本实验采用的是与食品添加剂成分相似的锐钛矿与金红石混合物[17],而Tada-oikawa等[15]的研究选用100%纯度的锐钛矿染毒。nano-TiO2成分差异可能是导致不同结果的原因之一。
JAK2/STAT3通路是参与调节炎症反应的重要通路之一。有研究分析发现,IL-6的表达与STAT3磷酸化水平呈正相关关系[18]。本实验在nano-TiO2刺激下,IEC-6细胞中JAK2蛋白和STAT3蛋白磷酸化水平增加,说明JAK2/STAT3信号通路可能被激活。随着nano-TiO2剂量增加,JAK2/STAT3两种蛋白磷酸活化水平与3种炎症相关因子(IL-1β、IL-6和TNF-α)的分泌水平变化趋势一致。因此,我们推断nano-TiO2引起肠上皮细胞炎症因子的表达可能与JAK2/STAT3蛋白磷酸活化相关。研究发现,JAK2通路抑制剂(AG490)能大幅度缓解JAK2/STAT3蛋白的激活和相关炎症因子的产生[19],这提示JAK2/STAT3信号通路参与炎症的发生发展。今后,我们将利用JAK2/STAT3通路的抑制剂探索nano-TiO2是否通过JAK2/STAT3信号通路诱导IEC-6细胞分泌炎症因子。Fukatsu等[20]的研究发现,nano-TiO2的炎症反应在核因子-κB(nuclear factor kappa-B,NF-κB)抑制剂作用下逐渐减轻,表明NF-κB通路同样参与纳米引起的炎症反应。除此之外,nano-TiO2暴露伴有炎症产生的同时还引起小鼠中丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的p38丝裂原活化蛋白激酶(p38 MAPK)表达上调[21]以及细胞中蛋白激酶B(protein kinase B,PKB)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38 MAPK等蛋白磷酸化水平增加[22-23]。由此,我们推断nano-TiO2致生物体产生炎性反应可能与多条信号通路有关,涉及JAK2/STAT3、MAPK家族和PKB等传导途径。
