助听器安全评价分析与若干思考
2019-04-11牛帅塔娜王晓玲
牛帅,塔娜,王晓玲
1 上海市食品药品监督管理局认证审评中心,上海市,200020
2 国家药品监督管理局医疗器械技术审评中心,北京市,100044
0 引言
助听器是一种放大声音、补偿听力损失的电子装置。根据第六次全国人口普查我国总人口数及第二次全国残疾人抽样调查推算,2010年末我国残疾人总人数8 502万人,其中听力残疾2 054万人[1],占全体残疾人口约24%,相当于每4名残疾人,将会出现1名听力残疾人。目前改善听力的主要方式是佩戴助听器。助听器能够有效补偿听障患者的听力损失,提高其生存质量[2]。近年来随着科学技术发展和人们健康意识的提高,助听器普及率越来越高。作为全球最大助听器生产国,助听器的安全问题越来越受到监管部门、医疗机构、生产企业和听障患者等各界广泛关注。
1 国内外对助听器产品的监管情况
1.1 美国FDA对助听器产品的监管情况
美国FDA在2013年发布了一项针对助听器和个人声音放大设备(PSAP)法规(Regulatory Requirements for Hearing Aid Devices and Personal Sound Amplification Products - Draft Guidance for Industry and Food and Drug Administration Staあ)[3],依据两者不同预期用途,采用不同的监管方式。PSAP产品主要用于健听人群,是一种简单放大环境声音的电子产品,不作为医疗器械管理;而助听器产品适用于中度以下的听障患者,预期用于补偿听力损失,需作为医疗器械管理。其中,普通的气导助听器按I类医疗器械进行管理,免于上市前审查;带无线功能的气导助听器按II类医疗器械进行管理,同样免于上市前审查;而骨导助听器和经皮气导助听器按II类医疗器械进行管理,但产品上市前,需要向美国FDA申请上市前审查和批准。所有的助听器产品必须符合相应的法规要求,包括标签、说明书和技术指标等。
1.2 我国对助听器产品的监管情况
我国根据医疗器械风险程度由低到高分为第一类、第二类和第三类。助听器按照第二类类医疗器械进行管理,即具有中度风险,需要严格控制管理以保证其安全、有效。根据《医疗器械监督管理条例》(国务院令第680号),各省局负责辖区境内助听器生产企业提交的注册申请,国家食品药品监督管理部门负责境外助听器生产企业提交的注册申请。
国家食品药品监督管理总局2016年发布了《助听器注册技术审查指导原则(2016年修订版)》[4],这是由广东省食品药品监督管理局审评认证中心牵头起草的指导文件,旨在指导注册申请人申报工作和技术审评部门的审查工作。这份指导原则的发布一定程度上统一了各方认识,有效支持了政府监管。
2 国内助听器监管存在的问题
2.1 助听器产品审评审批尺度不一
与美国FDA不同,我国实行医疗器械分级审批,境内第二类医疗器械的审评、审批由其所在省局负责。目前国内尚未发布助听器产品安全专标,且作为一种小型医疗器械,安全问题容易被忽视。各省局对助听器指导原则的理解和执行尺度不一,为助听器监管带来挑战[5]。广东省食品药品监督管理局2018年省内监督抽查通告显示[6],在助听器抽检51批中14批不符合标准要求。助听器合格率仅为72.5%,不符合产品涉及2个外省8家公司产品,主要原因是设备或设备部件的外部标记。
2.2 标准协调性问题
根据指导原则,助听器安全评价分为两部分:电气安全要求和电磁兼容性要求。由于国内尚未发布助听器产品安全专标,指导原则中电气安全要求引用了通用标准GB 9706.1—2007;针对电磁兼容性要求(EMC),指导原则直接引用了GB/T 25102.13—2010。目前YY 0505—2012作为GB 9706.1—2007的并列标准,是医用电气设备电磁兼容通用要求已形成共识。而GB/T 25102.13—2010仅考虑了无线电话系统产生射频电磁场对助听器的影响,与YY 0505—2012的试验项目、试验要求方面差别较大。江苏省医疗器械检验所的傅金德等结合注册检验和监督检验工作中贯彻GB 9706.1—2007标准情况,开展了相关研究,总结助听器产品在外部标记、漏电流检测、YY 0505—2012标准引用等问题以及监管面临的挑战。
2.3 助听器产品上市后监管有待完善
医疗器械上市后监管包括了不良事件监测、再评价等制度。随着助听器普及率越来越高,与之相关的监管要求也应随之提高。我国尽管发布了《医疗器械不良事件监测与再评价管理办法》等法规,但整体风险管理水平还比较弱。
以医疗器械不良事件监测为例,在我国主要由监测机构负责对报告进行收集,并在体系内进行封闭式评价和消化,缺少生产企业的参与[7]。而药监局官网没有具体企业及产品的相关风险信息情况或不良事件查询端口,医疗机构、生产企业和患者不能有效利用这些监管资源,难以形成正面反馈。而欧美、日本等国家已经形成较完善不良事件监测机制。笔者通过查询美国FDA不良事件数据库,选取2014年-2018年涉及助听器不良事件中28件进行了整理,暴露出儿童吞咽电池、过敏、电池寿命问题等9种问题,见表1。
从表1看出,耳模脱落于耳道是助听器暴露最多的安全事件,轻者造成使用者不适,严重者甚至需要通过外科手术取出。其他如电池问题、过量声输出、耳钩结构断裂也会一定的概率出现。通过对以上现象进行分析和评价,能够帮助监管部门发现助听器上市后的安全隐患,及时采取控制和干预措施,有效保障用械安全。

表1 美国FDA数据库28件助听器不良事件Tab.1 Twenty-eight adverse events of hearing aids in FDA database
3 对助听器安全评价的建议
3.1 标准层面
助听器产品缺少安全专标和国际标准转化滞后,是造成标准协调性问题的主要原因,比较见表2。鉴于助听器产品的特殊性,国际电工委员会(IEC)在通用安全标准IEC 60601-1的基础上,发布了最新安全专用标准IEC 60601-2-66:2015[8],其对以下几个方面进行了修改和补充:①明确外部标记的要求;②说明书增加助听器专用功能、警告信息、操作指令、清洗消毒等内容;③增加了锋利边缘、声输出、缠绕、助听器部件遗落耳道的危害的要求;④豁免了通用标准里不适用的条款。助听器最新EMC标准IEC 60118-13:2016[9]对试验项目和试验要求有很大调整,包含了辐射骚扰、静电放电、射频电磁场辐射和工频磁场的抗扰度要求,与EMC通用标准IEC 60601-1-2:2014协调一致,并更符合助听器产品特点。
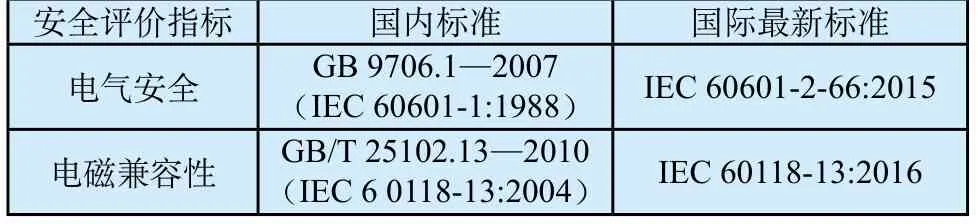
表2 国标与国际最新安全评价标准比较Tab.2 The comparison of national and international safety evaluation standard
目前我国医疗器械标准体系不包含电声学领域[10]。电声学相关标准制修订由全国电声学标准化技术委员会负责。推动IEC 60601-2-66:2015的转化,有助于填补空白领域,对完善我国医疗器械标准体系有重要意义。加快IEC 60118-13:2016的转化也将与国际电磁兼容性实施要求相匹配,统一市场准入要求。
3.2 技术审评层面
我国已发布的《助听器注册技术审查指导原则(2016年修订版)》从产品名称要求、结构组成、工作原理、注册单元划分、适用标准、适用范围、主要风险、主要性能指标、说明书和标签要求等14个方面对助听器审查要点进行了详细说明。以下结合助听器产品特点,在指导原则基础上从安全评价角度细化分析,希望对相关方有所帮助。
电击危险的防护方面,单独由内部电池供电的助听器可认为是安全的,无需与其它有源设备一样,强调GB 9706.1—2007安全通标要求的漏电流和电解质强度等试验。应重点关注在不同环境下与其他设备的连接,连接至符合要求的外部设备上。
机械危险的防护方面,助听器外壳应避免出现尖角及锐边,尤其在接口边沿、电池仓门和编程器接口部分;助听器部件在放入或从耳道拔出时,不易于脱落,若有相关风险,说明书应有避免和解决问题的办法;结构设计应考虑防止儿童错误吞咽。
生物和化学危害防护方面,与患者接触部分的材料按照GB/T 16886.1—2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》[11]的要求进行生物相容性试验和研究,如耳模、耳塞等。考虑到对电池进行不正确充电可能导致的膨胀和泄漏,在审查时应注意电池仓的结构和标识是否足够清晰明确。
声能和噪音防护方面,助听器应对最大声输出进行控制,防止患者暴露在非预期声环境中,并明确告知患者和医疗机构产品的最大声输出。
使用环境方面,助听器大多使用在家庭环境,由患者独立使用,缺乏专业医护人员指导和培训,使用不当是助听器安全风险的最大特点。应关注产品可用性引入的风险,重点考虑对助听器放入、移出耳道等关键功能和换电池、清洁、开关机和调节音量等常用功能加以验证和说明。同时与心脏起搏器类似,助听器也应考虑特殊的风险,如做磁共振检查或处于强磁场环境,应摘除并关闭助听器;对于含无线功能的助听器在乘飞机时,应按照航空公司要求使用和关闭该功能。
软件方面,除助听器指导原则中指明《医疗器械软件注册技术审查指导原则》要求[12]外,还需结合之后发布的《医疗器械网络安全注册技术审查指导原则》[13]、《移动医疗器械注册技术审查指导原则》[14]。全球已迈入数字化、智能化和网络化时代,无线通信技术广泛应用在助听器中,用以实现双耳同步、远程数据传输或与智能手机等生活工具连接进行远程控制[15]。助听器网络安全风险包括患者信息数据泄露或者非预期运行导致患者伤害等。因此在审查中重点关注:网络安全基本信息描述是否完整;软件版本命名规则是否涵盖网络安全;网络安全能力是否进行充分验证与确认等问题。
3.3 监管层面
我国已是助听器生产第一大国,监管部门需要利用科学化、规范化的监管手段服务产业发展,根据科学技术的不断发展,不断完善法规、标准体系。同时随着助听器普及率越来越高,与之相关的不良事件也将随之增多。助听器生产、经营和使用各环节,均应履行上报义务,支持医疗器械不良事件监测工作,与监管部门对助听器安全评价工作形成正向反馈,及时应对安全隐患,有效保障用械安全。
4 总结
虽然我国已出台助听器安全评价的标准和相应指导原则,但有待进一步完善。本文分析了国内外助听器监管现状,从安全评价标准协调性、技术审查角度,对助听器安全评价角度提出建议,希望对注册申报和监管有所帮助。
