利用乙酰微小杆菌GL-3脱除废弃虾壳中蛋白质和钙质的研究
2019-04-10丁振中雷鹏邓红兵张超曾哲灵
丁振中 雷鹏 邓红兵 张超 曾哲灵
摘 要:该研究从高邮湖底的淤泥中分离到一株能够高效分解废弃虾壳粉中蛋白质的菌株GL-3,经16S rDNA测序鉴定为乙酰微小杆菌(Exiguobacterium acetylicum)。发酵实验表明,GL-3可以以废弃虾壳粉为唯一营养源,降解其中的蛋白质和钙素,发酵8d后,虾壳粉中蛋白质含量由初始的33.2%降低到6.4%,蛋白脱除率为94.8%,钙元素含量由初始的16.8%降低到4.5%,钙素脱除率为92.8%,且GL-3对虾壳粉的处理量可达10%。当葡萄糖的添加量在15%时,虾壳粉中的蛋白质含量仅在第5天时,就降低到了3%,钙含量降低到了2.7%,与未添加糖相比,蛋白质和钙的脱除率和脱除效率均显著提高。
关键词:废弃虾壳 乙酰微小杆菌 脱蛋白 脱钙
中图分类号:TS254.9 文献标识码:A 文章编号:1672-3791(2019)12(b)-0076-03
甲壳素是地球上仅次于纤维素的第二丰富的天然聚合物。在自然界中,它通常与其他多糖和蛋白质结合。虾、蟹等甲壳纲节肢动物的外壳,是工业制备甲壳素的主要原料。据报道,虾蟹壳中甲壳素含量为20%~30%,碳酸钙含量为30%~50%,蛋白质含量为30%~40%[1]。因此,要从虾蟹壳中提取壳聚糖需要除去其中大量的碳酸钙和蛋白质。目前,国内大多数厂家从虾蟹壳中提取甲壳素都采用“稀酸脱钙”“稀碱脱蛋白”的双脱工艺,这种工艺产生大量的含蛋白的碱性废水、含钙盐的酸性废水以及各工序的洗涤废水[2]。按照当前的工艺,每生产1t壳聚糖能产生350~500t废水。因此,探索更为绿色的羧甲基壳聚糖制备工艺成为羧甲基壳聚糖生产行业亟待解决的重要课题。
近年来,随着生物工程技术的发展,越来越多的废弃资源能够通过微生物发酵技术进行处理或者资源再利用,这就为从虾蟹壳到甲壳素的工艺过程提供了取代传统酸碱提取法的思路,即利用生物法对虾蟹壳进行预处理,实现蛋白质和碳酸钙的脱除,这也成为科研人员开发甲壳素绿色制备工艺的新的聚焦点。
1 材料与方法
1.1 虾壳粉
废弃虾壳采购自高邮水产加工厂。将新鲜废弃吓壳用清水洗3次,除去表面脏质,然后于干燥箱中80℃烘干,再用粉碎机粉碎后,过200目筛网,即可得到虾壳粉。
1.2 菌种的分离与鉴定
称取1g取自高邮湖底的淤泥,加入9mL无菌水,振荡混匀后用无菌水稀释104倍,然后将100μL稀释液均匀涂布于虾壳粉琼脂培养基(3%的虾壳粉,1.5%琼脂,pH7.0)上,进行初筛。将平板至于37℃培养3d。将长出的菌落挑取单克隆于新鲜的虾壳粉琼脂培养基上划线纯化。将分离出来的菌株用1mL无菌水稀释后,涂布到酪蛋白琼脂平板上测试蛋白水解活性。挑选蛋白水解活性最高的菌株,通过形态学观察和提取16S rDNA测序进行分类鉴定。
1.3 废弃虾壳粉的发酵处理
称取150mg虾壳粉,加入50mL自来水,控制初始pH值为7.0,置于250mL摇瓶中,灭菌后,按照10%的接种量接入种子液(种子培养基为LB培养基,培养时间为24h,培养温度为37℃),将摇瓶置于摇床上振荡培养,控制培养温度为37℃,摇床转速为200rpm。
1.4 取样与分析
取样时,将发酵液采用抽滤法过滤纸,滤渣用清水清洗抽滤3次,即可得到发酵后的虾壳粉,置于烘箱中60℃烘干,烘干后粉末用于后续分析。
虾壳粉蛋白含量采用Lowry法测定。
钙含量测定:先用2M的盐酸溶液浸提24h后,离心取上清液,用离子火焰光度计测定。
2 结果与分析
2.1 高效降解废弃虾壳粉蛋白菌株的筛选与鉴定
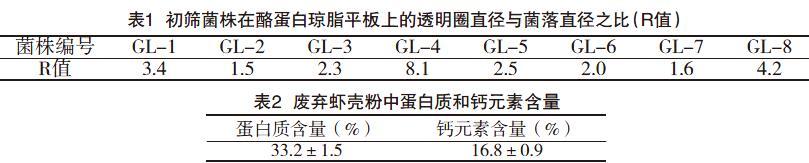
该研究以废弃虾壳粉为唯一碳源,以高邮湖底淤泥为菌种来源,在初筛培养基上筛选得到8个具有明显不同形态的单菌落,分别编号为GL-1~GL-8。在复筛时,利用酪蛋白琼脂平板透明圈法,对初筛的8株菌进行了比较。如表1所示,为8株菌在酪蛋白琼脂平板上水解蛋白产生的透明圈直径与其菌落直径的比值R,由该比值可知,菌株GL-3水解蛋白能力显著高于其余7株菌,因此确定菌株GL-3作为后续发酵法处理废弃虾壳粉的候选菌株。
通过对GL-3进行16S rDNA测序,测序结果在NCBI数据库中比对发现,GL-3的16S rDNA序列与乙酰微小杆菌相似度达100%,因此判断GL-3为乙酰短杆菌,并命名为Exiguobacterium acetylicum GL-3。乙酰微小杆菌在发酵水产动物蛋白方面一直都有相关报道。李燕等人对黄山臭鳜鱼发酵过程中的细菌群落结构组成进行研究,从中鉴定出了乙酰微小杆菌[3]。此外,乙酰微小杆菌也被认为是在低温及极端环境中,食物中主要的腐败菌[4]。因此,乙酰微小杆菌对蛋白质的分解能力较强,且容易产生酸性分泌物,从而脱除虾壳粉中的碳酸钙。
2.2 Exiguobacterium acetylicum GL-3發酵废弃虾壳粉分析
2.2.1 发酵时间的确定
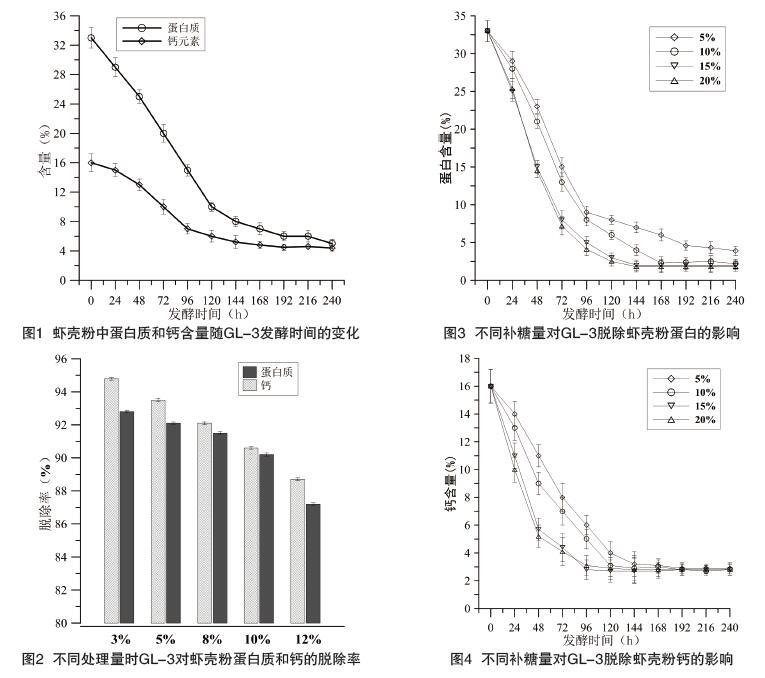
该研究所用的虾壳粉中蛋白质含量和钙元素含量如表2所示,干燥的虾壳粉中蛋白质含量为33.2%,钙元素含量为16.8%,与文献报道基本一致。该研究以3%的废弃虾壳粉作为处理量,考察了Exiguobacterium acetylicum GL-3对虾壳粉的处理周期,结果如图2所示。发酵8d后,虾壳粉中蛋白质含量由初始的33.2%降低到6.4%,蛋白脱除率为94.8%,钙元素含量由初始的16.8%降低到4.5%,钙素脱除率为92.8%。该研究表明,利用Exiguobacterium acetylicum GL-3对废弃虾壳粉进行发酵处理,脱除其中的蛋白质和钙元素具有较强的可行性,且处理周期在8d时可达到最佳效果。
2.2.2 废弃虾壳粉处理量的确定
为最大程度地降低发酵成本,该研究分别考察了处理时间8d,处理量为3%、5%、8%、10%、12%时,Exiguobacterium acetylicum GL-3对虾壳粉中蛋白质和钙素的脱除率。结果如图2所示,随着处理量的提高,蛋白质和钙元素的脱除率逐渐下降,当处理量在10%时,蛋白质和钙元素脱除率分别为90.6%、90.2%,继续提高处理量后,脱除率均低于90%。因此,在保证蛋白质和钙元素脱除率在90%以上的基础上,最高处理量可达10%。
2.2.3 外源添加糖分对虾壳粉处理效率的影响
根据该研究的结果(见图1和图2)尽管处理量可以提高到10%,但是处理周期8d,对于在工业上应用依然存在成本过高的问题,特别是面临较高的能耗成本和人工成本。利用GL-3处理废弃虾壳粉周期长的主要原因在于,该研究中(见图1和图2)都是采用了废弃虾壳粉作为GL-3的唯一营养源。尽管虾壳粉中蛋白质来源丰富,但是可供GL-3直接利用的碳源确相对偏少,因此导致GL-3在处理虾壳粉时,生长周期较长。而添加适量的碳源,有助于促进GL-3的生长,减少发酵周期,从而进一步降低虾壳粉的处理成本。葡萄糖作为发酵工业上最常用的碳源之一,具有价格低廉、适用性广等优点,因此该研究考察了葡萄糖添加对GL-3处理虾壳粉的影响。如图3、图4所示,虾壳粉处理量均为10%,添加葡萄糖显著提高了GL-3对虾壳粉中蛋白质和钙的脱除效率,当葡萄糖的添加量在15%时,虾壳粉中的蛋白质含量仅在第5d时,就降低到了3%,钙含量降低到了2.7%,与未添加糖相比,蛋白质和钙的脱除率和脱除效率均显著提高。当葡萄糖添加量为20%时,蛋白质和钙的脱除率和脱除效率与添加量为15%时差异不再显著,因此,从经济角度考虑,以15%的葡萄糖添加量最为合适。
3 讨论
近年来,随着国家对环保型生产的要求逐步提高,利用生物法对虾蟹壳进行预处理,实现蛋白质和碳酸钙的脱除,成为科研人员开发甲壳素绿色制备工艺的新的聚焦点。Zakaria(1998)最早使用一株副干酪乳杆菌(Lactobacillus paracasei strain A3)对废弃虾壳进行发酵处理,在30℃下,发酵5d后,蛋白质去除率为77.5%,钙的去除率为61.0%。随后,越来越多的菌属被用于虾蟹壳的脱蛋白及脱钙处理,包括植物乳杆菌、乳酸杆菌、乳酸球菌、嗜热链球菌、枯草芽孢杆菌、蜡状芽孢杆菌、地衣芽孢杆菌、绿脓假单胞菌、粘質沙雷氏菌、片球菌等。其中在脱蛋白和除碳酸钙效率方面,以乳酸菌和芽孢杆菌属具有较大的优势。Rao(2000)等使用植物乳杆菌(Lactobacillus plantarum 541),于30℃发酵虾壳48h,蛋白去除率为88%,碳酸钙去除率为90%;Cira(2002)等使用乳酸杆菌(Lactobacillus spp. B2),于塔式反应器中发酵虾蟹壳,30℃发酵6d后,碳酸钙的去除率为85%,蛋白质去除率为87.6%;Arbia(2013)等通过优化瑞士乳杆菌的培养基成分和培养条件,可以达到98%和78%的碳酸钙和蛋白质脱除率[1]。
该研究从高邮湖底的淤泥中分离到一株能够高效分解废弃虾壳粉中蛋白质的菌株GL-3,经16S rDNA测序鉴定为乙酰微小杆菌(Exiguobacterium acetylicum)。发酵实验表明,GL-3可以以废弃虾壳粉为唯一营养源,降解其中的蛋白质和钙素,发酵8d后,虾壳粉中蛋白质含量由初始的33.2%降低到6.4%,蛋白脱除率为94.8%,钙元素含量由初始的16.8%降低到4.5%,钙素脱除率为92.8%,且GL-3对虾壳粉的处理量可达10%。当葡萄糖的添加量在15%时,虾壳粉中的蛋白质含量仅在第5d时,就降低到了3%,钙含量降低到了2.7%,与未添加糖相比,蛋白质和钙的脱除率和脱除效率均显著提高。综上该研中的Exiguobacterium acetylicum GL-3与文献报道的菌株相比,无论是在蛋白个钙质脱除率上,还是在脱除效率方面,均展现了较为显著的优势,具有产业化应用的可能。
参考文献
[1] Arbia W, Arbia L, Adour L, et al. Chitin extraction from crustacean shells using biological methods - a review[J]. Food Technology & Biotechnology,2013,51(1): 12-25.
[2] 卓双文,章汝平,林水东.虾、蟹壳制备甲壳素工艺探讨[J].龙岩学院学报,2009,27(5):61-64.
[3] 李燕,吴佳佳,张井,等.PCR-DGGE 技术分析传统臭鳜鱼发酵过程中细菌群落结构[J].食品科学,2017,38(18): 29-34.
[4] 高灿灿,刘佳玫,栗军杰,等.检测乙酰微小杆菌的双重实时荧光定量聚合酶链式反应方法的建立[J].浙江大学学报:农业与生命科学版,2017,43(2):153-162.
