莫西沙星对自发性糖尿病GK大鼠血清胆汁酸谱的影响及与其所致高血糖的相关性
2019-04-10俞蕴莉王猛猛屈昱晨
郝 刚,陈 莉,俞蕴莉,王 吉,王猛猛,屈昱晨
(1.苏州市药品检验检测研究中心,江苏 苏州 215104;苏州大学附属第二医院2.临床药理实验室,3.肿瘤科,江苏 苏州 215004)
氟喹诺酮类药物是一类化学合成抗菌药,由于其普遍具有良好的耐受性和广谱抗菌活性,作为一线抗感染化疗药物在临床上广泛使用,主要用于治疗尿路、肠道、呼吸道以及皮肤软组织、腹腔和骨关节等感染,取得良好疗效。糖尿病患者极易发生皮肤感染、肺炎以及泌尿系统感染。氟喹诺酮药物是糖尿病患者的常见用药。然而,在氟喹诺酮类药物广泛应用的同时,其临床应用的安全性日益受到人们的重视。近年来,人们越来越关注这类药物造成血糖异常的不良反应,而且,研究发现糖尿病能增大氟喹诺酮药物诱发糖代谢障碍的风险[1-2],并且高血糖的发生率高于低血糖。在我国台湾地区的一项研究发现,莫西沙星(moxifloxacin,Mox)导致血糖升高的发生概率高于左氧氟沙星和环丙沙星[3]。目前,氟喹诺酮药物引起血糖升高的机制并不清楚,可能是药物直接作用于糖代谢过程,也可能是多种因素的共同作用结果[4]。
有文献报道,抗生素由于影响肠道菌群以及一些胆汁酸转运体的表达而能影响体内胆汁酸组成[5-7]。胆汁酸是一类胆烷酸的总称,是胆汁的主要成分。肝细胞内胆固醇在CYP7A1等代谢酶的作用下最终生成初级胆汁酸,胆酸(cholic acid,CA)和鹅去氧胆酸(chenodeoxycholic acid,CDCA)与甘氨酸或牛磺酸结合生成结合型胆汁酸储存于胆囊分泌进入十二指肠,在肠道菌的作用下,进行7-α脱羟作用生成次级胆汁酸,去氧胆酸(deoxycholic acid,DCA)和石胆酸(lithocholic acid,LCA)[5]。近年来,对于胆汁酸生理作用的认识已从最初的促进脂肪消化吸收扩展到对机体多种功能的调控作用,包括调控代谢过程,胰岛素敏感性以及肠道内分泌功能[6-7]。肠道胆汁酸的吸收、转运以及体内胆汁酸代谢过程对维持机体脂类代谢和糖代谢的稳态具有重要的作用。
然而,氟喹诺酮药物对胆汁酸谱的影响目前并不清楚。本研究选择临床常用的氟喹诺酮药物Mox,以自发性2型糖尿病GK大鼠为糖尿病模型,旨在研究Mox对糖尿病状态下血中胆汁酸组成的影响,并从胆汁酸代谢谱的角度初步评价其与Mox引起血糖波动的相关性,为氟喹诺酮药物的临床合理应用提供新的理论依据。
1 材料与方法
1.1 动物、药品、试剂和仪器
自发性2型糖尿病GK大鼠,SPF级,雄性,8~9 周龄,体质量217~235 g;正常 Wistar大鼠,SPF级,雄性,体质量219~227 g,均由上海斯莱克实验动物有限责任公司提供,动物许可证号:SCXK(沪)2012-0002。大鼠饲养于苏州药品检验检测研究中心。自然光照、室温20~24℃,普通饲料喂养,自由进食和饮水。本研究开展前经苏州市药品检验检测研究中心实验动物伦理委员会审批通过。
Mox(生产批号BJ40141)由德国拜耳公司生产,拜耳医药保健有限公司分装。CA(批号:SLBH1420V,纯度≥98%)、DCA(批号:BCBQ4388V,纯度≥98%)、CDCA(批号:MKBS2816V,纯度≥97%)、熊去氧胆酸(ursodeoxycholic acid,UDCA,批号:SLBQ1474V,纯度≥99%)、LCA(批号:BCBS3684V,纯度≥95%)、牛磺胆酸(taurocholic acid,TCA,批号:SLBQ5062V,纯度≥98%)、牛磺去氧胆酸(taurodeoxycholic acid,TDCA,批号:SLBR0659V,纯度≥98%)、牛磺鹅去氧胆酸(taurochenodeoxycholic acid,TCDCA,批号:SLBR7538V,纯度≥97%)、牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDCA,批号:026M4184V,纯度≥95%)、牛磺石胆酸(taurolithocholic acid,TLCA,批号:SLBQ8462V,纯度≥98%)、甘氨胆酸(glycocholic acid,GCA,批号:SLBR1284V,纯度:≥ 97%)、甘氨去氧胆酸(glycodeoxycholic acid,GDCA,批号:BCBN5741V,纯度≥97%)、甘氨鹅去氧胆酸(glycochenodeoxycholic acid,GCDCA,批号:SLBM3327V,纯度≥97%)、甘氨熊去氧胆酸(glycoursodeoxycholic acid,GUDCA,批号:BCBR4054V,纯度≥96%)以及 2,2,3,4,4-5氘代石胆酸(D5-LCA,批号:SH1094V,纯度为98 atom%D)购自美国Sigma-Aldrich公司,甘氨石胆酸(glycolithocholic acid,GLCA,批号:1-TMH-13-4,纯度:≥98%)由J&K科技公司提供,乙腈为色谱纯,醋酸铵为分析纯,水为灭菌注射用水。葡萄糖检测试剂盒购自南京建成生物工程研究所。
串联质谱检测系统:API-4000型三重四级杆串联质谱仪(美国Applied Biosystem Sciex公司),1200系列高效液相色谱仪(美国Agilent公司)。
1.2 动物分组和给药
大鼠适应性饲养1周后,以正常Wistar大鼠作为正常对照组。GK大鼠随机分为模型组和Mox 40 mg·kg-1组,每组5只。Mox组大鼠每天ig给予Mox 40 mg·kg-1,体积为0.01 mL·g-1体质量,连续7 d,模型组及正常对照组大鼠用溶媒(0.25%CMCNa)代替。最后一次给药后,各组大鼠禁食不禁水过夜。实验第8天,各组大鼠ip给予戊巴比妥钠 60 mg·kg-1,颈动脉插管采血,经(2~8)℃,1800×g,离心10 min后,取血清于-80℃冰箱保存。样本采集后,动物在麻醉状态下处死。葡萄糖检测试剂盒测定大鼠空腹血糖,LC-MS/MS法测定各组大鼠血清中15种胆汁酸(CA,CDCA,UDCA,LCA,DCA,TCA,TCDCA,TUDCA,TLCA,TDCA,GCA,GCDCA,GUDCA,GLCA和GDCA)浓度。使用Heml 1.0.3.7软件产生各组间15种胆汁酸成分的热图。
1.3 HPLC-MS/MS法测定大鼠血清中15种胆汁酸成分的浓度
血清样本预处理:吸取200 μL血清样本至1.5 mL塑料离心管中,加10 μL内标工作液后再加400 μL乙腈沉淀蛋白,涡旋1 min,于20 000×g,4℃离心10 min。取上清至1.5 mL塑料离心管中,用真空浓缩仪65℃挥干溶剂,100 μL甲醇:水=1∶1(V/V)复溶,涡旋1 min,20 000×g,4℃离心10 min,取上清至进样瓶中,最终进样10 μL分析测定。
色谱条件:使用色谱柱Xterra RP18(4.6 mm×150 mm,5 μm),保护柱 Phenomenex Security Guard TMC18预柱(4 mm×3.0 mm);流动相为10 mmol·L-1醋酸铵水溶液(A)和乙腈(B),梯度洗脱组成见表1,流速为1000μL·min-1,进样体积为10 μL。
质谱条件:电喷雾离子源,负离子检测,扫描方式多反应监测(MRM)。电喷雾电压:-4200 V,碰撞气:4 psi;气帘气:30 psi;雾化气:50 psi;辅助气:50 psi;离子源温度:500℃。15种胆汁酸及内标优化后的质谱参数(母离子,子离子,锥孔电压,碰撞能量)及保留时间见表2。

Tab.1 Composition of mobile phase
1.5 统计学分析
2 结果
2.1 莫西沙星对GK大鼠血糖的影响
血糖测定结果(图1)显示,和正常对照组〔(6.0±0.7)mmol·L-1〕相比,模型组GK大鼠空腹血糖〔(15.7±2.1)mmol·L-1〕显著升高(P<0.01),Mox 40 mg·kg-1连续ig给予GK大鼠7 d后,空腹血糖浓度〔(22.0±6.0)mmol·L-1〕进一步升高(P<0.05),提示Mox引起高血糖。
2.2 Mox对GK大鼠血清中15种胆汁酸成分浓度的影响
血清中15种胆汁酸成分浓度测定(表3)及热图结果(图2)显示,与正常大鼠相比,模型组大鼠游离型胆汁酸中仅DCA增加0.67倍(P<0.01),其余游离型胆汁酸均显著减少(P<0.01),其中CA减少89%,CDCA减少56%,UDCA减少99%,LCA减少76%;各型牛磺酸结合型胆汁酸均有不同程度的增加,TCA增加6.2倍(P<0.05),TCDCA增加8.6倍(P<0.01),TUDCA增加3.3倍(P<0.01),TLCA增加15.7倍(P<0.01),TDCA增加15.9倍(P<0.01)。而各型甘氨酸结合型胆汁酸的改变并无统计学差异。
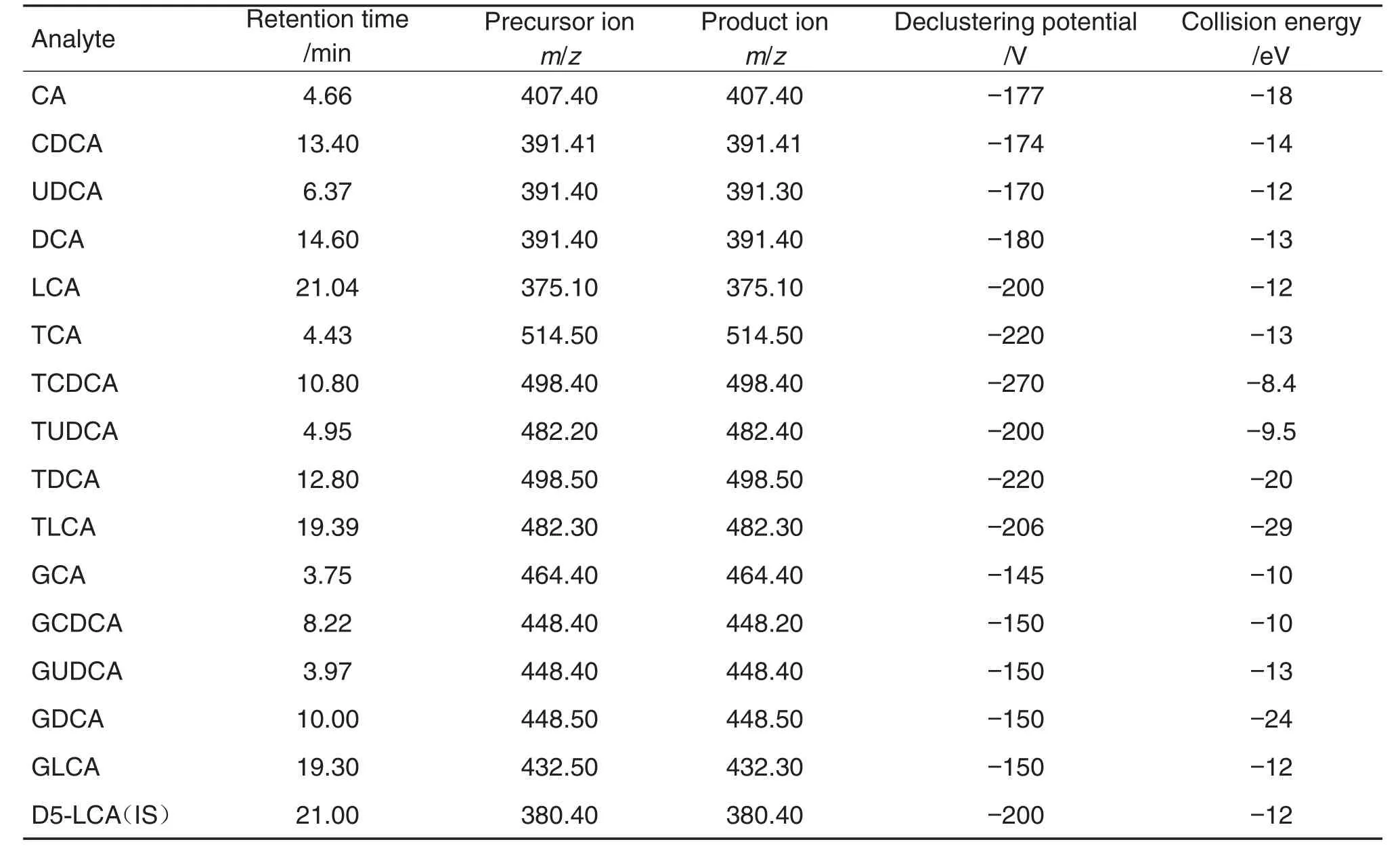
Tab.2 Retention time and mass spectrum conditions of 15 types of bile acids
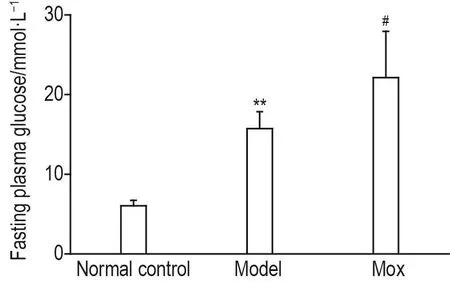
Fig.1 Effect of moxifloxacin(Mox)treatment on fasting serum glucose in GK rats.Normal control and model group rats were ig given 0.25%CMCNa(vehicle),Mox rats were ig given Mox 40 mg·kg-1for 7 d,respectively.±s,n=5.**P<0.01,compared with normal control group;#P<0.05,compared with model group.
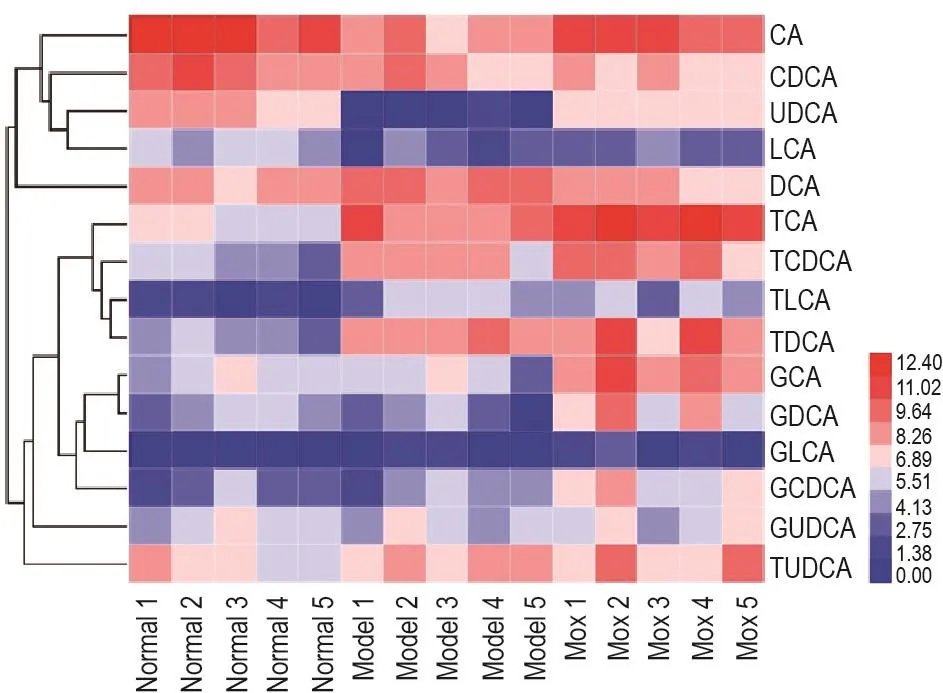
Fig.2 Effect of Mox on bile acid profiles in serum of GK rats by heatmap presentation.See Fig.1 for the rat treatment.The heatmap was generated using HemI 1.0.3.7.Red indicates an increased value,whereas blue indicates a decreased value.
连续ig给予Mox 7 d后,比较给药组GK大鼠与模型组GK大鼠血清中的胆汁酸代谢谱。结果发现,Mox处理组GK大鼠血中CDCA浓度降低50%(P<0.05),DCA降低60%(P<0.01),而血中CA,UDCA,TCA,TDCA,GCA,GCDCA及GDCA分别增加了3.4倍(P<0.01)、9.9倍(P<0.01)、5.7倍(P<0.05)、27.1倍(P<0.05)、4.1倍(P<0.05)和12.0倍(P<0.05),其余胆汁酸成分浓度与模型组大鼠相比无统计学显著改变。
2.3 Mox对GK大鼠血清初级胆汁酸/次级胆汁酸、结合型胆汁酸/游离型胆汁酸、12 α羟基化胆汁酸/12 α未羟基化胆汁酸及疏水指数的影响
根据胆汁酸的不同分类,进一步进行分类(表4)比较(图3),在正常大鼠血清胆汁酸代谢谱中,初级胆汁酸与次级胆汁酸比值为10.1±2.6,结合型胆汁酸与游离型胆汁酸比值为0.10±0.02,12α羟基化胆汁酸与12α未羟基化胆汁酸比值为3.0±1.0,而在GK大鼠血清胆汁酸代谢谱中,三者比值分别为初级胆汁酸与次级胆汁酸(1.9±0.6,P<0.01)显著降低,结合型胆汁酸与游离型胆汁酸(1.5±0.4,P<0.05)显著升高,12α羟基化胆汁酸与12α未羟基化胆汁酸比值为2.2±1.1,与正常大鼠相比略有下降,但无统计学差异。Mox组大鼠血中胆汁酸代谢谱以上3项比值较模型组GK大鼠均显著升高,分别为6.3±1.4,4.5±1.4和6.2±2.8(P<0.05)。
对比各组大鼠疏水性指数(hydrophobicity index,HI)值,发现正常对照组大鼠HI为0.22±0.05,模型组GK大鼠血清胆汁酸池的HI值显著升高(0.31±0.08,P<0.05),Mox给药后GK大鼠血清胆汁酸池的HI值下降为0.18±0.04,与正常组大鼠相比无显著性改变(图3)。

Tab.4 Subgrouping of measured bile acids
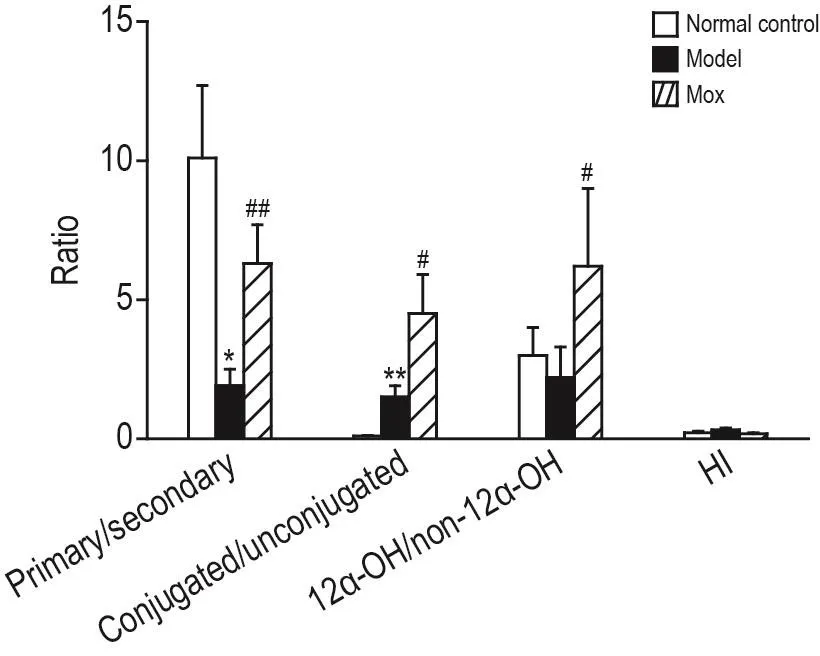
Fig.3 Ratio of primary/secondary bile acids,conjugated/unconjugated bile acids and 12 α-OH/non-12 α-OH bile acids.See Fig.1 for the rat treatment.±s,n=5.HI:hydrophobicity index.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.4 莫西沙星引起胆汁酸代谢谱改变与其所致血糖波动的相关性评价
采用Pearson相关性分析评价3组大鼠血糖与胆汁酸代谢谱变化的相关性。结果表明(表5),大鼠血糖改变与血清中结合型胆汁酸/游离型胆汁酸比值的相关系数为0.784(P<0.01),与12α羟基化胆汁酸/12α未羟基化胆汁酸比值的相关系数为0.624(P<0.05),提示Mox引起的GK大鼠血糖升高与血清中上述2项指标呈现较强的正相关。
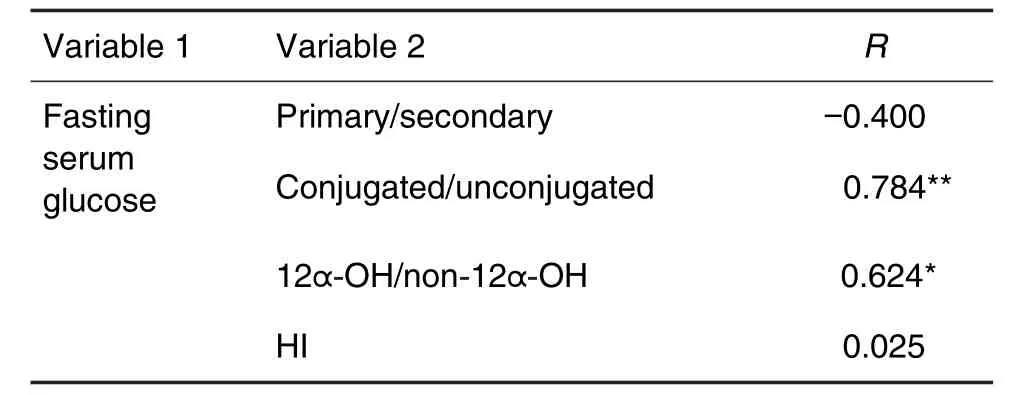
Tab.5 Correlation analysis between serum glucose and bile acids
3 讨论
糖尿病患者表现为不同程度的糖代谢和脂类代谢紊乱,血清总胆汁酸显著增加,胆汁酸代谢失衡[12],然而目前的研究未能揭示糖尿病状态下的胆汁酸代谢谱的改变。本研究使用高效液相色谱-串联质谱联法,测定大鼠血中5种游离型胆汁酸——CA,CDCA,UDCA,DCA和LCA及其相应的牛磺酸结合型和甘氨酸结合型共15种胆汁酸的浓度。结果发现,自发性糖尿病GK大鼠血中游离型胆汁酸中除DCA有显著增加外,其余游离型胆汁酸均显著减少,牛磺酸结合型胆汁酸显著增加,甘氨酸结合型胆汁酸无显著改变,提示游离型胆汁酸和牛磺酸结合型胆汁酸的改变可能与GK糖尿病血糖升高相关。Mox干预GK大鼠7 d后,GK大鼠血清中CDCA及DCA水平进一步降低,CA,UDCA,TCA,TDCA,GCA,GCDCA及GDCA进一步增加,而Mox对其他胆汁酸亚型的影响则是逆转了GK大鼠中血清胆汁酸的改变,使之与正常大鼠更为接近。
由于体内循环胆汁酸池包含着大量的胆汁酸亚型,每种胆汁酸分子与体内各胆汁酸受体的亲和力也都存在差异,因此很难阐明单一胆汁酸亚型浓度的变化对机体代谢的影响。我们进一步对血清胆汁酸谱分类分析,比较初级胆汁酸与次级胆汁酸比值,结合型胆汁酸与游离型胆汁酸比值以及12α羟基化胆汁酸与12α未羟基化胆汁酸的比值在各组大鼠间的差异。此外,由于各胆汁酸亚型电离状态,羟基数目、位置等存在差异,因此不同胆汁酸疏水性具有很大不同,胆汁酸谱的疏水性指数能定量反映循环胆汁酸亲疏水平衡[13]。由于胆汁酸的亲水性能影响其在体内某些疏水域(如细胞膜、胶束或某些受体位置)的溶解性能或结合能力,因此胆汁酸谱的疏水性指数的变化可用来评估体内胆汁酸谱改变对机体的影响[14]。尽管目前胆汁酸谱的疏水性指数与机体代谢的关系还未被完全阐明,但有文献报道2型糖尿病患者胆汁酸池的疏水性指数较正常人显著性升高[14],这与我们的研究结果一致,模型组GK大鼠的胆汁酸池疏水性指数显著高于正常对照组。此外,我们还发现,糖尿病GK大鼠血中初级胆汁酸/次级胆汁酸显著降低,结合型胆汁酸/游离型胆汁酸显著升高,而12α羟基化胆汁酸/12α未羟基化胆汁酸的比值并无显著改变。Mox干预后能显著增加糖尿病GK大鼠血中上述3项比值,而对胆汁酸池的疏水性指数影响不明显。
本研究结果表明,Mox能导致糖尿病GK大鼠空腹血糖进一步升高。对各组大鼠血糖及胆汁酸代谢谱参数进行相关性分析,我们发现结合型胆汁酸和游离型胆汁酸比值与各组大鼠血糖波动呈现显著的正相关关系,12α羟基化胆汁酸和12α未羟基化胆汁酸比值也与血糖波动呈现一定的正相关关系,提示Mox引起血糖升高可能是由于改变了胆汁酸代谢谱中上述2项比值。
本研究揭示了糖尿病状态下血清胆汁酸谱的改变,以及Mox用药后对糖尿病状态下血清胆汁酸谱的影响,并从胆汁酸代谢谱的角度初步评价其与Mox引起血糖升高的相关性,提示该类药物的使用需关注患者胆汁酸代谢谱,为减少该类药物引起的血糖紊乱不良反应提供新的理论依据,而对于Mox引起的胆汁酸代谢谱改变在其所致高血糖不良反应中的机制,我们将开展进一步的研究。
