青果多糖组分抑制人体肿瘤细胞增殖作用研究
2019-04-08刘梅,湛琦
刘 梅,湛 琦
(重庆市中医院药剂科,重庆 400011)
恶性肿瘤是当前危害人 类健康的重大疾病。目前临床上预 防和治疗恶性肿瘤主 要以化学治疗为主,但大部分化学治疗药物在杀死肿瘤细胞的同时,也严重损害正常细胞的功能。由于化学治疗有较大的毒副作用,因此寻找新型高效低毒抗肿瘤药物被全世界科研工作者广泛关注。
多糖为一类由多羟基醛或多羟基酮通过糖苷键连接而成的天然高分子聚合物,广泛存在于动物、植 物、真菌以及微生物中,具有多种多样的天然活性,如调节免疫[1]、降血糖[2]、抗肿瘤[3]等作用。
青果(Canarii Fructus)为橄榄科植物橄榄(Canarium album Raeusch.)的干燥成熟果实,其性味甘、酸、平,具有清热解毒,利咽,生津的功效。 药理研究表明,青果具有抗炎[4]、镇痛[5]、抗氧化[6]以及抑制肿瘤细胞增殖[7]的作用。本研究 通过提取分离青果中的多糖类成分,发现其通过DEAE-琼脂糖凝胶FF后的水部位蛋白多糖组分CFW具有体外抑制肿瘤细胞增殖的作用,报道如下。
1 实验材料
本实验所用青果购 自四川新荷花中药饮片 有限公司,人体乳腺癌细胞MCF-7、人体肝癌细胞HepG2和人体胃癌细胞MGC-803购自美国模式菌种收集中心(ATCC);DPBS缓冲液、DMEM高糖培养基、胎牛血清、1%青-链霉素和0.25%胰蛋白酶购自 美国Gibco公司,BCA蛋白定量试剂盒购自美国Thermo公 司,MT T试剂盒购自中国碧云天生物技术研究所,DEAE-琼脂糖凝胶FF购自中国北京瑞达恒辉科技发展有限公司,3500Da透析袋购自中国上海源叶生物科技有限公司,无水乙醇、氯化钠均购自中国国药集团化学试剂有限公司。
全自动酶标仪(美国BioTek仪器有限公司),电子分析天平(日本岛津),电热恒温水浴箱(上海精宏设备有限公司),电热鼓风干燥箱(成都苏净科学器材有限公司)。
2 研究方法
2.1 青果粗多糖的制备
提取流程。 取青果饮片,粉碎,加8倍量无水乙醇加热回流提取4h,过滤;药渣置于电热鼓风干燥箱,40℃烘干,加8倍量水煎煮3次,合并水煎液,过滤;除去残渣,减压浓缩至浓稠液,加入4倍量无水乙醇使醇含量达到80%,静置过夜,去上清液收集沉淀,挥干,依次用无水乙醇,丙酮,乙醚洗涤,挥干,加水溶解后,冷冻干燥,即得青果粗多糖。
DEAE-琼脂糖凝胶FF预处理。采用0.2mol/L的氢氧化钠溶液清洗至无色,用蒸馏水洗至中性,再用0.1mol/L的盐酸溶液清洗至无色,用蒸馏水洗至中性,蒸馏水配置成匀浆,减压脱气1h,直 至浆液没有任何气泡,装柱(35mm×30cm),蒸馏水平衡过夜。
青果粗多糖的部位分离。称取青果粗多糖5g溶于20mL的蒸馏水,4000×g离心5min;取上清液,玻璃棒引导沿着色谱柱壁缓缓加样,用蒸馏水溶液洗脱。使用苯酚-硫酸法检测洗脱液含糖部分,然后收集。3500Da透析袋用自来水流水透析24h,减压浓缩,冷冻干燥,得到青果粗多糖洗 脱各组分CFW。
总多糖含量测定。精密称取D-葡萄 糖20mg于250mL的容量瓶中,加去离子水至刻度,分别吸取0.4mL,0.6 mL,0.8 mL,1.0 mL,1.2 mL,1.4 mL,1.6 mL及1.8 mL,以水补至2mL,然后 加入6%苯酚1.0mL 及浓硫酸5.0mL,摇匀,静置20min,于490nm处测吸光度,以去离子水为空白,得标准曲 线。吸取待测溶液适量,按照上述步骤进行操作,以标准曲线计算其总多糖含量。
总蛋白含量测定。使用 Pierce BCA 蛋白定量分析试剂盒测定,按照试剂盒说明配制工作液,并配制1mg/mL的待测溶液。根据微孔板方案(样品与工作液的比例为1:8),取3组样品,按照标准曲线同法操作,得3组数据的平均值,根据标准曲线计算总蛋白含量。
3 细胞实验
细胞培养。细胞在含有10%胎牛血清和1%青-链霉素的高糖DMEM培养液中,置于37℃、5%CO2的细胞培养箱内培养。用0.25%胰蛋白酶消化传代,取对数期细胞用于MTT检测。
CFW不同溶液配置。精密称取CFW约2mg,置于灭菌EP管中,加入含有10%胎牛血清和1%青-链霉素的高糖DMEM培养液。浓度为1000μg/mL,振摇混匀,4000×g离心5min,取上清液0.22μm无菌滤头过滤除菌,然后对其稀释,依次得到浓度为62.5μg/mL,125μg/mL ,250μ g/mL, 500μg/ mL的CFW溶液。
细胞增殖 抑制实验。采用MTT法检测CFW对3种肿瘤细胞的增殖抑制作用,选取对数期的细胞,用0.25%胰蛋白酶进行消化, 重悬,调整细胞浓度约为5×104细胞/mL,以每孔100μL接种于96孔板中,置于37℃、5%CO2的细胞培养箱内培养24 h,待细胞贴壁后,弃去上清液,加入200μL不同浓度的CF W、CF1、CF2、CF3溶液,每 组3个复孔,同时设置加等 量的细胞培养液(多糖浓度为0)为对照组,置于37℃、5%CO2的细胞培养箱内培养48h后,每孔加入20μL M TT溶液(25mg MTT溶于5mL MTT溶液中),细胞培养箱中静置培养4h,完全弃去培养液,每孔加入150μL Formazan溶解液,摇床上振摇15min,酶标仪37℃测定每孔的吸光度值,检测波长为570nm。抑制率计算公式如下。
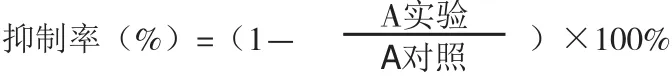
用SPSS 22软件进行数据分析,数值用平均值±标准差(±s )表示,多组间比较用单因素方差分析(One way ANOVA)进行方差分析,Duncan post-hoc比较各组与对照组之间的差异,P<0.05为差异有统计学意义。
4 实验结果
4.1 青果水部位 多糖组分CFW
依次通过乙醇除脂、水提、醇沉得到青果粗多糖,得率为7.11%,性状为淡黄色粉末,接着通过DEAE-琼脂糖凝胶FF对青果粗多糖进行部位分离,得到水部位CFW组分,CFW的得率为36.8%,CFW为白色粉末状物质。通过苯酚-硫酸法测定CFW中的总多糖,通过BCA法测定CFW中的总蛋白含量,结果显示CFW中总糖含量为(80.43±1.99)%,总蛋白含量为(14.59±0.19)%,说明CFW为糖蛋白成分。
4.2 CFW对人体乳腺癌MCF-7细胞增殖的抑制作用
不同浓度的CFW作用于MCF-7细胞48h后,对MCF-7细胞增殖的抑制见比较率如表1。CFW中62.5、125、250、500和1000μg/mL浓度组别的吸光度与对照组相比,均有极显著性差异,说明有显著抑制MCF-7细胞增殖的作用,62.5μg/mL、125μg/mL、250μg/mL、50μg/mL 0和1000μg/mL浓度组别的抑制率分别为(7.9±3.6)%、(15.0±4.2)%、(23.5±3.3)%、(34.6±4.0)%和(44.1±1.6)%,说明随着CFW浓度的增加,抑制作用逐渐增强,CFW抑制MCF-7细胞增殖的作用与剂量呈依赖关系。
表 1 不同浓度的CFW对人体乳腺癌MCF-7细胞增殖抑制比较(±s ,n=3)
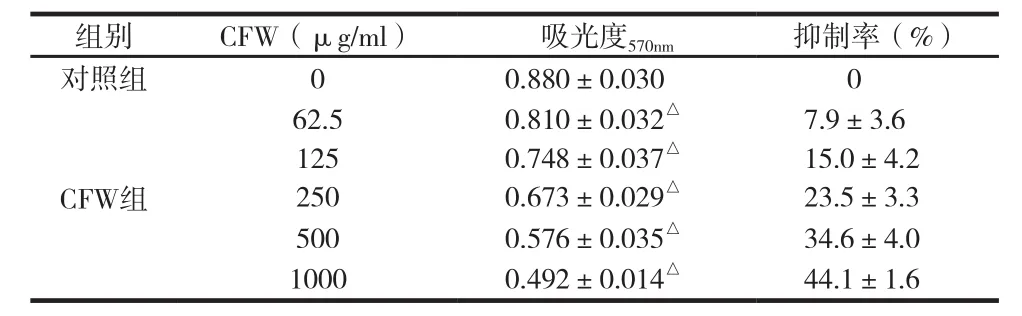
表 1 不同浓度的CFW对人体乳腺癌MCF-7细胞增殖抑制比较(±s ,n=3)
注:与对照组比较,△P<0.05。
组别 CFW(μg/ml) 吸光度570nm 抑制率(%)对照组 0 0.880±0.030 0 CFW组62.5 0.810±0.032△ 7.9±3.6 125 0.748±0.037△ 15.0±4.2 250 0.673±0.029△ 23.5±3.3 500 0.576±0.035△ 34.6±4.0 1000 0.492±0.014△ 44.1±1.6
4.3 CFW对人体胃癌MGC-803细胞增殖的抑制作用。
不同浓度的CFW作用于MGC-803细胞48h后,对MGC-803细胞增殖的抑制比较见表2。与对照组比较,CFW中500μg/mL和1000μg/mL组的吸光度均有极显著性差异,说明低剂量CFW没有抑制MGC-803细胞增殖的作用,高剂量CFW有抑制MGC-803细胞增殖的作用,500和1000μg/ml浓度组别的 抑制率分别为(27.9±5.8)%和(43.8±3.4)%。
表2 不同浓度的CFW对人体胃癌MGC-803细胞增殖的抑制比较(±s ,n=3)
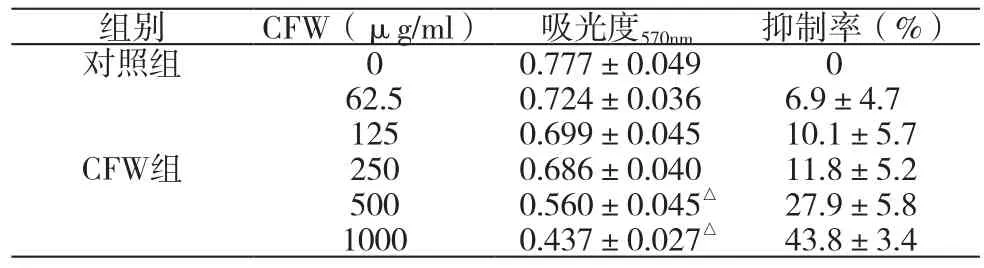
表2 不同浓度的CFW对人体胃癌MGC-803细胞增殖的抑制比较(±s ,n=3)
注:与对照组比较,△P<0.05。
组别 CFW(μg/ml) 吸光度570nm 抑制率(%)对照组 0 0.777±0.049 0 62.5 0.724±0.036 6.9±4.7 125 0.699±0.045 10.1±5.7 250 0.686±0.040 11.8±5.2 500 0.560±0.045△ 27.9±5.8 1000 0.437±0.027△ 43.8±3.4 CFW组
4.4 CFW对人体肝癌HepG2细胞增殖的作用
不同浓度的CFW作用于HepG2细胞48h后,对HepG2细胞增殖的抑制见表3。CFW中62.5μg/mL、125μg/mL、250μg/mL、500μg/mL和1000μg/mL组的吸光度与对照组相比,均有极显著性差异,说明有显著性抑制HepG2细胞增殖的作用,62.5μg/mL、125μg/mL、250μg/mL、500μg/mL和1000μg/mL组别的抑制率分别为(18.8±5.2)%、(30.6±4.4)%、(42.6±2.8)%、(52.2±4.8)%和(58.8±2.5)%,说明随着CFW浓度的增加,抑制作用逐渐增强,CFW抑制HepG2细胞增殖的作用与剂量呈依赖关系。
表3 不同浓度的CFW对人体肝癌HepG2细胞增殖抑制比较(±s, n=3)
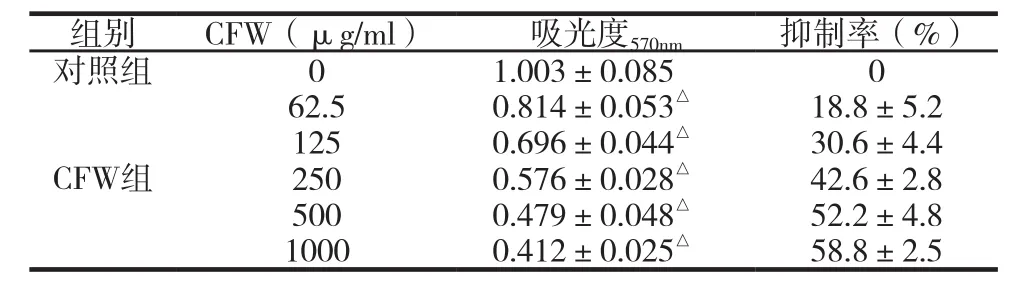
表3 不同浓度的CFW对人体肝癌HepG2细胞增殖抑制比较(±s, n=3)
注:与对照组比较,△P<0.05。
62.5 0.814±0.053△ 18.8±5.2 125 0.696±0.044△ 30.6±4.4 250 0.576±0.028△ 42.6±2.8 500 0.479±0.048△ 52.2±4.8 1000 0.412±0.025△ 58.8±2.5组别 CFW(μg/ml) 吸光度570nm 抑制率(%)对照组 0 1.003±0.085 0 CFW组
5 讨 论
用乙醇除脂、水提、醇沉的方法从青果中提 取得到粗多糖和粗多糖复合物成分,进一步利用DEAE-琼脂糖凝胶FF离子交换色谱对提取得到的粗多糖和粗多糖复合物成分进行部位分离,依次用蒸馏水,0.5mol/L氯化钠、1.0mol/L氯化钠和2.0mol/L氯化钠溶液洗脱,得到CFW、CF1、CF2和CF3四个部位。在前期的实验研究过程中发现,CFW、CF1、CF2和CF3四个部位中,只有CFW具有抑制肿瘤细胞增殖的活性。因此本研究在3种人体肿瘤细胞模型上:人体乳腺癌细胞MCF-7,人体肝癌细胞HepG2细胞和人体胃癌细胞MGC-803。对CFW的体外抗肿瘤活性进行了研究。
MTT学名为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名为噻唑蓝,是一种黄颜色的染料。MTT法是一种检测细胞增殖和存活的方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,在酶标仪570nm波长处测定其吸光度值,可间接反映活细胞数量。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。MTT法是国内外检测药物的细胞毒性和抗肿瘤活性的常用方法。
近年来,多糖就其显著的抗肿瘤活性和较低的毒副作用,逐渐得到国内外科研工作者的关注。研究显示,多糖主要通过直接和间接的方式发挥抗肿瘤活性:通过细胞毒性作用,诱导肿瘤细胞凋亡,抑制肿瘤细胞周期等直接发挥抗肿瘤作用,例如枸杞多糖LBP通过诱导人体前列腺癌PC-3细胞的凋亡,从而抑制其增殖[8];人参多糖通过将非小细胞肺癌A549肿瘤细胞周期阻滞在G0/G1期,发挥抗肿瘤作用[9];通过发挥机体免疫调节作用,通过宿主免疫系统间接发挥抗肿瘤作用,例如桑黄多糖通过活性T细胞和B细胞,抑制肿瘤的生长和转移[10],芦荟多糖PAC-1通过活化巨噬细胞,增强巨噬细胞的摄取和吞噬作用,进而发挥抗肿瘤活性[11]。实验结果显示青果水部位多糖组分CFW在体外对人体乳腺癌细胞MCF-7,人体肝癌细胞HepG2细胞和人体胃癌细胞MGC-803的增殖有明显抑制作用。因此可以通过诱导肿瘤细胞凋亡、细胞周期阻滞的作用机制,继续对CFW抗肿瘤机制进行研究,同时可以 检测CFW在体内的抗肿瘤活性,为从青果中开发具有抗肿瘤活性的药物提供更多的参考。
