城市化背景下珠江三角洲典型湿地土壤多环芳烃(PAHs)的含量、来源与污染风险评价
2019-04-08高照琴白军红温晓君张光亮
韩 玲,高照琴,2,白军红*,温晓君,张光亮,王 伟
(1.水环境模拟国家重点实验室,北京师范大学环境学院,北京 100875;2.生态环境部环境发展中心,北京 100029)
珠江三角洲处于海陆相互作用较强的地带,是脆弱的生态敏感区,同时湿地类型多样且分布广泛,是一个活跃的生态系统,它以其自身的生态优势维系着大量的水生生物和植物的生存发育[1-2]。近年来,珠江流域经济社会快速发展及城市化与工业化加速推进,土地开发利用力度加大,建设用地占地比重增大,同时伴随着沿岸生活污水和工业废水的大量排放,以及燃料消耗量的不断增加,自2004年以来,污染物年排放总量均超过200万t(2008年除外),致使珠江河口湿地呈现开发过量、面积减少、区域环境污染严重、生态环境退化以及生物多样性锐减等问题[3-4],成为人类活动干扰极度频繁剧烈的典型湿地区域。
PAHs是持久性有机污染物之一,具有强烈的“三致”毒性,主要来源于自然界和人类活动中化石燃料的不完全燃烧和石油泄漏等[5]。随着工业化和城市化的迅猛发展,煤、石油等化石燃料在生产生活中被广泛使用,以化石燃料燃烧为主的人类燃烧活动成为环境中PAHs的主要来源[6]。土壤环境是PAHs的储存库和中转站,PAHs能够通过大气沉降和污水灌溉被动植物吸收而广泛分布于土壤环境中[7]。同时由于其水溶性差,辛醇分配系数高,易与土壤有机质结合等特点,常被吸附于土壤颗粒,并可通过地表挥发、径流和生物作用进入整个生态系统,对土壤质量和地下水产生长期或潜在威胁[8]。因此,土壤中PAHs的浓度水平能在一定程度上反映区域污染水平和土壤环境质量,以致近年来国内外对土壤中多环芳烃的分布、来源和风险评价研究越来越多[8-14]。如Swapnil Suman等[15]采用计算PAHs混合物毒性当量的方法对印度巴丹德地区土壤多环芳烃进行了评价。Xu等[16]的研究表明秸秆和薪柴燃烧产生的PAHs是我国PAHs的主要排放源之一,占我国每年排放量的60%。
关于我国河口湿地表层土壤多环芳烃的含量与分布、组成及来源分析[17-19]、迁移转化[20],以及PAHs与土壤中其他有机或无机污染物及环境因子之间的关系[21]报道很多。已有研究表明珠江河口区多环芳烃的含量与社会经济指标呈现显著的同步相关性,主要的污染源为机动车尾气排放、燃煤和燃油发电等[10],但关于城市化背景下河口湿地不同功能区PAHs总体分布情况的对比研究还较少。因此,本文选取珠江河口的三类典型湿地(人工湿地、城市河流湿地和农村河流湿地)土壤作为研究对象,采用毒性当量浓度和生态风险熵值等方法进行PAHs的污染风险评价,并对该区域典型污染物进行筛选,以期为未来研究提供参考。
1 材料与方法
1.1 研究区概况与样地选择
珠江三角洲位于广东省中南部,地理坐标为21°17.6′~23°55.9′N,111°59.7′~115°25.3′E。属亚热带海洋季风气候,雨量充沛,热量充足,雨热同期,降水量在年内相当集中,4—9月的降雨量占全年的82%~85%,年降水量为1600~2300 mm,水资源总量3235亿m3,年日照为2000 h,多年平均气温21.4~22.4℃。土壤类型主要有赤红壤、潴育型水稻土、盐渍型水稻土、滨海盐渍土等。优势植物群落主要有茳芏(Cyperus moldcensislam)和藨草(Scripus triqueter)等。
珠江三角洲是我国重要的河口三角洲之一,凭借优越的地理区位和机遇,工业化和城市化得到了快速发展,导致了围垦、污染等人为活动对环境的影响日益显著。因此本文选取位于广州大学城的人工湿地和番禺污灌区城市河流和农村河流湿地的三类典型湿地进行采样分析研究(图1)。人工湿地是以自然泥土为基质的,水流在湿地表面流动的表面流人工湿地,和天然湿地具有极高的相似度,处理的污水主要来源于大学城区的生活和交通污水[8]。
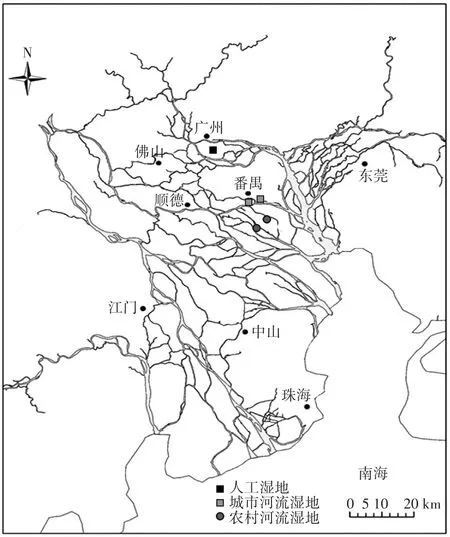
图1 研究区概况图Figure 1 Sketch map of research area
1.2 土壤样品采集
于2015年5月进行土壤样品采集。先将土壤地表的枯枝落叶清除,使用塑料铲子采集表层土壤(0~10 cm)样品,设置两个重复样地,每个样点随机采集3个重复样品,然后将同一样点土壤样品混合装袋后带回实验室进行分析。
1.3 样品分析
采用岛津气相色谱-质谱联用仪(GC-MS)QP-2010(Shimadzu,Japan)对多环芳烃含量和组分特征进行测定分析[8]。
首先,将土样与硅藻土(5.0 g)均匀混合后填满萃取池,用二氯甲烷和丙酮的混合溶液(1∶1)进行萃取。萃取条件为:提取温度140℃,加压10 MPa,加热时间5 min,静态萃取5 min,清洗体积20 mL,氮吹60 s,循环2次。其次,将萃取液放入旋转蒸发仪进行浓缩,转换溶剂为正己烷,浓缩,正己烷活化弗罗里硅土柱,上样1 mL,用正己烷:丙酮混合液(体积比4∶1)进行洗脱,流速2 mL·min-1,备用分析。气相色谱质谱条件为:DB-5MS毛细管色谱柱(0.25 mm×30 m×0.1µm),载气为 He,流速恒定 1.5 mL·min-1,进样口300℃,柱温始温80℃保留4 min,10℃·min-1升至270℃,以5℃·min-1升至300℃,保留35 min,无分流进样1µL。电子能量设定为70 eV;离子源温度设定为210℃;传输线温度为280℃。
本文选取16种优控多环芳烃,包括:萘(Nap)、苊(Acy)、苊烯(Ace)、芴(Fle)、菲(Phe)、蒽(Ant)、荧蒽(Fla)、芘(Pyr)、苯并[a]蒽(Baa)、苗屈(Chr)、苯并[b]荧蒽(Bbf)、苯并[k]荧蒽(Bkf)、苯并[a]芘(Bap)、二苯并[a,h]蒽(Daa)、苯并[g,h,i]苝(Bgp)、茚并[1,2,3-cd]芘(I1P)16种PAHs。
1.4 污染物的评价方法
1.4.1 污染分级标准
选取 Maliszewska-Kordybach(1996)[22]对土壤中16种优控PAHs污染程度建立的分级标准对三类湿地的污染程度进行了分级划分,具体分级标准如表1所示。

表1 土壤中PAHs污染程度分级[22]Table 1 Pollution classification of PAHs in soil
1.4.2 生物毒性评价
主要采用Long等[23]沉积物质量基准法(SQGs)对研究区内各类土壤多环芳烃的潜在生物毒性进行评价。若污染物浓度小于效应范围低值(ERL),表明生物毒性效应鲜有发生;若污染物浓度大于效应范围中值(ERM)时,表示生物毒性效应将频繁发生;如污染物浓度介于二者之间,则生物毒性效应会偶尔发生。相同方法可用于临界效应浓度(TEL)与必然效应浓度(PEL)毒性预测评价。多环芳烃的ERL/ERM和TEL/PEL的相关数值见参考文献[23]。
1.4.3 毒性当量风险评价
Nisbet等[24]提出的毒性当量因子即以Bap作为毒性标准物质,其他PAHs与Bap相比较的值来计算每个 PAHs单体的毒性当量浓度(BEQi,ng·g-1)及PAHs总毒性当量浓度(TEQ,ng·g-1),计算公式分别如下所示:

式中:ci指组分i的质量浓度,ng·g-1;TEFi指组分i的等效当量因子。
1.4.4 风险熵值法风险评价
风险熵值(RQ,Risk quotient)是由 Kalf等[25]于1997年提出的评价PAHs的生态风险商值,其定义如公式(3):

式中:CPAHs为介质中PAHs的浓度;CQV为该介质相应的PAHs的风险标准值。由RQ的基本定义公式可以进一步得到公式(4)和公式(5):
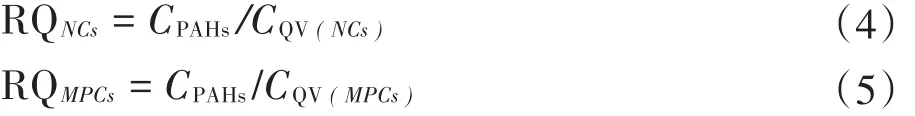
式中:NCs为最低风险浓度;MPCs为最高风险浓度;CQV(NCs)为最低风险标准值;CQV(MPCs)为最高风险标准值。
1.5 质量控制和质量保证
为了质量控制和保证,在测定过程中,每个多环芳烃的基体峰(100 ng·g-1)、实验室控制(方法空白)和重复样品(15%)一起进行。空白方法检测目标多环芳烃污染的数量。基于矩阵脉冲实验,16个多环芳烃的回收率在80%~110%之间。16个多环芳烃的相对标准差均在10%以下。所有16个美国环保局规定的多环芳烃的浓度值都是基于烘干土壤进行计算。
1.6 数据处理
使用Excel 2010、SPSS 20.0和Origin 8.5对论文中的数据进行统计和分析。
2 结果与讨论
2.1 三类湿地土壤PAHs总量分布及同分异构体组成特征
由图2可知,在16种PAHs中,单体菲和苯并[a]芘平均含量最高,萘含量次之;致癌性最强的苯并[a]芘的浓度范围为73.8~139.4 ng·g-1,均值为109.8 ng·g-1,呈RRW>URW>CW的变化趋势,RRW湿地土壤苯并[a]芘的浓度分别是URW和CW的1.08和1.39倍。菲的浓度范围为112.4~175.2 ng·g-1,具有最高的单体均值140.92 ng·g-1,且呈现CW>URW>RRW的分布趋势。此外,CW土壤中单体萘(Nap)的含量最高,分别是URW和RRW湿地的3.61倍和1.92倍。可能与该样地中强烈的人类活动干扰以及农户家庭供暖(主要以木材、煤和泥炭为基础在研究区的广泛使用)所导致的PAHs排放有关[26-28]。同时,农村周边的工业活动中煤炭、焦炭的燃烧可能也是重要的影响因素,因为化石燃料的不完全燃烧及焦油、煤气等产品的加工过程都可能导致PAHs类物质的排放。有研究表明,工业工厂是多环芳烃的重要污染源,所排放出的污染物能够影响2~3 km或更大范围的地区[29]。
如图3所示,三类湿地土壤PAHs的不同环的组分差异较大,在RRW和URW样地中,土壤PAHs组成均以3-5环为主,这三种PAHs分别达到总量的81.42%和89.35%。在CW样地中,2-5环的总量占ΣPAHs的96.77%。这是因为一些高环PAHs的水溶性较低,主要以与土壤有机质胶体结合的形式发生迁移,不易迁移到土壤深层[30]。农村河流湿地土壤PAHs含量呈5环>3环>4环>2环>6环的趋势,城市河流湿地土壤PAHs含量呈3环>5环>4环>2环>6环的趋势,表明3、5、4环多环芳烃的总含量占农村河流和城市河流湿地总含量的绝大部分,这与肖蓉[8]在珠江河口湿地的研究结果一致,可能是由于中高分子量多环芳烃难降解且移动性弱造成的。城市农村中垃圾的焚烧导致3环PAHs的含量分别达到33.8%和27.76%,这与肖蓉[8]研究发现的珠江河口围垦湿地溶解相和颗粒相中PAHs以3环的PAHs为主(占总组分的80%)的部分结果一致,说明湿地土壤中的PAHs主要来自于水体溶解相的输入和沉积。与城市和农村河流湿地相似,人工湿地土壤中3、4、5环多环芳烃含量也较高,所占比例均超过总量的23%。人工湿地土壤中Phe和Nap的含量最高,可能与研究区域内薪柴使用和秸秆燃烧[31]以及PAHs干湿沉降浓度有关[31]。
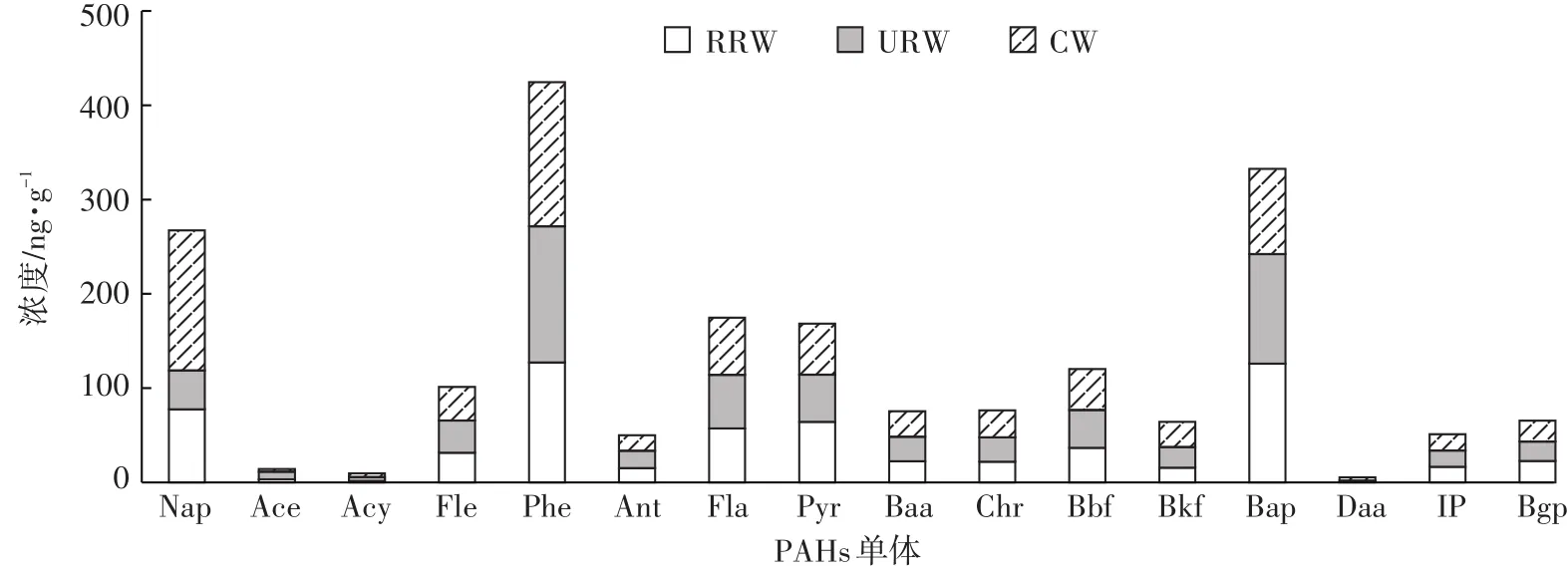
图2 三类湿地土壤PAHs同分异构体组成特征Figure 2 Composition characteristics of PAHs isomers in three types of wetland soils
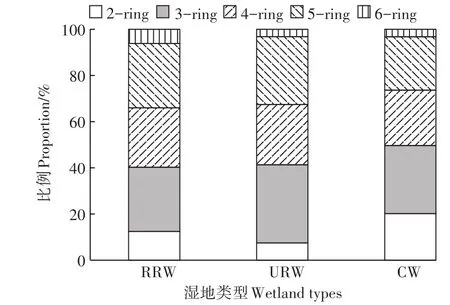
图3 三类湿地土壤中不同环的Σ16PAH的组成特征Figure 3 The composition characteristics of different rings of Σ16PAH in three types of wetland soils
由图4可知,湿地土壤PAHs含量组分差异与湿地类型密切相关。16PAHs在所有样品中均有检出,ΣPAHs含量在三类样地的范围值为625~736.4 ng·g-1,平均值为666.9 ng·g-1。三类湿地土壤∑PAHs含量高低呈CW>RRW>URW趋势,表明该区土壤中PAHs的残留与湿地类型有关。其中,ΣPAHs含量最高值出现在人工湿地,分别是农村河流和城市河流湿地的1.15倍和1.18倍,这可能与人工湿地接纳生活污水的排放有关,同时这些区域通常都受到工业活动的影响,例如煤炭处理、碳化作用、煤气净化和工厂副产物处理等[26]。城市河流和农村河流湿地中较低的PAHs富集可能与城市和农村区域疏浚河道的翻土工程有关,底层上翻土壤的多环芳烃含量低,污染程度较低[8]。
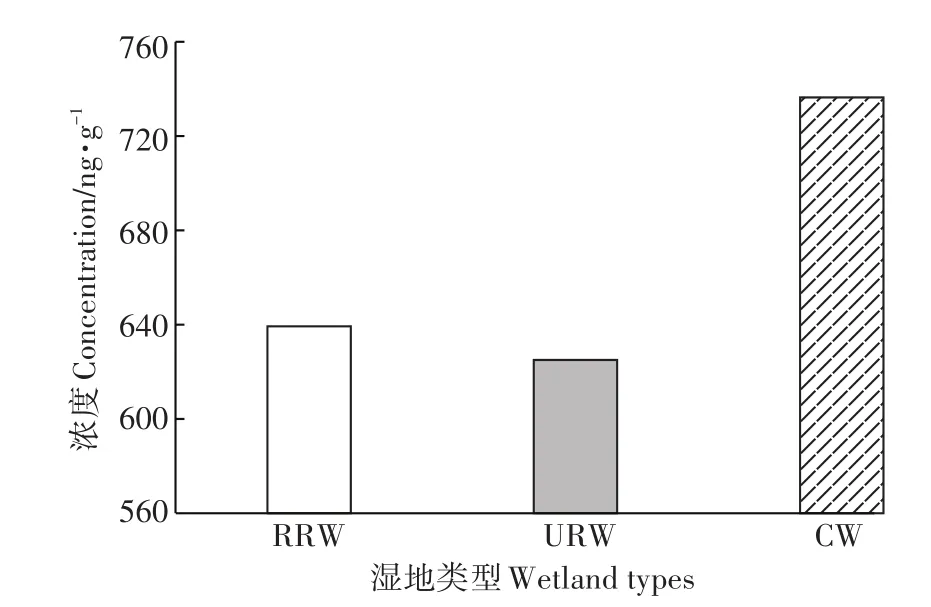
图4 三类湿地土壤Σ16PAH总量分布特征Figure 4 The total contents of the PAHs in the three wetlands
2.2 土壤中PAHs的来源解析
本研究利用6个多环芳烃同分异构体比率参数来分析三类典型湿地土壤多环芳烃来源(表2),发现PAHs除自然成因外,主要以人类活动以及能源利用过程中煤、石油的不完全燃烧产生的PAHs为主要来源。如表2所示,Phe/Ant在7.39~9.47,均小于10,表明为燃烧来源[8],且有研究表明,Ant和Phe通常存在于燃烧源中,Phe是煤燃烧产生PAHs的主导组分,图1中也显示三类湿地中较高的单体菲,均说明了三类样地是属于PAHs燃烧源污染。Fla/Pyr在RRW样地的范围为0.77~1.22,表明RRW土壤PAHs来源于煤和石油燃烧及石油排放的混合源[8],这与Fla主要来源于石油产品(原油、燃油和使用过的机油等)的泄漏和化石燃料的燃烧会产生少量的Pyr的结果一致[32]。而URW和CW(Fla/Pyr>1)来源于煤和石油的燃烧源。Ant/(Ant+Phe)在0.10~0.12,均大于0.1,说明三类湿地均是来源于煤和石油的燃烧源。Fla/(Fla+Pyr)在RRW样地的范围为0.43~0.55,表明RRW是液体的化石燃料和生物质与煤炭混合燃烧源,而URW和CW大于0.5,是生物质与煤炭燃烧的来源。Baa/(Baa+Chr)在0.47~0.54,均大于0.35,说明均是煤炭、草和木头燃烧的来源;I1p/(I1p+Bgp)在0.41~0.47,均显示介于0.2~0.5之间,说明均是液体的化石燃料的燃烧、汽车尾气的排放和原油的燃烧,这与Bgp是机动车排放源的特征组分的结果一致[33]。因此,说明城市河流和人工湿地的PAHs主要来源于煤和生物质等燃烧,而农村河流湿地来源于木材、煤等燃烧和石油排放的混合源。同时各样地单体Phe、Bap的检出含量最高,而Phe和Bap的排放是煤燃烧源的重要特征[34]。总体而言,珠江三角洲三类湿地表层土壤中的PAHs主要来源于以煤为主的化石燃料的燃烧,石油类燃烧和泄漏的贡献较少。此外,城市河流湿地、农村河流湿地和人工湿地土壤∑PLPAH在16种多环芳烃总量中所占比例分别达59%、60%和50.3%,印证了以上的结果。因此,研究区PAHs的含量水平可能与采样点周围PAHs排放源较多、颗粒物性质复杂有关,同时新污染源(工厂、交通源)的叠加效应也可能是一个重要影响因素。这也可能是城市地表灰尘中的PAHs随降水、地表径流进入河流湿地中,加上农村大量的生活污水和渗滤液从家庭、牲畜、食品厂和塑料/电子/五金制品加工厂排入到河流湿地中[8],以上这些都是土壤环境中PAHs的重要污染源。这与罗孝俊等[35]研究发现珠江三角河流及伶仃洋更多受石化燃料燃烧的影响结果一致。也与Li等[36]发现的长江河口沉积物中PAHs主要来自石油、木材和煤的燃烧一致,表明国内重大河口经济区工业的发展伴随着对化石燃料的消耗,在一定程度上导致了河口环境中多环芳烃的污染。
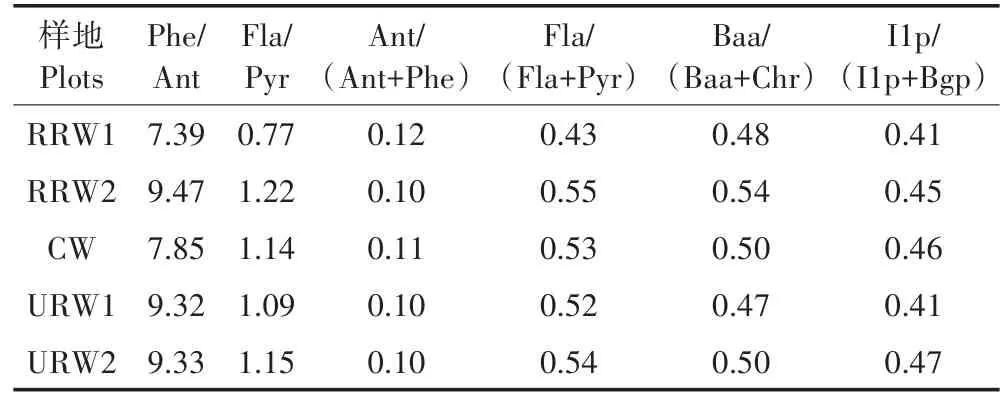
表2 土壤中PAHs多特征比值判源Table 2 Source identification with compositional analysis of PAHs in soil samples
2.3 土壤中PAHs污染水平与毒性风险评价
根据Maliszewska-Kordybach[22]对PAHs污染的土壤建立的污染程度分级标准(表1),CW(736.4 ng·g-1),RRW(639.3 ng·g-1)和 URW(625 ng·g-1)均达到了中度污染级别(Σ16PAHs为600~1000 ng·g-1)。Trapido[17]对未受人类活动干扰的土壤PAHs本底值的界定为小于100 ng·g-1。该研究区表层土壤中PAHs总量明显高于上述限值,表明在城市化背景下,珠江三角洲三类湿地土壤已经受到了一定程度PAHs污染,应当引起重视。与国内不同时期在同类研究区的结果[37-40]相比,本研究区PAHs的平均值处于较高浓度范围,总的来说,珠江三角洲典型湿地土壤中PAHs含量与国内外其他地方相比处于中高度污染水平,可能是因为快速的城市化进程促使土壤环境的载荷加大的结果。
根据Long等沉积物质量基准法(SQGs)[23]对研究区内各类湿地土壤多环芳烃的潜在生物毒性进行了评价,结果显示三类湿地土壤中Fle的含量显著高于ERL值(Fle=19 ng·g-1),表明研究区土壤具有一定的生物毒性;同时单体Nap、Fle、Phe、Ant和Bap在三类湿地中均超过其TEL标准值,表明存在潜在的生物毒性。同时,三类湿地的PLPAHs的浓度均达到或超过ERL和TEL标准,表明研究区的土壤PAHs属于中度污染水平,且主要源于毒性较高的中、高环组分,与已有研究结果一致[33]。
表3列出了三类湿地土壤中PAHs单体毒性当量浓度、ΣPAHs毒性当量浓度(TEQs)及其与总PAHs的TEQs比率。三类湿地土壤PAHs的毒性风险水平的大小趋势呈现为RRW(153.07 ng·g-1)>URW(145.04ng·g-1)>CW(121.08 ng·g-1),呈现较高的TEQs值。这主要是由于三类湿地土壤包含更高浓度的强致畸致癌物质(Bap和Daa),并且具有最高的TEFs指数,占16PAHs TEQ值的90%以上,表现出较强的生物毒性。RRW和URW具有相近的TEQs和相对TEQs值(TEQs/∑PAHs),这可能与两类湿地受货运船油泄露或化学产物释放的影响有关。据2004年统计,番禺区工业废水排放总量为3 164.52万t,工业废气排放量524.3亿m3,是整个珠三角地区生态负荷红色预警区域。目前,全区仍有5000多家乡镇企业,主要以排污严重的印染、电镀、化工等工厂为主,由于该区河道狭窄,河流水系自净能力难以与日复一日的排污抗衡,致使该区河流水系、土壤环境污染问题异常严重[8]。
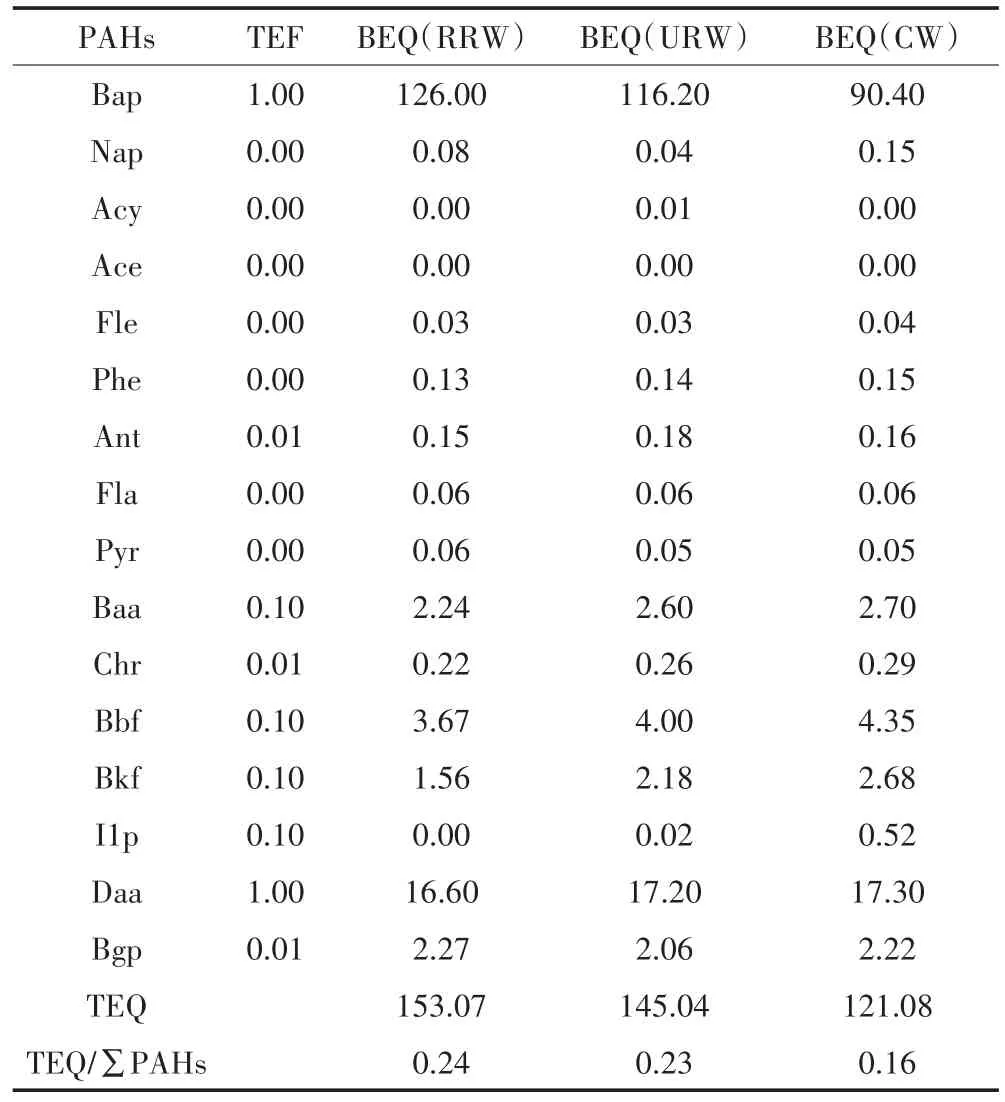
表3 三类湿地土壤中PAHs毒性当量浓度(TEQ)Table 3 Concentration of PAHs toxic equivalent(TEQ)in wetland soils
CW土壤具有相对低水平的TEQs可能与附近的环城高速公路带来的交通尾气、城市建设带来的大量工业和生活污染物颗粒沉降有关[3-4,41]。同时人工湿地具有较强的自净能力,TEQ/∑PAHs值较低。根据加拿大《基于风险的土壤保护人类健康标准》(CC⁃ME,2010)[42],该地区所有样地的TEQs均低于600 ng·g-1的安全水平。
PAHs单体和∑16PAHs生态风险等级如表4所示,在三类湿地中,除了Chr、Bkf、Daa、IP和Bgp单体的RQNC<1(除CW的Daa和Bkf,如表4中的黑体显示),显示为中等风险1,其余PAHs单体的RQNC值均大于1,RQMPCs值均小于1,显示为中等风险2。然而Nap单体在CW湿地土壤中的RQMPCs值为1.06,大于1,显示出高风险水平。同时,根据三类湿地土壤∑PAHs的 RQNC值均小于 800,但 RQMPCs均大于 1,显示出中等风险水平。因此,尽管三类湿地土壤总的PAHs无明显的生态风险,但有少量PAHs单体存在中等风险,个别单体显示了高度风险水平,应给予高度重视,进行土壤修复治理。

表4 三类湿地土壤中单体PAHs的NCs和MPCs值(ng·g-1)Table 4 NCs and MPCs of individual PAHs in sediment and soil(ng·g-1)of three type of wetlands
3 结论
(1)在城市化发展的背景下,珠江三角洲典型湿地类型土壤∑PAHs含量大小以人工湿地含量最高,农村河流湿地次之,城市河流湿地最低;单个化合物的含量以萘、菲和苯并[a]芘3种化合物为主;土壤中以3环、4环和5环的PAHs含量最高,2环和6环的PAHs则较少,表明珠江三角洲不同土地利用对湿地土壤PAHs污染的影响存在差异。
(2)珠江三角洲农村河流湿地土壤中的PAHs污染源来源于化石燃料不完全燃烧(热解),和石油排放的混合源。而城市河流湿地和人工湿地土壤的PAHs主要来源于煤和生物质燃烧。有关各种多环芳烃来源的具体贡献率,还有待进一步探讨。
(3)PAHs在城市建设区(人工湿地)土壤中的PAHs含量明显高于湿地工业污染区(农村河流和城市河流),且三类湿地土壤均属于中度污染。由两类风险评价方法的计算结果均显示珠江三角洲三种类型湿地土壤PAHs均处于中等风险水平,但有些PAHs单体(如:菲、苯并[a]芘)具有较高的毒性当量浓度,存在高生态风险,需要采取相关措施进行治理和修复。
