冠心病患者消化道出血后远期心血管不良事件危险因素分析及评分系统的评价
2019-04-08卢放根
石 林,黎 昀,卢放根,张 洁
(中南大学湘雅二医院消化内科,湖南长沙410011)
冠心病已位于全球单病种死因的第一位[1]。全球近60%的冠心病负担发生在发展中国家,而且在发展中国家,其患病率和死亡率还在不断上升[2-3]。在中国,冠心病已成为威胁国人生命的首要病因[4]。虽然抗血小板药物的应用降低了死亡率,但也带来了常见的副作用,比如消化道出血。冠心病合并消化道出血进一步增加了患者死亡风险,包括出血后心血管不良事件的发生。欧洲一项纳入6 212人的研究指出,冠脉介入术后随访1年消化道出血率超过30%[5]。此外,消化道出血也是冠心病患者发生心肌梗死,甚至死亡的独立危险因素。临床上常用AIMS65,Glasgow-Blatchford(GBS)、Rockall评分系统评估出血病人的病情。三者各有特点,GBS评分在预测急诊介入治疗、输血、死亡、再出血有优势[6-8]。AIMS65评分在预测死亡、急诊治疗及筛选高危病人与GBS相差不大[9]。现有的评分系统专注于研究患者就诊时或住院期间的输血率、死亡率、再出血率等短期情况。且这些评分系统并非针对冠心病患者。此外,目前尚未有这些评分系统(GBS、AIMS65、Rockall等)可以预测冠心病患者出血1~2年后发生不良心血管发生事件的报道。因此,本研究的目的在于评价GBS评分系统及AIMS65评分系统预测冠心病患者消化道出血后不良心血管事件发生的效能,并分析出血后发生心血管事件的危险因素。
1 材料与方法
1.1 患病人群
选取2014年1月至2016年7月因消化道出血于中南大学湘雅二医院就诊的冠心病患者,并对临床资料进行回顾性的收集及分析。主要临床表现为呕血、黑便、便血、贫血。本研究已经过我院伦理委员会批复同意。
1.2 纳入与排除标准
纳入标准:①年龄大于18岁,有详实的临床资料。②已确诊的冠心病合并消化道出血的病人。排除标准:①合并有严重肝病、肝硬化或已确诊或临床高度怀疑食管胃底静脉曲张的患者。②住院期间确诊肿瘤或随访中发现肿瘤的患者。③全身系统疾病导致的出血。④住院期间死亡的患者或随访时因非心源性因素死亡的患者。
1.3 方法
1.3.1 收集资料 对患者入院后的临床表现,如首次实验室检查如血常规、肝肾功能电解质、高血压等既往病史、出血GBS评分及AIMS65评分、输血、院内再出血情况、再次使用抗凝或抗血小板药物时机等进行收集归纳。随访结束至2017年7月。
1.3.2 AIMS65评分系统 AIMS65评分系统:血浆白蛋白<3 g/dL、国际标准化比值(INR)>1.5、收缩压<90 mmHg、神志改变以及年龄>65岁者各积1分,分值越高说明患者消化道出血越重。
1.3.3 GBS评分系统 根据患者的性别、SBP、血红蛋白、脉搏、血尿素氮、黑便、晕厥、肝脏疾病、心力衰竭等对患者危险程度进行评分(表1)。

表1 Glasgow-Blatchford评分详细项目Table 1 The detailed information of Glasgow-Blatchford system
1.3.4 评分分级 首先对219名患者分别进行GBS评分及AIMS65评分,将GBS评分≥9分,列为高危组,<9分为低危组。将AIMS65评分≥2分,列为高危组,<2分,列为低危组。随访至2017年7月截止。之后分别对GBS评分及AIMS65评分进行ROC曲线分析,并计算曲线下面积,比较两种评价系统的预测出院后不良心血管事件的能力。
1.3.5 危险因素分析 随访结束时,将患者分为发生心血管不良事件组(阳性组)与未发生组(阴性组),并将两组患者的性别、年龄、既往病史、2种评分系统得分、血红蛋白、尿素氮、输血治疗、院内再出血、出院后再服用抗血小板及抗凝药时间进行单因素Logistic分析,因受限于样本量,遂将P<0.1或具有临床意义而无统计学意义的变量纳入多因素逐步logistic回归分析,多因素分析中P<0.05认为有统计学差异。
1.3.6 观察指标及定义 主要参考2015年Martínez-Cara 等的研究[8]。①院内再出血定义为:住院期间发生呕血、黑便、便血并有血红蛋白下降,伴或不伴休克。②心血管不良事件定义为出现以下任何一项或多项事件:患者因再发心绞痛、非致死性心梗、心力衰竭和中风而去门诊就诊或住院和因心脏疾病而导致的死亡。③住院期间的心绞痛等心血管不良事件的诊断由患者症状及BNP水平、心电图、心肌酶等结果由心内科医生作出诊断。
1.3.7 统计分析 所有数据统计由Stata14.0软件完成。计量资料正态分布数据由均数±标准差表示,定性资料由率表示。定性变量的比较采用卡方检验。计量资料的比较采用t检验。分别计算GBS评分及AIMS65评分的ROC曲线下面积,当AUC≥0.7时评分系统的准确度良好,AUC越接近于1,该评分系统的参考价值越大。并对发生及未发生不良心血管事件的患者的临床资料进行多元Logistic回归分析寻找心血管不良事件危险因素。P<0.05认为有统计学差异。
2 结果
2.1 一般资料
2.1.1 入选患者一般情况 研究开始时共纳入246位病人,在随访中无法联系的有22人,5人临床资料不完整或并发恶性肿瘤而剔除。失访率约9%。最终纳入研究共219人,其中男性150人,女性69人,平均年龄72岁,年龄跨度为38~93岁。其中上消化道出血197人,下消化道出血22人,合并有高血压患者141人(64%),糖尿病患者66人(30%),有陈旧性心肌梗死24人(10.9%),既往行PCI术30人。其中189位患者使用阿司匹林,其中55人为双抗方案(阿司匹林及氯吡格雷联用),15人使用华法林抗凝治疗,其余病人入院前未采用任何抗血小板或抗凝药物。所有病人中无接受双抗血小板加抗凝患者。219人全部使用了质子原抑制剂(proton pump inhibitor,PPI)药物并且在住院期间均未服用阿司匹林或氯吡格雷等抗栓药物,出院后所有患者陆续服用阿司匹林或氯吡格雷。在219位病人里,20人接受胶囊镜检查,165人接受胃镜检查,14人接受肠镜检查。在接受内镜检查的病人里有140人发现有胃或十二指肠溃疡,22人有胃粘膜损伤,8人发现结肠粘膜溃疡出血,3人结肠血管畸形出血,12人小肠血管畸形出血。消化道出血病因主要为抗血小板(189人)或抗凝药物(15人)所致消化道出血,少部分人为血管畸形引起的出血(15人)。所有病人出院前未解黑便且连续两次大便隐血试验阴性。其余一般情况详见表2。
2.1.2 随访时间及结局 随访时间至2017年7月止,平均随访时间14.7个月,最长随访时间23.3个月,最短7个月。心血管不良事件截至随访时共有70人(31.9%)发生结局事件,其中57人因心绞痛于门诊就诊或住院接受治疗,8人发生心房颤动,2人新发心肌梗死,1人脑梗死。
2.2 结局事件
2.2.1 评分系统分析 GBS评分与AIMS65评分对219名患者进行两种评分系统评分后,根据Stata软件计算两组ROC曲线图(图1)。由图中可见,GBS评分系统曲线下面积为0.51(P=0.039),AIMS65评分系统曲线下面积为0.59(P=0.035),曲线下面积均在0.5~0.6之间(表3)。
2.2.2 Logistic分析 单因素Logistic分析中年龄、糖尿病、既往心梗、血红蛋白浓度、住院期间是否使用PPI、输血具有意义(P<0.05)。而性别、两种评分系统、血尿素氮浓度、输血治疗、院内再出血、出院后再服用抗血小板及抗凝药时间无统计学意义。之后将P<0.1的变量或具有临床意义的指标,即(性别等)纳入多因素逐步Logistic回归分析,最后结果如表4所示血红蛋白浓度、糖尿病病史、既往有无心梗病史有统计学意义。
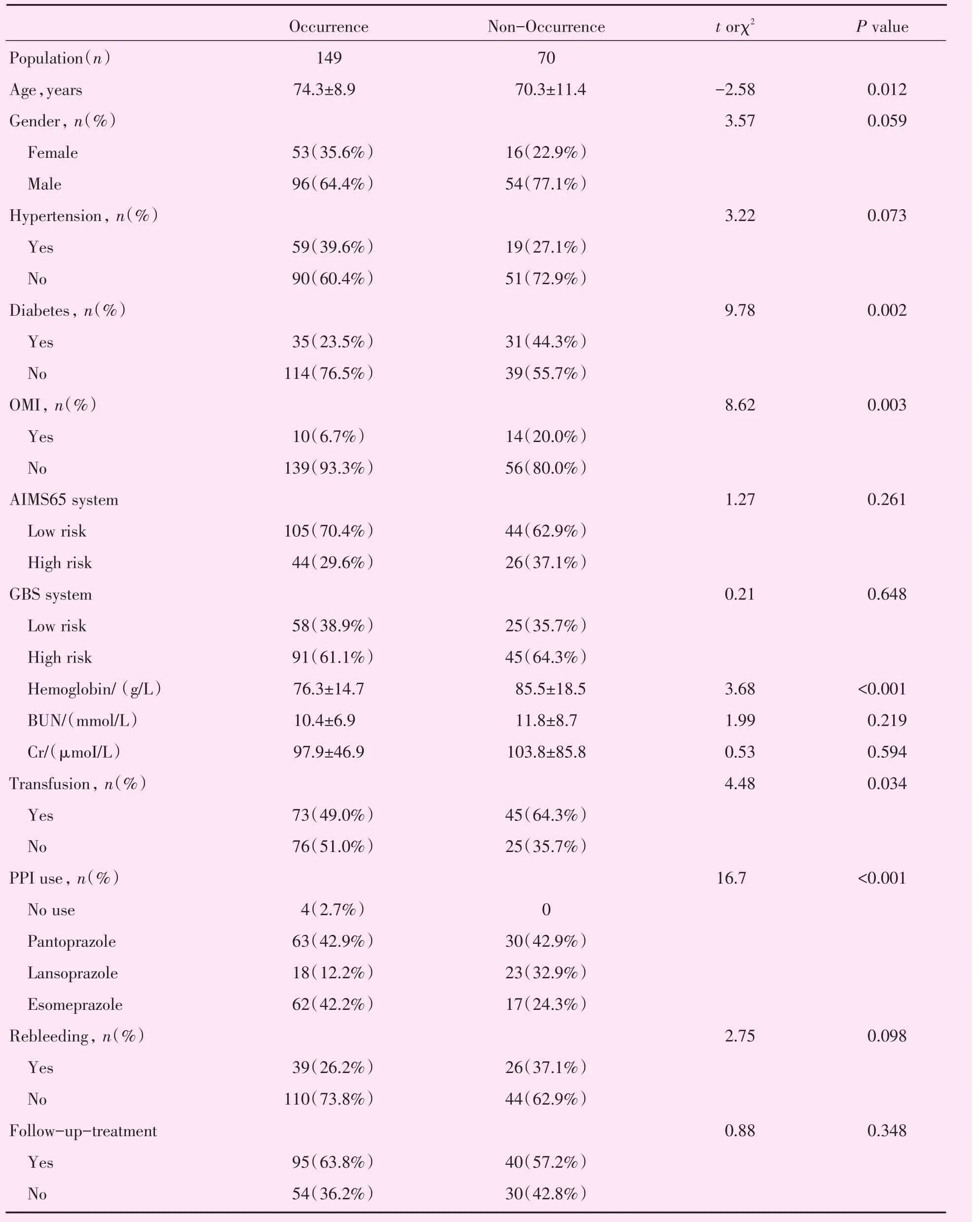
表2 病人一般情况及两组间比较Table 2 The clinical characteristics of patients and comparison of two groups
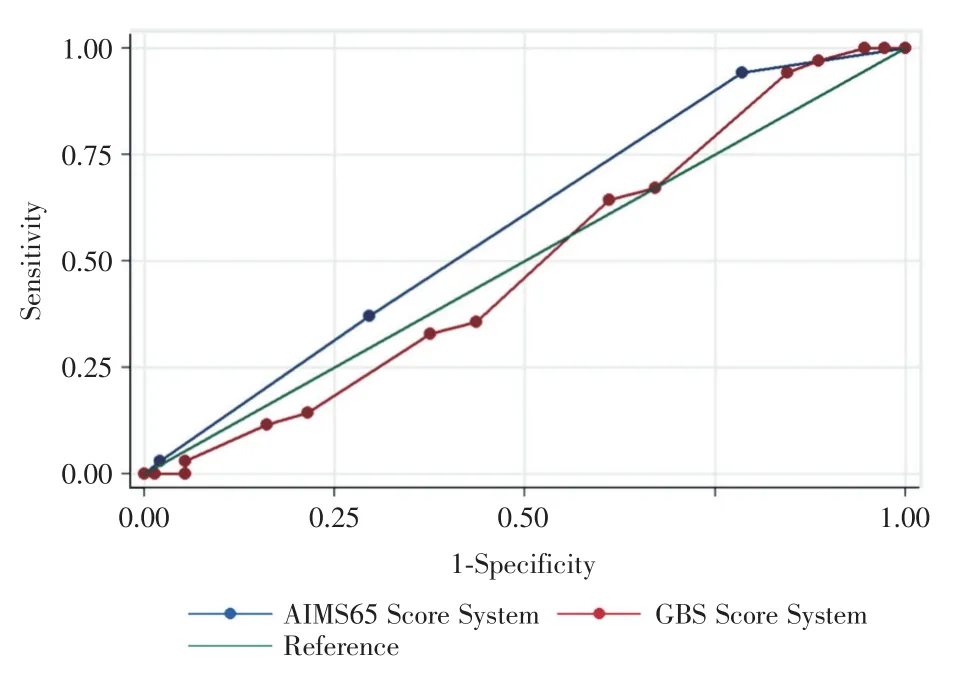
图1 GBS评分系统及AIMS65评分系统关于心血管不良事件的ROC曲线图Fig.1 ROC of the adverse cardiovascular events as predicated by GBS score and AIMS65 score system
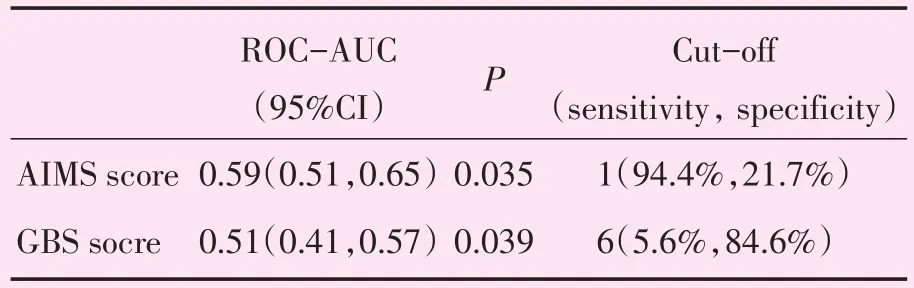
表3 AIMS65评分系统及GBS评分系统的ROC曲线结果Table 3 The main outcomes of ROC of GBS score and AIMS65 score system
2.2.3 血红蛋白截断值分析 经Medcalc软件计算得出入院时血红蛋白浓度小于74 g/L是发生心血管事件的切点值。
3 讨论
消化道出血是冠心病患者常见且严重的并发症,病死率高。但是冠心病患者消化道出血后几乎会全部就诊于消化科而非心内科,对于消化科医生来说,担心的是出血后心血管事件发生的可能性,如何采取应对措施等,而这些问题仍悬而未决。本研究旨在调查冠心病患者消化道出血后心血管不良事件发生情况,并评价临床常用出血评分系统对心血管事件预测能力及心血管不良事件的危险因素。
临床上有 GBS、AIMS65、Rockall出血评分系统。国内外多篇文章均有报道[6-8]。Glasgow-Blatchford评分系统最常用于预测消化道出血患者的治疗需要(输血、内镜治疗及外科治疗)且随着GBS评分的增高,出血患者的再出血率、手术率和死亡率相应增高。AIMS65评分多用于预测住院病人死亡率,住院时间和医疗费用[10-11]。此外Rockall评分及AIMS65评分最开始时是基于上消化道出血的人群设计的,但是目前国外有部分研究同样发现Rockall评分及AIMS65评分可用于下消化道出血病人的预后分析及治疗[12-13]。从图1的ROC曲线中可以看到,GBS评分及AIMS65评分用于预测出血后心血管不良事件的效能较差,ROC均在0.5左右,这可能与两大评分系统主要用于院内死亡预测相关,并且评分中的多个标准在多因素分析中均无意义。但是本研究是单中心研究,结论仍需多中心前瞻性研究证实。因此建立一个新型评分标准仍是亟待解决的问题。
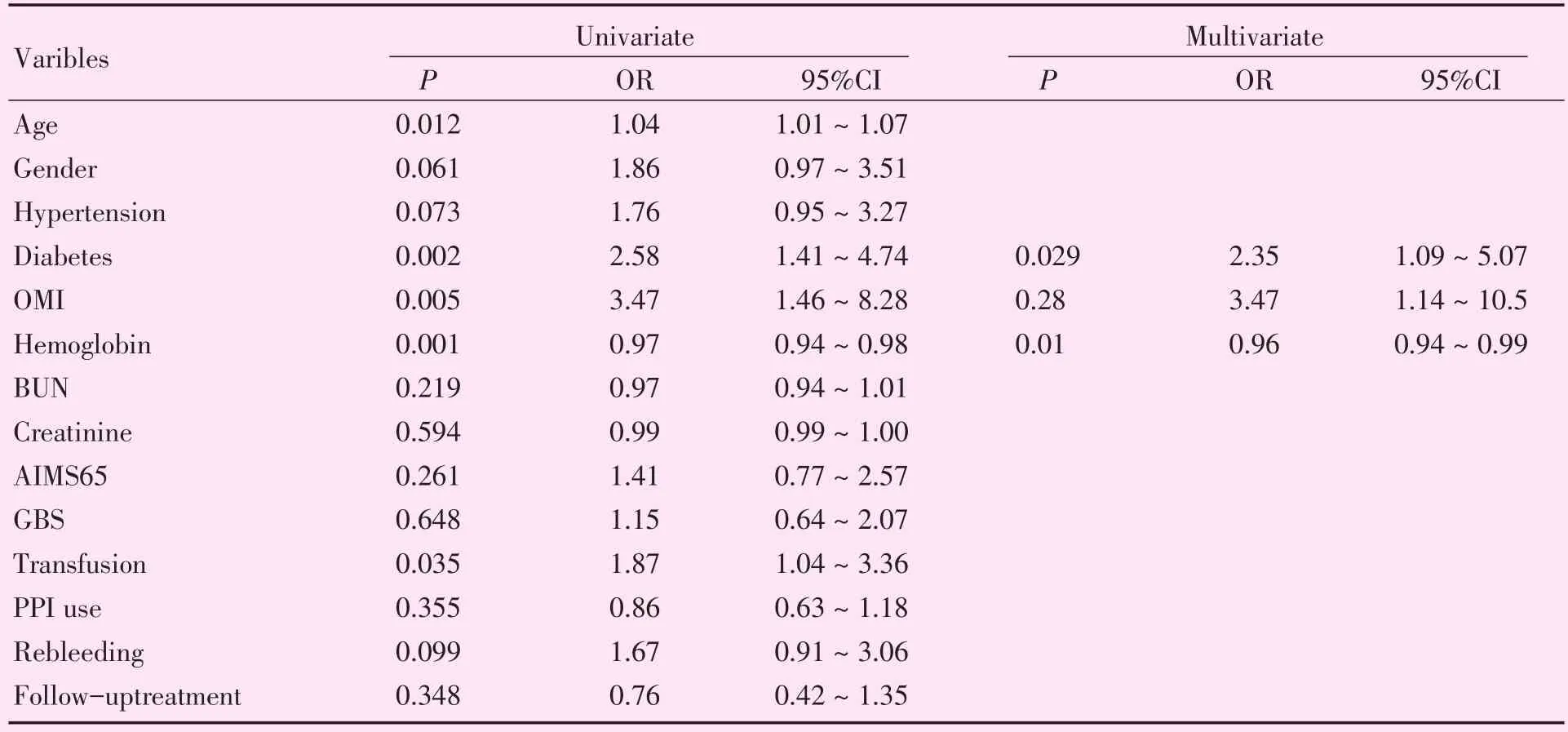
表4 消化道出血后不良心血管事件发生的单因素及多因素分析结果Table 4 Univariate and multivariate logistic regression analysis for adverse cardiovascular outcomes after gastrointestinal bleeding
本文进一步探讨了影响冠心病患者出血后心血管事件发生的危险因素,目前国内外多篇研究发现出血是冠心病患者发生心肌梗死等不良心血管事件的危险因素[9]。此外Bellotto[14]指出停用阿司匹林等抗血小板药物会增加心肌梗死的风险,但在出血期间不停用阿司匹林则会成倍增加出血的风险。在本研究中阿司匹林使用最多,并且在出血急性期均未使用抗血小板或抗凝药物,2016年抗栓药物专家意见中也指出出血急性期需停用抗栓药物。冠心病病史、入院时低血压、老年人、贫血、出血病情重、白细胞总数升高等是出血后心肌梗死的高危因素[11,15]。本文中经过多因素分析发现贫血、糖尿病、既往心梗病史是出血后心血管不良事件的危险因素。
Bellotto等[14]发现住院期间血红蛋白最低值低于82 g/L是心肌梗死的高危因素。本研究发现,患者入院时Hb与远期心血管不良事件有关,其截断值为74 g/L,较Bellotto等人的研究值稍低,这可能与研究终点事件不同、两者纳入人群不同等有关。贫血导致心血管不良事件的可能机制有交感神经激活导致心率加快,心肌耗氧量增加,加重心肌缺血或引起心律失常[14]。
此外,多项研究发现糖尿病和高血压也是心血管不良事件的危险因素。既往研究已经证实糖尿病患者血糖长期处于高水平,其动脉内血管内皮细胞损失,增加血管通透性,易发生动脉粥样硬化[15]。高血压患者体内的脂质代谢异常容易导致血脂粘滞,附着在冠状动脉内壁形成动脉粥样硬化而导致冠心病[15]。
本研究中院内再出血、出院1周是否开始抗凝治疗在单因素及多因素分析中均无意义,但2016年Chan等[16]发现出血停止后尽快服用阿司匹林或华法林虽然会增加消化道再出血的风险但会降低患者心血管死亡风险。这可能是由于单中心研究较难发现较弱的关联关系。
性别、输血、PPI使用仅在单因素分析中有意义,但2016年抗栓药物专家建议中及国内外多篇文献指出[17-20],输血治疗、使用PPI类药物、PPI与氯吡格雷之间的相互作用均有可能是冠心病患者再出血或心梗的影响因素。2015年一篇台湾的研究发现冠心病患者消化道出血后2年内发生心肌梗死的危险因素有女性、<65岁[20],与本研究的结果不同,这可能是因为纳入人数不同、终点事件不同、随访时间不同造成的。
综上,本研究首次发现现有的GBS评分系统及AIMS65评分系统对冠心病合并消化道出血患者的远期预后的预测功能一般,目前针对这部分患者需要更为有效的评分系统用于预测远期预后。另外,本研究发现贫血、高血压、糖尿病是这部分病人心血管不良事件发生的独立危险因素。但是本研究也存在一些缺陷,作为一个单中心的回顾性研究,在进行随访过程中,难免会有回忆偏椅等因素存在。因此,今后还需要大样本多中心、长随访时间的前瞻性研究以发现确实的危险因素,进一步提出更合适的评分系统。
