副结核分支杆菌MAP0862蛋白的表达及临床应用
2019-04-06解晓莉孙阳阳程凯慧楚会萌张亮王基隆杨美杨宏军
解晓莉 孙阳阳 程凯慧 楚会萌 张亮 王基隆 杨美 杨宏军


摘要:本研究以腹泻牛粪便基因组DNA为模板,扩增MAP0862基因,构建重组表达载体pET-30a(+)-MAP0862和pEGX-6P-1-MAP0862,通过原核表达系统表达His-MAP0862和GST-MAP0862蛋白,经纯化后制备兔源高免血清,建立ELISA特异性检测方法,最后将纯化蛋白和ELISA方法用于牛副结核病临床样品检测,并对检测数据进行分析。结果表明,以MAP0862蛋白为检测原建立的ELISA检测方法在临床样品检测中具有较高的特异性和敏感性,说明MAP0862蛋白适用于副结核病抗体检测。本研究建立的ELISA检测方法可有效检测临床样品中副结核病的感染。
关键词:副结核病;MAP0862蛋白;ELISA;副结核分枝杆菌
中图分类号:S852.61+8文献标识号:A文章编号:1001-4942(2019)02-0111-06
Expression and Clinical Significance of Mycobacterium
avium subsp. paratuberculosis MAP0862 Protein
Xie Xiaoli, Sun Yangyang, Cheng Kaihui, Chu Huimeng,
Zhang Liang, Wang Jilong, Yang Mei, Yang Hongjun
(Dairy Cattle Research Center, Shandong Academy of Agricultural Sciences, Jinan 250131,China)
AbstractThe MAP0862 gene was cloned from fecal genome of diarrhea cattles. The pET-320(+)-MAP0862 and pEGX-6P-1-MAP0862 expression vector were constructed to express the His-MAP0862 and GST-MAP0862 proteins. The recombinant proteins were used to obtain immune serum after purification, and the ELISA method was established. The MAP0862 protein and ELISA method were used to detect paratuberculosis. The results showed that there was highly specificity and sensitivity in ELISA test using MAP0862 protein as stimulator, so it was confirmed that MAP0862 protein was optimal for antibody detection of paratuberlosis. The ELISA method established based on MAP0862 protein could detect paratuberculosis effectively in clinical samples.
KeywordsParatuberculosis; MAP0862 protein; ELISA; Mycobacterium avium subsp. paratuberculosis (MAP)
副結核病(paratuberculosis)是一种由副结核分支杆菌即禽分枝杆菌副结核亚种(Mycobacterium avium subsp. paratuberculosis,MAP)引起的以慢性增生性、顽固性肠炎和进行性消瘦为特征的传染病[1,2],具有强烈的传染性,而且可垂直传播。副结核分枝杆菌主要感染反刍动物,如牛、山羊、绵羊和鹿等,也可感染部分野生非反刍兽[3]。牛在一岁前最易感染MAP,但直到2~5岁才会出现临床症状,导致顽固性腹泻、消瘦、产奶量和繁殖力严重下降至丧失,最终导致淘汰。另外,有报道指出,牛副结核分枝杆菌与人的局限性肠炎以及HIV和其他免疫缺陷病的感染有关[4-9]。
副结核分支杆菌感染后机体的免疫应答在感染初期以细胞免疫为主,皮内变态反应检出率高,但随着病情的发展,细胞免疫应答逐渐减弱而体液免疫应答逐渐增强[10-12]。MAP对牛的持续性感染可以分为两个阶段,首先是MAP感染宿主进入肠道,然后进入巨噬细胞[13],并在巨噬细胞内生存和增殖[14],从而导致MAP的持续性感染。而MAP特异性基因编码的蛋白是影响MAP在巨噬细胞内定殖和发挥致病力的重要因素[15,16]。另外,由于MAP特异性抗原可以区别于环境中的分枝杆菌尤其是禽分枝杆菌,所以其在副结核病的诊断方面具有良好的敏感性和特异性。因此,众多学者开展了MAP特异性抗原的分析工作,并鉴定出一些具有诊断价值的抗原[17,18],如MAP0862、MAP2154c等。
MAP0862蛋白是MAP特异性抗原,在副结核诊断中具有良好的特异性和灵敏性。本研究从成母牛的腹泻粪便中提取基因组DNA,扩增克隆MAP0862基因,并体外表达纯化相关蛋白,建立ELISA和早期检测方法,应用于牛副结核病的临床诊断,以评价其临床诊断应用价值。
1材料与方法
1.1质粒、菌株及主要试剂
pMD-20T克隆载体、感受态DH5α、BL21(DE3)、蛋白质Marker均购自北京TransGen Biotech;pET-30a(+)和pEGX-6P-1由本实验室保存;限制性内切酶BamHⅠ、EcoRⅠ及DNA Marker均购于大连宝生物工程有限公司;Anti-His mAb和Anti-GST mAb及羊抗鼠IgG-HRP购自Sigma公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;DNA回收试剂盒和质粒抽提试剂盒均购自北京TianGen Biotech;His-Bind Purification Kit和GST-tag Protein Purification Kit购自Novagen公司;试验用雌兔购于山东省农业科学院种兔实验基地。其余试剂为国产分析纯。
1.2副结核分支杆菌基因扩增模板的选取
取少量腹泻牛粪便于无菌离心管内,加入无菌SW,振荡混匀,10 000 r/min离心3 min,弃上清,用粪便基因组DNA提取试剂盒提取总DNA。
根据GenBank中IS900序列(CP005928)设计引物,由北京华大生物科技有限公司合成,序列为:F:5′-CTGGCTACCAAACTCCCGA-3′,R:5′-GAACTCAGCGCCCAGGAT-3′,预计扩增目的片段长度为314 bp,琼脂糖凝胶电泳鉴定,鉴定正确的总DNA作为MAP0862基因扩增的模板。
1.3MAP0862基因的克隆
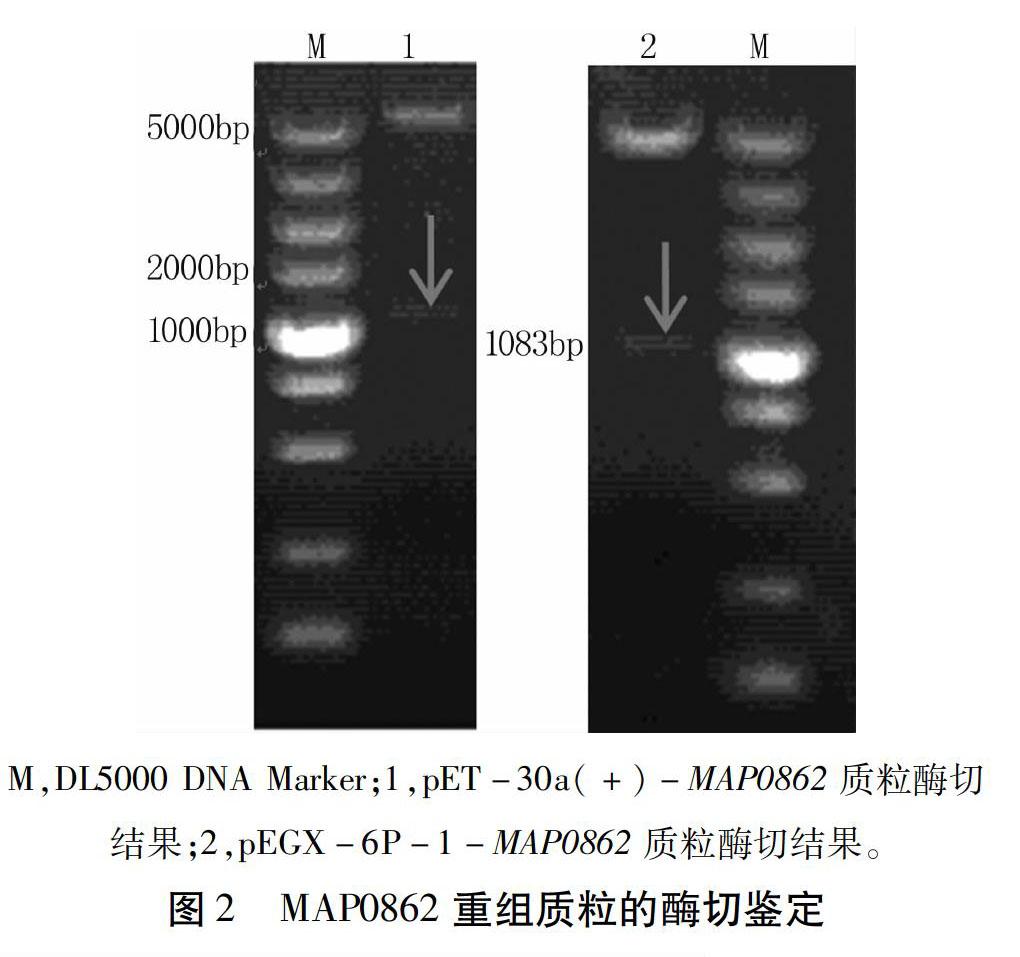
根据GenBank中MAP0862基因序列(NC_002944.2)设计引物,由北京华大生物科技有限公司合成,引物序列为:Ps1:5′-CAGGATCCATGCGCTTCGTAAACGGCAA-3′(BamHⅠ),Pa1:5′-ATGAATTCTCAGGCGCGCCACAGATTT-3′(EcoRⅠ),预计扩增目的片段长度为1 083 bp。参照文献[12]方法进行RT-PCR、连接、转化、筛选、酶切和测序鉴定,将重组质粒命名为pMD-20T-MAP0862。利用NCBI中的BLAST进行MAP0862氨基酸序列比对。
1.4重组MAP0862蛋白的表达与鉴定
将重组质粒pMD-20T-MAP0862和pET-30a(+)、pEGX-6P-1同时使用EcoRⅠ和BamHⅠ进行双酶切,连接、转化宿主菌BL21(DE3)中构建重组菌(pET-30a(+)-MAP0862/BL21)和(pEGX-6P-1-MAP0862/BL21)。同上方法进行筛选、酶切和测序鉴定。取鉴定正确的菌液培养,经IPTG(终浓度为0.5 mmol/L)30℃诱导后,超声波裂解离心取上清。使用His-Bind Purification Kit和GST-tag Protein Purification Kit纯化His-MAP0862和GST-MAP0862蛋白,使用超滤柱对纯化的蛋白进行除盐浓缩。参照文献[12]的方法以Anti-His mAb和Anti-GST mAb (1∶2 000)為一抗,羊抗鼠IgG-HRP(1:4 000)为二抗,ECL显色,进行Western blot鉴定。利用BCA蛋白浓度测定试剂盒(增强型)对纯化蛋白浓度进行测定。
1.5MAP0862蛋白高免血清的制备
免疫前对家兔耳缘静脉采血,收集血清,以备后续检测使用。以纯化的His-MAP0862蛋白为免疫原,与等体积的弗氏完全佐剂充分混合均匀,对家兔(2 kg/只,雌性)进行皮下多点免疫,免疫剂量为1.0 mg/只。分别于首次免疫两周和四周后,将His-MAP0862蛋白和弗氏不完全佐剂等体积混合免疫家兔。于第三次免疫两周后,收集少量血清进行抗体水平分析,抗体大量产生后处死家兔,收集血清。
1.6MAP0862抗体检测ELISA方法的建立
使用包被液(Na2CO3/NaHCO3缓冲液,pH值9.6)稀释GST-MAP0862蛋白分别为0.25、0.5、1.0、2.0、5.0、10.0 μg/mL和20.0 μg/mL作为包被抗原,100 μL/孔,置于4℃过夜包被;用PBST洗板,然后加入10%小牛血清,200 μL/孔封闭2 h;用PBST洗板,然后加入1∶100、1∶200、1∶400到1∶102 400倍比稀释的血清,以PBS为空白对照,100 μL/孔,37℃孵育2 h;用PBST洗板,加入HRP标记的羊抗兔IgG抗体(用PBST进行1∶5 000稀释),100 μL/孔,37℃孵育1 h;用PBST洗板,加入TMB显色液,100 μL/孔,避光反应10~15 min后,加入终止液(2 mol/L H2SO4)50μL/孔,读取吸光值(OD 492)。经多次调整抗原包被浓度和血清稀释度后,确定GST-MAP0862抗原的最佳包被浓度,建立MAP0862抗体检测方法。并以建立的ELISA方法对高免血清抗体效价进行评定。
1.7MAP0862在临床检测上的应用
1.7.1ELISA方法检测牛群中副结核病的感染情况采集牛颈静脉或尾静脉血于促凝管中,收集血清。用爱德士的牛副结核分枝杆菌抗体检测试剂盒和上述建立的MAP0862间接ELISA检测方法,分别对收集的血清进行ELISA检测。具体步骤参照试剂盒说明书和上述ELISA检测方法建立步骤。整理检测结果,对两种检测方法在副结核病检测中的特异性和敏感性进行比对分析。
1.7.2皮肤变态反应检测牛群中副结核病的早期感染情况将牛在颈夹保定的基础上进行头部安全固定,充分暴露出颈部,在颈部相聚10 cm以上的部位选取两点分别作为副结核菌素和MAP0862蛋白的注射点,剃毛。然后用电子游标卡尺测量注射点的皮肤厚度,记录数据。消毒后,在两个注射点分别皮内注入0.1 mL的副结核菌素(0.5 mg/mL)和MAP0862蛋白(0.05 mg/mL,高纯蛋白使用浓度为副结核菌素的1/10)。注射72 h后测量注射点的皮肤厚度,记录数据。分析注射前后皮肤厚度差,判断牛只副结核分支杆菌感染状态。对比结果,分析MAP0862蛋白和副结核菌素作为副结核病检测刺激原的特异性和敏感性。
1.7.3IFN-γ释放试验检测牛群中副结核病的早期感染情况无菌采集牛颈静脉或尾静脉血5 mL于含肝素锂或肝素钠的抗凝管中,轻轻颠倒混匀防止部分血液发生凝血。无菌条件下将血液分装至3个无菌离心管内,1.5 mL/支,分别加入100 μL PBS,副结核菌素(200 IU)和MAP0862蛋白(20 μg/mL),充分混匀,37℃孵育16~24 h。500×g离心10 min后,将上层血浆转移到新的离心管中。根据Prionics公司的Bovigam牛结核分枝杆菌γ干扰素ELISA检测试剂盒说明书进行接下来的ELISA检测,读取OD 450的吸光度,分析牛群的感染情况及两种刺激原在此方法应用中的特异性及敏感性。
1.7.4MAP0862蛋白在副结核病诊断中的应用前景分析汇总数据,分析MAP0862蛋白和副结核菌素在副结核病诊断中的结果符合率及各刺激原在检测中的特异性及敏感性。
2结果与分析
2.1MAP0862基因的克隆和重组质粒构建
以临床上筛选到的阳性粪便样品全基因组DNA为模板,成功扩增1 083 bp的MAP0862基因(图1),经测序鉴定正确无突变。
MAP0862重组质粒经BamHⅠ和EcoRⅠ双酶切鉴定,得到1 083 bp的目的片段(图2),BLAST比对结果显示该基因与NCBI公布的相应序列同源性均为100%,重组质粒均构建正确。
2.2MAP0862蛋白的表达与鉴定
将原核表达产物经SDS-PAGE与Western blot(图3)分析显示,His-MAP0862和GST-MAP0862蛋白均已表达,且大小与预期大小(分别为44 kD和64 kD)一致。利用BCA蛋白浓度测定试剂盒测得纯化的His-MAP0862和GST-MAP0862蛋白浓度分别为1.5 mg/mL和1.0mg/mL。
2.3MAP0862间接ELISA检测方法的建立
根据不同包被浓度下空白对照和阴性值以及不同浓度抗体与抗原的反应情况,最终确定MAP0862蛋白的包被浓度为2 μg/mL,样品OD 450≥0.25且样品OD 450/阴性OD 450≥2时认为抗体阳性,否则为阴性。利用建立的ELISA方法,测定制备的兔源多抗的效价达1∶106(图4)。结果表明MAP0862具有良好的免疫原性和反应原性。
2.4MAP0862蛋白在临床诊断中的应用
2.4.1ELISA方法检测牛群中副结核病的感染情况收集274份牛血清进行牛副结核病抗体ELISA检测,结果显示,爱德士的牛副结核分枝杆菌抗体检测试剂盒检测出抗体阳性59头份,MAP0862抗原检测出抗体阳性48头份,其中一头爱德士试剂盒检测为可疑(列入陰性群)的牛只MAP0862蛋白检测抗体阳性。两种检测方法的符合率达95.26%。具体分析结果见表1。
2.4.2皮肤变态反应检测牛群中副结核病的早期感染情况皮肤变态反应试验共检测牛只100头份,根据《中华人民共和国出入境检验检疫行业标准SN/T 1084-2010》和OIE 2014年5月颁布的副结核病皮试检测判断标准:皮厚差>2 mm即判为副结核阳性,≤2 mm则为副结核阴性。结果显示副结核菌素作为检测原检测阳性11头份,MAP0862蛋白作为检测原检测阳性7头份。两者整体符合率达82.00%,但阳性符合率为0。具体分析结果见表2。
2.4.3IFN-γ释放试验检测牛群中副结核病的早期感染情况从上述检测的100头份牛只中采取51头份奶牛抗凝血进行IFN-γ释放试验检测,结果显示,副结核菌素作为刺激剂检测阳性15头份,MAP0862蛋白作为刺激剂检测阳性15头份。两者的整体符合率仅为68.63%。具体分析结果见表3。
2.4.4MAP0862蛋白在副结核诊断中的应用前景分析将皮肤变态反应和IFN-γ释放试验结果进行对比分析,结果显示以副结核菌素作为检测原,两种方法的符合率为62.75%;而以MAP0862蛋白作为检测原,两种方法的符合率达73.53%。说明在副结核病的早期诊断中MAP0862蛋白作为检测原具有较高的特异性,但相较于副结核菌素的高阳性检出率,MAP0862蛋白在副结核病的早期检测中的敏感性可能相对较低。而在抗体检测中,MAP0862蛋白作为检测原,与商品化的试剂盒检测结果的符合率较高,且其作为单一抗原,在检测的特异性上可能更有优势,因此MAP0862蛋白更适合应用于副结核病的抗体检测。
3讨论与结论
副结核病是由副结核分枝杆菌引起的反刍兽的慢性消化道疾病,以顽固性腹泻、渐进性消瘦、肠黏膜增厚并形成皱襞为特征。本病呈世界性流行,无明显季节性,主要呈散发,有时可呈地方性流行。副结核病的主要诊断方法为以副结核提纯菌素或禽结核提纯菌素为刺激原或检测原的皮试检测和ELISA抗体检测,但由于副结核分枝杆菌与结核分枝杆菌复合群内的主要致病菌牛分枝杆菌和结核分枝杆菌的同源性较高,相互之间干扰较大,降低了检测特异性,易引起检测的假阳性。
MAP0862蛋白为副结核分枝杆菌特异性抗原,其可对副结核病进行特异性检测,不受其他分枝杆菌的影响。本研究利用大肠杆菌表达系统进行MAP0862蛋白的体外表达获得高纯MAP0862蛋白,制备高免血清并建立了ELISA特异性检测方法。利用此方法对临床样品进行检测,结果显示,本方法与商品化爱德士试剂盒检测结果的符合率达95.26%,表明此方法具有较好的特异性与敏感性;且其作为单一检测原,与爱德士试剂盒中以副结核菌素为检测原相比,具有更高的特异性。
以MAP0862蛋白作为刺激原通过皮肤变态反应和IFN-γ释放试验对临床样品进行检测,结果显示,在皮肤变态反应中,MAP0862蛋白与副结核菌素作为刺激原的检测结果的符合率为82.00%;在IFN-γ释放试验中,MAP0862蛋白与副结核菌素作为刺激原的检测结果的符合率为68.63%。但MAP0862蛋白在两种方法的检测中有更高的符合率,表明MAP0862蛋白在副结核病的早期检测中有更高的特异性,但其敏感性较低。
本研究结果表明,MAP0862蛋白在副结核病的抗体ELISA检测中具有较好的特异性与敏感性,可用于副结核病的血清学抗体检测。根据这一结果推测MAP0862蛋白主要在以体液免疫为主的副结核病感染中后期参与副结核病感染。本研究为副结核病诊断方法的研究提供了借鉴依据与研究方向,有利于副结核病诊断方法研究的进一步开展。
參考文献:
[1]Olsen I, Sigurgardottir G, Jonne D B. Paratuberculosis with special reference to cattle. A review[J]. Vet. Q., 200 24:12-28.
[2]Whittington R J, Sergeant E S. Progress towards understanding the spread, detection and control of Mycobactrium avium subsp. paratuberculosis in animal population[J]. Aust. Vet. J., 200 79:267-278.
[3]Motiwala A S, Amonsin A, Strother M, et al. Molecular epidemiology of Mycobacterium avium subsp. paratuberculosis isolates recovered from wild animal species[J]. J. Clin. Microbiol., 2004, 42:1703-1712.
[4]Chacon O, Bermudez L E, Barletta R G. Johnes disease, inflammatory bowel disease, and Mycobacterium paratuberculosis[J]. Annu. Rev. Microbiol., 2004, 58:329-363.
[5]Davis W C, Madsen-Bouterse S A. Crohns disease and Mycobacterium avium subsp. paratuberculosis: the need for a study is long overdue[J]. Vet. Immunol. Immunopathol., 201 145:1-6.
[6]Paccagnini D, Sieswerda L, Rosu V, et al. Linking chronic infection and autoimmune disease: Mycobacterium avium subspecies paratuberculosis, SLC11A1 polymorphisms and type-1 diabetes mellitus[J]. PLoS One, 2009, 4:e7109.
[7]Sisto M, Cucci L, DAmore M, et al. Proposing a relationship between Mycobacterium avium subspecies paratuberculosis infection and Hashimotos thyroiditis[J]. Scand. J. Infect. Dis., 2010, 42:787-790.
[8]Arru G, Caggiu E, Paulus K, et al. Is there a role for Mycobacterium avium subspecies paratuberculosis in Parkinsons disease?[J]. J. Neuroimmunol., 2016, 293:86-90.
[9]Niegowska M, Delitala A, Pes G M, et al. Increased seroreactivity to proinsulin and homologous mycobacterial peptides in latent autommune diabetes in adults[J]. PLoS One, 2017, 12:e0176584.
[10]Coussens P M. Model for immune responses to Mycobacterium avium subspecies paratuberculosis in cattle[J]. Infect Immun., 2004, 72:3089-3096.
[11]Stabel J P. Transition in immune response to Mycobacterium paratuberculosis[J]. Vet. Microbiol., 2000, 77: 465-473.
[12]Koo H C, Park Y H, Hamilton M J. Analysis of the immune response to Mycobacterium avium subsp. paratuberculosis in experimentally infected calves[J]. Infect Immun., 2004, 72: 6870-6883.
[13]Arsenault R J, Maattanen P, Daigle J, et al. From mouth to macrophage: mechanism of innate immune subversion by Mycobacterium avium subsp. paratuberculosis[J]. Vet. Res., 2014, 45(54):1-15.
[14]Kuehnel M P, Goethe R, Habermann A, et al. Characterization of the intracellular survival of Mycobacterium avium ssp. paratuberculosis: phagosomal PH and fusogenicity in J774 macrophages compared with other mycobacteria[J]. Cell Microbiol., 200 3(8):551-556.
[15]Bannantine J P, Barletta R G, Stabel J R, et al. Application of the genome sequence to address concerns that Mycobacterium avium subspecies paratuberculosis might be a foodborne pathogen[J]. Foodborne Pathog. Dis., 2004, 1:3-15.
[16]Wang J, Pritchard J R, Kreitmann L, et al. Disruption of Mycobacterium avium subsp. paratuberculosis-specific genes impairs in vivo fitness[J]. BMC Genomics, 2014, 15:415.
[17]Bannantine J P, Paustain M L, Waters W R, et al. Profiling bovine antibody responses to Mycobacterium avium subsp. paratuberculosis infection by using protein arrays[J]. Infect. Immun., 2008, 76(2):739-749.
[18]Paustain M L, Amonsin A, Kapur V, et al. Characterzation of novel coding sequences specific to Mycobacterium avium subsp. paratuberculosis: implications for diagnosis of Johnes disease[J]. J. Clin. Microbiol., 2004, 42(6):2675-2681.
