入侵植物小蓬草的细菌群落组成和多样性研究
2019-04-04程丹丹田忠赛
程丹丹,赵 菁,田忠赛
(中国地质大学(武汉)环境学院,湖北 武汉 430074)
生物入侵被认为是目前仅次于土地利用变化而导致全球生物多样性丧失的第二大因素[1],严重威胁着生态系统的健康,是影响生物和生态安全的重要因素之一。尽管已经开始采取诸多措施来防治生物入侵,但其依旧是当今全球面临的重大生态环境问题之一[2]。我国已经查明的外来入侵物种共529种,其中入侵植物多达270种,影响也日趋严重[3]。入侵植物具备规模大、范围广、难以清除、清除成本高等特点,能对农业、林业、畜牧业产生最直接的经济危害,并且给本土生物多样性带来不利的影响。对入侵植物微生物组的研究,能在一定程度上揭示微生物是否对生物入侵产生帮助,有助于植物入侵机制的探索,同时发现某些有益促生菌也是良好的生物资源。如Rout等[4]通过对北美入侵植物假高粱(Sorghumhalepense)的研究发现,内生细菌能够固氮、溶磷,增强入侵植物的竞争力,改变入侵植物所在群落的生物地球化学循环特征;Aschehoug等[5]通过对北美草原入侵植物矢车菊(Centaureastoebe)接种内生真菌的研究发现,内生真菌可以增强矢车菊对土著植物的竞争能力,并增强化感作用。
植物微生物组(Plant microbiota/microbiome)是指在植物生长环境中,所有栖息附着于植物宿主表面和(或者)内部的各种微生物。从微生物分布的部位来说,植物微生物可以分为:根际微生物(rhizosphere microbe)、内生微生物(endophytes)、叶际微生物(phyllosphere microbe)[6-7]。其中,根际微生物被认为是植物的“第二基因组”(secondary genome),为植物提供微生物衍生的化合物,有助于植物固氮、溶磷、耐寒和耐盐碱[8-9]。叶际微生物是指植物叶表所有能栖息微生物区域的微生物,包括茎、花、果实和叶表面,广义的叶际微生物也包括叶内的微生物。植物叶际定殖有数百种微生物,其中大部分为细菌[10-11],叶际微生物被认为是植物与大气环境交互响应的媒介,对揭示植物与环境因子间的响应机制十分重要[12-13]。内生微生物是指其生活史的一定阶段或全部阶段存在于植物各种组织和器官内部,一般认为是不会引起植物感染、不会改变植物性状的微生物[14]。内生微生物可以增强宿主对各种胁迫环境的耐受力,促进植物生长,提高植物适应力,植物甚至可以将有利的内生微生物通过种子传递给下一代[15-16]。总体来说,植物微生物可以矿化土壤有机质、刺激植物防御机制、制约植物病原体,是决定土壤质量、植物健康和生产力的关键因素之一,在植物生长和抗病中起着重要作用[17-18]。
在植物微生物组研究中通常要求植物样品采集后储存在4℃条件,且在24 h之内处理,以保证试验材料的新鲜和试验结果的准确。在植物内生菌的研究中需要对试验材料进行严格的表面消毒,以去除材料表面DNA的污染,以免对内生菌的提取、测序和数据分析产生干扰;同时还需要充分地研磨,使植物内生菌的DNA充分释放,以达到测序结果可靠性的最大化。目前,在植物内生菌的研究中,表面消毒多采用化学法,即使用乙醇、双氧水、次氯酸钠等化学试剂组合清洗植物材料表面。这些试剂能杀死细菌并降解残留DNA,针对不同的植物,通过改变消毒液浓度和消毒时间,均能达到较好的除菌和降解DNA的效果[19-20]。例如对美洲黑杨(Populusdeltoides)根内生菌的研究中,就使用了双氧水、乙醇和次氯酸钠去除根表细菌[21]。此外,还有少部分研究使用无菌水大量冲洗,使用超声波、涡旋震荡等机械法来去除植物材料的表面细菌,如在水稻根微生物组研究中,获取根内生菌则是使用超声波处理,通过多次的超声波以确保根表附着的微生物全部脱离[22]。Richter-Heitmann等[23]对比了采用化学和机械的除菌方法对水稻根微生物组研究结果的影响,结果发现使用水冲洗和使用化学试剂并未破坏根表组织的完整性,而不同的频率声波会对根表组织产生一定的破坏,因此建议研究内生菌还是使用化学法去除表面细菌DNA。在植物基因组和代谢组的研究中,常常使用机器研磨代替人工研磨,以便快速处理植物样本,而冷冻干燥后的植物样本能达到长期保存样本的目的。但是这些处理方式在植物微生物组研究中尚不多见,还需要评估其对植物微生物组的研究是否存在不利的影响。
本文选用入侵植物小蓬草(ConyzacanadensisL.)为研究对象,小蓬草是菊科一年生草本,原产北美,是我国分布最广的入侵物种之一[24]。通过提取小蓬草相关的细菌DNA,用特异性引物通过PCR扩增细菌DNA的16S rRNA 基因的V5~V7高变区,使用Illumina MiSeq测序平台对目标序列进行测序,再利用获得的测序数据进行Alpha和Beta多样性分析,探索小蓬草生境中的土壤及其根和叶的细菌群落组成和多样性,并分析表面消毒、冷冻干燥保存和不同研磨方法等处理方式对研究结果的影响。该研究结果可为后续入侵植物微生物组的试验研究提供一定的方法指导,并为微生物在植物入侵机制中所起的作用研究提供一定的数据支持。
1 材料与方法
1.1 样本采集
小蓬草样本均于2017年7月采自中国地质大学(武汉)北区草地。在研究区随机选取3个采样点,每个采样点之间的间隔不超过2 m,每个采样点采集3株相邻且长势良好的小蓬草。将3株植株小心地连根挖出,轻轻将附着在根上的土抖落至自封袋中混合均匀,记作根围土(root zone soil)。采集每个植株根周围0~10 cm的表土,组成混合土样记作背景土(bulk soil)。将小蓬草根在50 mL灭菌离心管中用无菌水冲洗,经过3 000 r/min离心5 min后弃掉上清液,将沉淀物记作根际土(rhizosphere soil)[25]。全部样本放入无菌自封袋、离心管中,均密封储存于4℃低温保鲜,在24 h之内进行后续处理。
1.2 样本处理
将每个采样点的3株小蓬草分为地上和地下部分,用纯水清洗植物材料表面杂质,选取新鲜的无病虫害的叶和长势良好的根,将其按照采样点分别均匀混合后,均分8份,对应8个处理组合。处理组合按照如下划分:样品是否进行表面消毒处理、冷冻干燥处理还是及时处理新鲜样本、机器研磨和人工研磨两种研磨方式;每个处理组合有3个生物学重复。表面消毒的流程是:将样品在70%酒精振荡浸泡1 min,1%NaClO振荡浸泡1~2 min(地上部分为1 min,地下部分为2 min),随后用无菌水冲洗4次,取最后一次冲洗的无菌水涂布牛肉膏蛋白胨平板,培养2~3 d,若无菌落生长则确定表面消毒除菌完全。未进行表面消毒的样品直接进行后续处理。冷冻干燥处理是将样品放入灭菌50 mL离心管中,使用冷冻干燥机处理48 h,随后至-20℃保存,于一个月后进行后续处理。未进行冷冻干燥的样品在24 h之内迅速处理。机器研磨是采用高通量组织研磨机(Retsch®MM400,German)将样品在频率为300 s-1下研磨3 min;人工研磨则是将样品置于灭菌研钵中加入液氮研磨成粉末[26]。
1.3 PCR扩增及高通量测序
所有样品(植物样、土壤样)DNA均使用试剂盒MOBIO PowerSoil DNA Isolation Kit (MO-BIO,Carlsbad,CA,USA) 提取,植物样研磨后取约2 g,土壤样取约0.25~0.3 g,按照说明书提取DNA。使用16S rRNA基因扩增子来确定每个样品中的细菌群落多样性。PCR采用的引物是799F-1193R(799F:AACMGGATTAGATACCCKG,1193R:ACGTCATCCCCACCTTCC),因为这一对特异性引物被设计用来扩增细菌DNA的16S rRNA基因的V5~V7高变区,一定程度上可以避免植物叶绿体和线粒体的扩增[27-28]。PCR采用25 uL反应体系,包括:含有10 uM的正向和反向引物,10 ng的DNA模板及Q5®高保真DNA聚合酶,于98℃预变性2 min后,98℃变性15 s,55℃退火30 s,72℃延伸30 s循环30次后,72℃终延伸5 min。
将样品在2%琼脂糖凝胶电泳上检测,选择条带在400~500 bp长度进行切胶回收,使用AXYGEN切胶回收试剂盒进行回收纯化。将回收产物使用全自动定量绘图酶标仪Mircoplate reader(BioTek,FLx800)进行荧光定量,根据每个样本测序量的需求,按相应比例进行混合。使用TruSeq®Nano DNALT Library Prep Kit (Illumina,CA,USA)试剂盒制备测序文库。通过对测序文库在生物芯片分析仪Agilent Boanalyzer上进行质检,使用Promega QuantiFluor荧光定量系统对文库进行定量后,采用ILLumina MiSeq测序平台进行2×300 bp双端测序,测序在上海派森诺生物科技有限公司进行。
1.4 序列数据处理
按照样本特有的条形码,将各样本序列分成成对的reads,采用FLASH(V1.2.7,http://ccb.jhu.edu/software/FLASH/)切除每个样本reads的条码及引物序列并进行拼接,运用QIIME软件(V1.7.0,http://qiime.org/scripts/split_libraries_fastq.html)对原始序列进行质量控制,得到高质量可用数据(Clean Tags)。通过与数据库(Gold database,http://drive5.com/uchime/uchime_download.html)进行比对,使用UCHIME算法(http://www.drive5.com/usearch/manual/uchime_algo.html)检测并去除嵌合体序列,最终得到有效数据(Effective Tags)。
调用Uparse序列对比工具(Uparse v7.0.1001,http://drive5.com/uparse/)对获得的高质量数据按照序列按97%的序列相似度进行归并和OTU(operational taxonomic unit,可操作分类)划分,并选取每个OTU中丰度最高的序列作为该OTU的代表序列,在Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com/)进行注释。序列处理和注释均在上海派森诺生物科技有限公司进行。获得原始OTU丰度矩阵之后,将丰度值低于全样本测序总量0.001%的OTU去除,并剔除掉鉴定出来属于叶绿体和线粒体的宿主序列,此OTU丰度矩阵用于后续分析。
1.5 统计分析
利用ImageGP 易汉博生物信息在线作图网站(http://www.ehbio.com/ImageGP/index.php/Home/Index/VennDiagram.html)绘制Venn图、箱线图。基于未进行均一化的数据并使用R软件包(Biodiversity R)计算每个样本群落的Alpha-多样性(Shannon指数),分别对根、叶、土壤细菌群落的不同水平分类单元的丰度的中位数进行排序,决定优势门和科,并绘制优势门和科丰度的柱形图。方差分析和组间多重比较结果均通过R软件包进行。NMDS(Nonmetric Multidimensional Scaling,非度量多维尺度)分析和Adonis分析则是基于BC(Bray-Curtic,相异度)距离,利用R软件包vegen完成。
2 结果与分析
2.1 样本细菌群落的Alpha多样性
本次从57个样本中得到3 460 130的高质量DNA片段,剔除鉴定为非细菌、叶绿体或者线粒体的序列后,剩下1 498 222条序列,鉴定为3 315个OTU,见图1。从根样本中鉴定出的OTU数目最多,占总OTU数目的96%。根样本包含大多存在于土壤、叶中的OTU,根叶共有的OTU数目占总OTU数目的53.5%,根土共有的OTU数目占总OTU数目的68%,根特有的OTU数目211个(占总OTU数目的6.4%)被鉴定。叶样本中鉴定出的OTU数目最少,只占总OTU数目的55.1%,且叶中特有的OTU最少,仅有51个(占总OTU数目的1.5%[见图1(a)]。从3种类型的土壤中鉴定出的共有OTU数目很高,占总OTU数目的58.9%,3种土壤均包含小部分特有的OTU数目(占总OTU数目的5.0%~7.9%)[见图1(b)]。
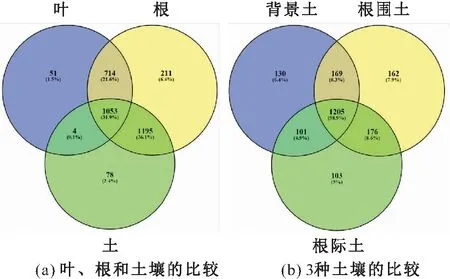
图1 土壤和小蓬草根、叶中细菌群落共有的OTU韦恩图Fig.1 Venn diagrams of shared bacteria operational taxonomic units (OTU) in bacterial communities in leaf,root and soil associated with Conyza canadensis
来自不同类型样本(小蓬草根、叶和土壤样本)细菌群落的Alpha多样性(以Shannon指数为代表)存在显著的差异,小蓬草叶样本细菌群落的Aplha多样性最低,其次是小蓬草根样本,土壤样本细菌群落的Alpha多样性最高。背景土、根围土和根际土细菌群落的Alpha多样性基本保持在同一水平,虽然根际土细菌群落的Alpha多样性较根围土和背景土略低,但是3种土壤之间的差异不显著,见图2。

图2 土壤和小蓬草根、叶中细菌群落的Shannon指数 箱线图Fig.2 Boxplot of Shannon index of bacterial communities from leaf,root and soil samples associated withConyza canadensis不同样本类型间差异显著(AVOVA test:df=4,52;F=24.82;p<0.001)。图中不同的字母表示组间多重比较的结果。
2.2 样本细菌群落组成
本次总共发现了25个不同的细菌门,其中平均丰度排名前10的细菌门所占丰度之和在各个样本中均大于 98%,且前3门(变形菌门Proteobacteria、放线菌门Actinobacteria和拟杆菌门Bacteroidetes)丰度之和均大于90%。小蓬草根、叶和土壤细菌群落前10门的相对丰度排序略有不同,但三者均以变形菌门和放线菌门为优势门,这两个门的丰度之和在小蓬草根和叶细菌群落中高达85%,在土壤细菌群落中达到70%以上。其中,变形菌门在小蓬草叶细菌群落中丰度最高(65%),而放线菌门在小蓬草根细菌群落(38%)中的丰度高于小蓬草叶和土壤细菌群落中的丰度。比较小蓬草根、叶中的丰度土壤三类样本,小蓬草叶细菌群落中异常球菌门(Deinococcus-Thermus)的丰度占比为1.5%,略高于小蓬草根和土壤;小蓬草根细菌群落中厚壁菌门(Firmicutes)的丰度较高,占比为5%;而土壤细菌群落中拟杆菌门(Bacteroidetes,丰度占比为7.5%)、酸杆菌门(Acidobacteria,3.7%)、芽单胞菌门(Gemmatimonadetes,丰度占比为5.5%)、浮霉菌门(Planctomycetes,丰度占比为2.4%)、疣微菌门(Verrucomicrobia,丰度占比为2.1%)、硝化螺旋菌门(Nitrospirae,丰度占比为1.4%)的丰度均略高于它们在小蓬草叶、根细菌群落中的丰度[见图3(a)]。
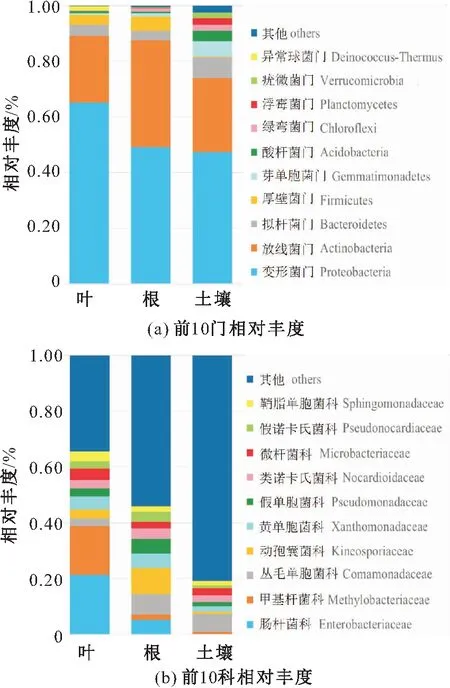
图3 土壤和小蓬草根、叶中细菌群落前10门及前 10科相对丰度柱形图Fig.3 Relative abundance of top 10 phyla and families of the leaf,root,and soil bacteria communities associated with Conyza canadensis
在科水平,小蓬草叶、根和土壤细菌群落前10科丰度差异较大:小蓬草根细菌群落的优势科是动孢囊菌科(Kineosporiaceae,丰度占比为9.27%)和丛毛单胞菌科(Comamonadaceae,丰度占比为7.38%);小蓬草叶细菌群落的优势科则是肠杆菌科(Enterobacteriaceae,丰度占比为21.34%)和甲基杆菌科(Methylobacteriaceae,丰度占比为17.54%),这两科在小蓬草根细菌群落中的丰度都很低;土壤细菌群落以丛毛单胞菌科(Comamonadaceae,丰度占比为6.40%)和亚硝化单胞菌科(Nitrosomonadaceae,丰度占比为4.54%)为优势科[见图3(b)]。
小蓬草叶细菌群落中的大部分OTU可以鉴定到属的水平,优势属包括甲基杆菌属(Methylobacterium)、假单胞菌属(Pseudomonas)、埃希氏-志贺氏菌属(Escherichia-Shigella)、沙雷氏菌属(Serratia)、无色杆菌属(Achromobacter)、鞘氨醇单胞菌属(Sphingomonas)和微杆菌属(Microbacterium)等,这些类群的丰度之和达到细菌群落总丰度的50%。根细菌群落中有29.4%的细菌未鉴定到属,已鉴定的优势属包含了上述小蓬草叶的优势属,同时还有链霉菌属(Streptomyces)、放线游动菌属(Actinoplanes)、类卡诺氏菌属(Nocardioides)、无色杆菌属(Achromobacter)、根瘤菌属(Rhizobium)和芽孢杆菌属(Bacillus)等。土壤中未鉴定到属的细菌OTU最多,达46.0%,除去未鉴定到属的细菌,丰度较高的有类卡诺氏菌属(Nocardioides)、产酸菌属(Acidibacter)和黄杆菌属(Flavobacterium),其中产酸杆菌属(Acidibacter)和黄杆菌属(Flavobacterium)的平均丰度高于小蓬草叶和根。
2.3 不同处理对小蓬草叶和根细菌群落研究结果的影响
进行表面消毒处理的样本中细菌群落的Alpha多样性均低于未进行表面消毒处理的样本,尤其是对小蓬草叶样本的影响十分显著,未进行表面消毒处理的小蓬草叶样本中细菌群落的Alpha多样性显著高于表面消毒处理过的样本[见图4(a)];在小蓬草根样本中,表面消毒处理的影响接近显著(p=0.051 8)[见图4(b)和表1]。采用不同的研磨方式和是否进冷冻干燥处理对小蓬草根和叶样本中细菌群落Alpha多样性的影响不显著(见图4和表1)。
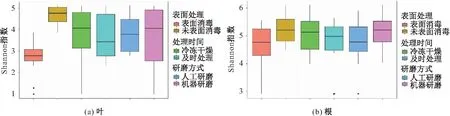
图4 不同处理的小蓬草根和叶中细菌群落的Shannon指数Fig.4 Shannon index of bacterial communities from Conyza canadensis leaf and root samples with different treatments

处理方式DfSum.SqMean.SqF值p值叶根叶根叶根叶根叶根表面消毒/未进行表面消毒1,231,2324.0801.88424.0801.884 154.9804.2290.000 1∗∗∗0.051 8人工研磨/机器研磨1,231,230.0000.1740.002 80.173 90.0020.3320.966 00.570 0冷冻干燥保存处理/及时处理1,231,230.3000.7580.301 40.758 40.1981.5270.660 00.230 0
注:“***”表示在0.000 1水平上差异显著。
NMDS分析结果表明:来自于小蓬草根、叶和土壤的细菌群落组成差异明显[图5(a)],是否进行表面消毒处理的根和叶样本的细菌群落组成差异显著[见图5(b)];而采用不同研磨方式和是否进行冷冻干燥保存处理的小蓬草根和叶样本的细菌群落组成差异不显著[见图5(c)、图5(d)]。Adonis分析结果表明:是否进行表面消毒处理的小蓬草根、叶样本的细菌群落组成差异显著,但是否进行冰冻干燥处理和采用不同研磨方式对小蓬草根和叶样本的细菌群落组成的影响不显著,见表2。

图5 土壤和小蓬草根、叶细菌群落的NMDS分析图Fig.5 Nonmetric multidimensional scaling (NMDS) plots for the leaf,root,and soil bacteria communities associated with Conyza canadensis

表2 不同处理方式对小蓬草根和叶中细菌群落Beta多样性影响的Adonis分析结果
注:“**”、“*”分别表示在0.01、0.05水平上差异显著。
3 讨 论
小蓬草根样本细菌群落中OTU的数目最多,略高于土壤样本,明显高于小蓬草叶样本;细菌群落Alpha多样性却是土壤最高,其次是小蓬草根,小蓬草叶的细菌群落Alpha多样性最低。小蓬草细菌群落的Alpha多样性变化趋势与龙舌兰[29]、拟南芥[30]、Espeletiasp.[31]的微生物组研究结果一致,但OTU数目的结果却有差异。推测原因是本研究的样本包含了根表细菌,而上述研究均采用的表面除菌样本。土壤包含了大部分出现在根样本中的细菌OTU,根样本包含了大部分出现在叶样本中的细菌OTU,而土壤和叶的共有OTU数目更少。表明相邻的部位所共有的OTU数目越多,而且土壤是植物表面和内部微生物组的重要来源。随着取样部位靠近植物内部,植物对微生物的选择作用越来越强烈,微生物之间的竞争也越来越激烈,故多样性程度越低[32]。细菌群落中优势门包括变形菌门、放线菌门、拟杆菌门、酸杆菌门、厚壁菌门。由土壤到根再到叶,变形菌门和厚壁菌门相对丰度在增加,而酸杆菌门相对丰度在降低,这与其他植物的微生物组如水稻[22]、龙舌兰[29]、拟南芥[30]的研究结果类似。
研究发现,一些植物益生菌是小蓬草细菌群落中的优势菌属,可能会对小蓬草适应不良环境提供一定的帮助。例如鞘氨醇单胞菌属是很多植物的叶际优势菌属,能利用的底物十分广泛,具有较强的生物降解能力[33],某些种还能产生有价值的高分子物质如胡萝卜素等,可以为植物降解复杂有机物提供良好的帮助[34];通过对拟南芥研究发现,鞘氨醇单胞菌属有着很好的植物保护效应(plant-protective effect),能够抑制疾病症状,减少病原菌生长[35];根瘤菌属中的部分种具备较强的固氮能力,能够促进植物对氮源的吸收和利用;甲基杆菌属在自然界碳循环中有着重要的作用,有研究从3种番红花属的根瘤中分离出甲基杆菌属,且能在结瘤植物如猪屎豆(Crotalaria)中生存并具有固氮功能[36];链霉菌属中的部分种能产生葡萄糖异构酶,同时产生抗菌素;在豌豆(Pisumsativum)中发现一株寄生于根部的链霉菌(StreptomyceslydicusWYEC108),能通过特殊的途径增加根瘤产生的频率且增加根瘤大小,是一种自然产生的促豆类植物生长的微生物[36];假单胞菌属和芽孢杆菌属是土壤、植物中广泛存在的菌属,与植物联系紧密,部分种具有较强的溶磷能力,还能产生生长素(IAA)[37],如从美洲黑杨(Populusdeltoides)中分离出21株假单胞菌,其中大半接种至莴苣中均能表现促生机制[38]。
此外,研究还发现,是否进行冷冻干燥保存处理和采用不同的研磨方式对微生物群落组成的影响不是很明显,但是否进行表面消毒处理则影响较大。进行表面消毒处理和未进行表面消毒处理的小蓬草叶、根中细菌群落组成和多样性有明显的差异,未进行表面消毒处理的样本带有组织表面的微生物,因此其多样性明显高于表面消毒处理过的样本,表明小蓬草的根表和根内以及叶表和叶内的细菌群落存在明显的差异。在未进行表面消毒处理的小蓬草根中,存在大量广泛存在于土壤和腐烂的植物体内的链霉菌属,其含量是消毒处理过的小蓬草根的3倍。未进行表面消毒处理的小蓬草叶中存在大量类诺卡氏菌属,类卡诺氏菌属在土壤、水中广泛存在,在植物体内也有发现,但含量较低[39]。鞘氨醇单胞菌属也在未进行表面消毒处理的小蓬草叶中含量远高于表面消毒处理的小蓬草叶中含量。鞘氨醇单胞菌属在环境中无处不在,河水、地表、土壤中都有它们的踪迹,和甲基杆菌一同被认为是叶际常见的优势菌属[34-35]。
4 结 论
对小蓬草根、叶以及相关土壤细菌群落多样性的研究表明,小蓬草不同部位(根际、根和叶)的细菌群落多样性和组成有一定差异,其优势门、科、属与前人的研究结果类似。研究发现,小蓬草含有的一些优势菌属是植物益生菌,可能在一定程度上帮助宿主适应各种环境,如帮助宿主获取养分、改善土壤性质。该研究成果能为研究微生物在入侵植物中起到何种作用提供一定的数据支持,为防治生物入侵研究提供一定的帮助。此外,优势益生菌也是一种良好的生物资源,针对优势益生菌的进一步研究,将其投入到环境生物保护的应用中,能达到变害为宝的目的。
研究还发现,进行了表面消毒处理的小蓬草根和叶样本的细菌群落组成和多样性与未进行表面消毒处理的样本相比有明显的差异;而不同的研磨方式和冷冻干燥保存处理,对小蓬草根和叶细菌群落组成和多样性的研究结果并未产生明显的影响。该结论可为植物微生物组的相关研究提供指导。
