玉米Suwan种质改良过程中的关键基因组区段发掘
2019-04-03李秀诗吴文强刘鹏飞郭向阳王安贵祝云芳陈泽辉
李秀诗 吴 迅 吴文强 刘鹏飞 郭向阳 王安贵 祝云芳 陈泽辉
玉米Suwan种质改良过程中的关键基因组区段发掘
李秀诗 吴 迅 吴文强 刘鹏飞 郭向阳 王安贵 祝云芳 陈泽辉*
贵州省农业科学院旱粮研究所, 贵州贵阳 550006
玉米Suwan种质抗性好、适应性强、籽粒品质优, 在现代育种尤其是南方玉米育种中具有不可替代的作用。明确Suwan种质优良特性在改良过程中的遗传机制对我国南方玉米生态区的玉米生产具有重要意义。本研究以Suwan 1 (Suwan 1C10)及其衍生群体(苏兰1号C0)不同改良世代为材料, 利用包含5.6万个SNP标记的MaizeSNP50芯片对供试群体进行基因型鉴定。遗传分析发现: Suwan 1群体不同改良世代间的基因组差异片段较少, 仅出现5个, 其中4个出现在第11轮改良世代(Suwan 1 C11), 1个出现在第15轮改良世代(Suwan 1 C15); 苏兰1号不同改良世代间的基因组差异片段相对较多, 共有18个, 其中8个在不同改良世代间稳定遗传; Suwan种质改良形成苏兰1号群体的过程中, 共获得43个Lancaster特异性遗传片段, 其中35个在苏兰1号不同改良世代间稳定遗传。全基因组关联分析共鉴定出16个与穗行数显著关联的QTN, 分别位于第2、第3、第5、第6、第7、第8、第9染色体上, 其中SYN25713和SYN36577位于苏兰1号群体的Lancaster特异性遗传片段内; 共检测到13个控制穗长相关的QTN, 分别位于第1、第2、第5、第7、第8、第9染色体上, 其中PZE-105143697位于苏兰1号群体的Lancaster特异性遗传片段内。该结果为后续全基因组关联研究和分子标记辅助选择等提供了重要的理论依据。
玉米; 群体改良; 基因组特征; 全基因组关联分析; 遗传位点
Suwan 1群体是泰国Kasetsart大学通过引进和鉴定世界各地玉米种质, 筛选出36份综合性状优良的玉米材料, 在苏湾农场人工合成的热带玉米种质群体。该种质与巴西玉米群体及国际玉米小麦改良中心(CIMMYT)的热带晚熟群体配组均表现出较强的杂种优势, 因此被缅甸、中国、印度、马来西亚等国家引进和应用[1-2]。自Suwan 1群体引入中国后, 从中选育出了一批优良自交系如S37、T32、苏1611、QR273等, 在西南玉米生态区的育种及生产中具有极其重要的地位[3-4], 并组配出雅玉2号[5]、贵单8号[6]、金玉506[7]、会单4号[8]等优质玉米杂交种在我国西南区被大面积推广应用。
近年来, 随着高通量基因型鉴定技术的不断发展, 研究者从分子水平上解析了温带玉米种质的遗传基础。如兰进好等[9]利用黄早四和Mo17构建的F2:3群体, 基于SSR和ALFP标记鉴定出一批控制穗行数、行粒数、百粒重等性状的QTL; Wu等[10]利用包含56,110个SNP标记的基因芯片对367份重要自交系的遗传多样性、群体结构、亲缘关系等进行分析, 并结合全基因组关联分析策略共定位到158个与株型相关性状的SNP位点; Yang等[11]利用B73、SICAU1212及其F2群体, 结合SSR标记基因型进行连锁分析, 共定位到33个QTL与12个农艺性状相关。但是针对Suwan种质的遗传研究较少, 主要集中在表型数据或少数标记的配合力分析、杂种优势分析和群体结构分析等, 所揭示的信息量较为有限。如杨文鹏等[12]利用88个SSR标记对贵州2000年来审定的玉米品种70份亲本材料分析发现, 泰国苏湾热带种质被分为一个亚群, 揭示出贵州以地方亚热带种质和泰国苏湾热带种质为主要杂种优势群的玉米育种模式; 闫飞燕等[13]和番兴明等[14]对热带、亚热带玉米种质群体及自交系的配合力效应和杂种优势分析表明, Suwan 1群体及其衍生自交系具有较高的一般配合力, Suwan 1×Ried是表现较好的杂优模式之一; Zhang等[15]利用MaizeSNP50芯片对西南地区362份玉米自交系的群体结构和遗传多样性进行全基因组关联分析发现, 位于第2染色体130 Mb的一个区域遗传多样性较为丰富, 第7染色体30~120 Mb是S37在西南区玉米育种的一个保守区域; 陈泽辉等[16]利用属Reid自交系和属Tuxpeno自交系构建人工合成群体墨瑞1号, 用属Suwan自交系、Mo17和78599构建人工合成群体苏兰1号, 并利用半同胞相互轮回选择法进行改良, 通过田间鉴定发现Reid-Tuxpeno×Lancaster-Suwan 可作为我国南方玉米杂种优势利用的重要模式之一。然而, 关于Suwan种质改良的遗传基础以及在改良过程中是否存在一些重要遗传区段等研究则属于空白。因此, 本研究利用包含5.6万个标记的MaizeSNP50芯片对Suwan及其衍生群体(苏兰1号)不同改良世代进行基因型鉴定, 基于高密度的基因型鉴定结果分析Suwan及其衍生群体不同改良世代之间的基因组演化特征; 结合全基因组关联分析策略, 初步揭示Suwan种质改良过程中的关键遗传区段并明确其效应, 为玉米Suwan种质改良利用和后续分子标记辅助育种提供参考。
1 材料与方法
1.1 试验材料
以玉米种质群体Suwan 1 (Suwan 1 C10)、苏兰1号的不同改良世代为材料。其中, Suwan 1群体的第11轮(C11)是贵州省农业科学院旱粮研究所1992年从泰国的苏湾农场引进; 而Suwan 1群体的不同改良世代[第10轮(C10)、第12轮(C12)、第13轮(C13)、第15轮(C15)]则是课题组2014年从苏湾农场引进; 苏兰1号(SL1C0)是由苏湾种质与Lancaster种质的优良自交系的人工合成群体, 并通过3次半同胞相互轮回选择法获得SL1C1、SL1C2、SL1C3三轮改良世代[16]。供试材料系谱来源和类群见表1。
1.2 试验方法
1.2.1 田间鉴定 2017年春, 将Suwan 1及4个改良世代、苏兰1号及其3轮改良世代分别在贵州贵阳(26.33°N, 106.64°E)、贵州大方(26.98°N, 105.66°E)和云南罗平(24.78°N, 104°E) 3个不同环境下进行田间鉴定。采用完全随机区组设计, 3次重复, 2行区, 行长5 m, 行距0.7 m, 每行定苗22株。按照常规生产条件进行田间管理。参照石云素等编写的《玉米种质资源描述规范和数据标准》调查表型[17], 即收获后, 从每个小区随机取10个果穗调查穗长、穗行数, 取平均值用于统计分析。

表1 供试材料系谱和类群
Suwan-Lancaster 1简写为“SL1”。Suwan-Lancaster 1 is abbreviated as "SL1".
1.2.2 基因型鉴定 2016年冬, 在海南省三亚市九所镇贵州南繁基地从Suwan 1及其衍生群体各改良世代中取样。即在玉米大喇叭口时期, 首先依据植株高度将每个群体分为高、中、低3种类型, 从每种类型中取30株幼嫩叶片等量混合和提取DNA, 并采用Illumina公司开发的MaizeSNP50芯片对所取样本进行基因型鉴定, 该芯片包括56,110个SNP标记。参照Illumina 公司提供的操作指南检测基因型。其中DNA提取和基因型鉴定工作均委托北京康普森生物科技有限公司完成。
1.3 表型数据统计分析
采用Microsoft Excel 2007和SAS 9.2软件[18]的PROC UNIVARIATE和PROC GLM程序对田间统计数据进行描述性统计和方差分析等。
1.4 候选遗传区段鉴定
基于不同世代的基因型鉴定结果, 通过全基因组比较, 利用GGT32软件鉴定出在各改良世代间稳定遗传和差异的候选区域。
1.5 全基因组关联分析
根据最小等位基因频率MAF > 0.05且样本缺失率< 20%的标准[19], 筛选出43,980个高质量的SNP标记, 利用TASSEL软件的混合线性模型[20]对表型和基因型进行全基因组关联分析。以< 0.0001为阈值, 鉴定出控制目标性状的关键QTN。在此基础上, 利用生物信息分析手段, 借助公共数据库的定位结果, 初步揭示出目标区段的遗传效应。
2 结果与分析
2.1 穗长和穗行数分析
随着改良轮次的增加, 苏兰1号群体的穗长增加, 从改良前的17.67 cm增长到改良后的18.27 cm, 明显高于Suwan 1群体(17.22 cm); 穗行数性状变化较小, 但各世代间存在着明显差异。供试群体在贵阳、大方和罗平3个点的穗长性状的平均值分别为17.56、18.65和17.06 cm, 变异系数分别为6.21%、3.91%和4.92%; 穗行数性状的平均值分别为15.07、14.93和14.45行, 变异系数分别为4.45%、2.82%和4.50% (表2), 说明Suwan 1及其衍生群体各改良世代间穗长和穗行数差异明显。
2.2 基因组特征
在Suwan 1群体的不同改良世代中, 共鉴定出9个稳定遗传片段和5个差异遗传片段(图1)。说明Suwan 1群体在改良过程中, 保持着群体内丰富的遗传变异, 其不同改良世代间基因发生交换重组的频率较低, 仅出现5个差异遗传片段, 其中4个出现在第11轮改良世代(Suwan 1 C11), 1个出现在第15轮改良世代(Suwan 1 C15), 其原因是Suwan 1 C11的引入时间较早, 与其他改良世代批次不同, 受到环境驯化和选择发生基因漂移, 而且这9个稳定遗传片段可能在保持Suwan群体优势抗性、适应性等热带种质特征方面发挥作用。而其中的5个差异遗传区段可能是Suwan种质改良过程中的重组热点区域, 可为后续的种质改良提供依据。
在苏兰1号C0群体不同改良世代中, 共鉴定出26个稳定遗传片段和18个差异遗传片段(图2), 分别位于第1、第2、第3、第4、第5、第6、第7、第9染色体上。其中, 第2、第5、第6染色体上的8个差异遗传片段在其改良世代间稳定出现, 以第2染色体上的多态性最高。说明苏兰1号群体在改良过程中, 不同改良世代间保持着群体内丰富的遗传变异, 少数基因发生交换重组, 获得18个差异遗传片段, 而且这些差异遗传区段可能与苏兰1号群体改良世代间秃尖长、行粒数等产量性状特征方面发挥作用, 可为后续利用分子标记辅助育种提供重要依据。
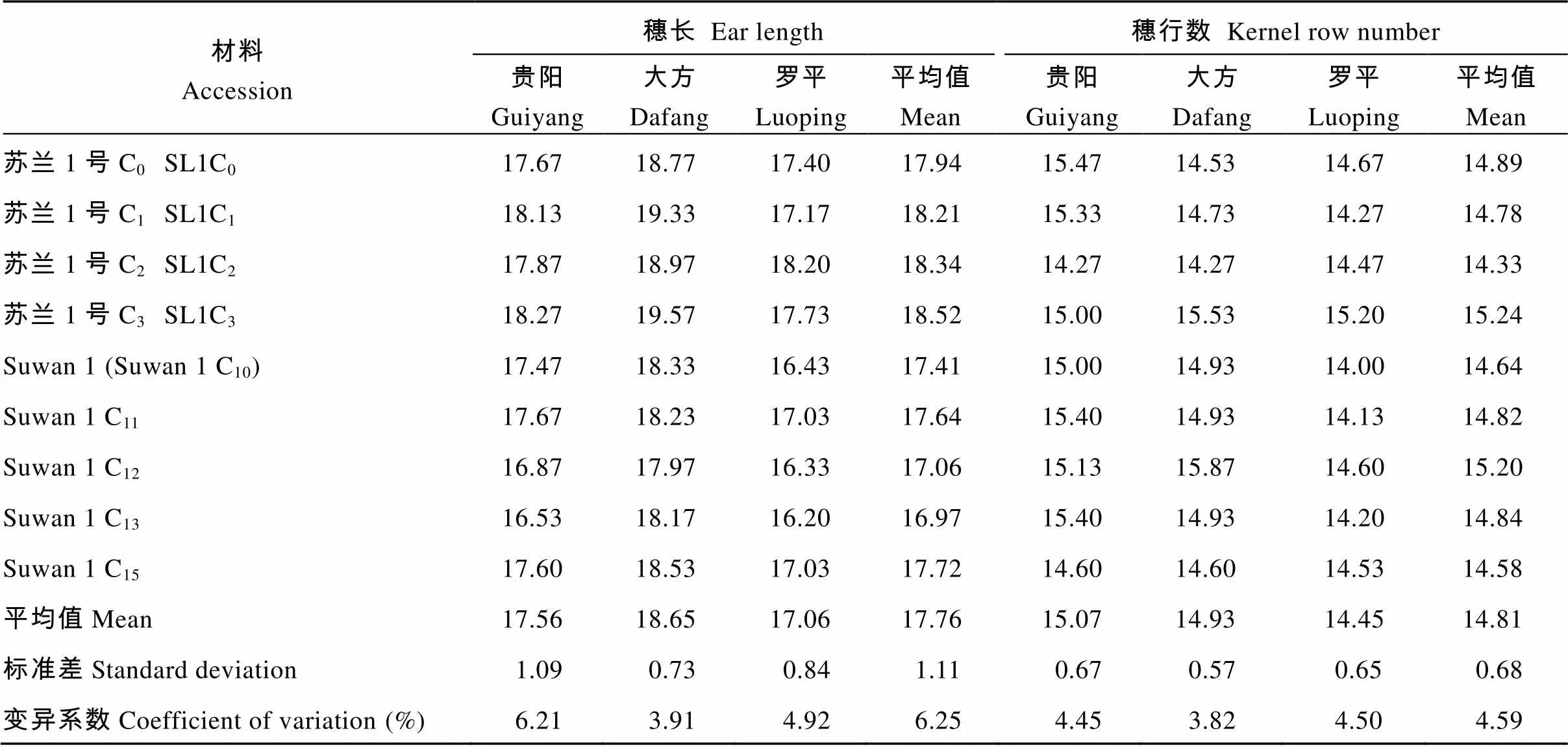
表2 9个供试群体穗长和穗行数
Suwan-Lancaster 1简写为“SL1”。Suwan-Lancaster 1 is abbreviated as “SL1”.
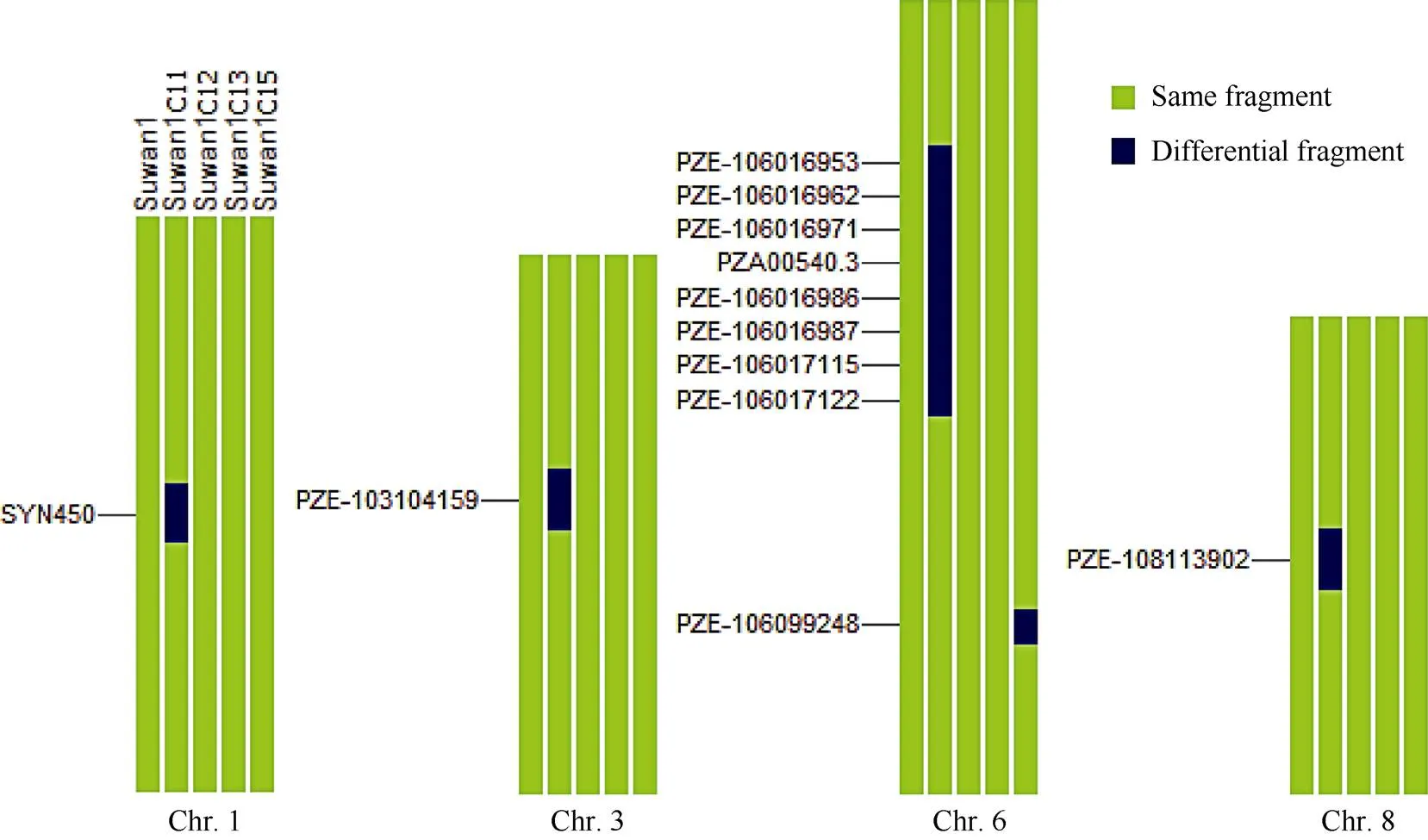
图1 Suwan 1群体不同改良世代间的基因组特征
特异性SNP标记在染色体上的物理位置见附表1。
The physical location of the specific SNP markers on chromosome is shown in the Supplementary table 1.
基因组信息比对发现, Suwan种质改良形成苏兰1号群体的过程中, 共有53个区段来自Suwan群体和43个区段来自Lancaster种质(图3), 其中有35个Lancaster来源区段在苏兰1号C0群体不同改良世代间稳定出现, 分别位于第1、第3、第4、第5染色体, 说明这些区域发生交换重组的频率较高, 多态性较丰富。
2.3 全基因组关联分析
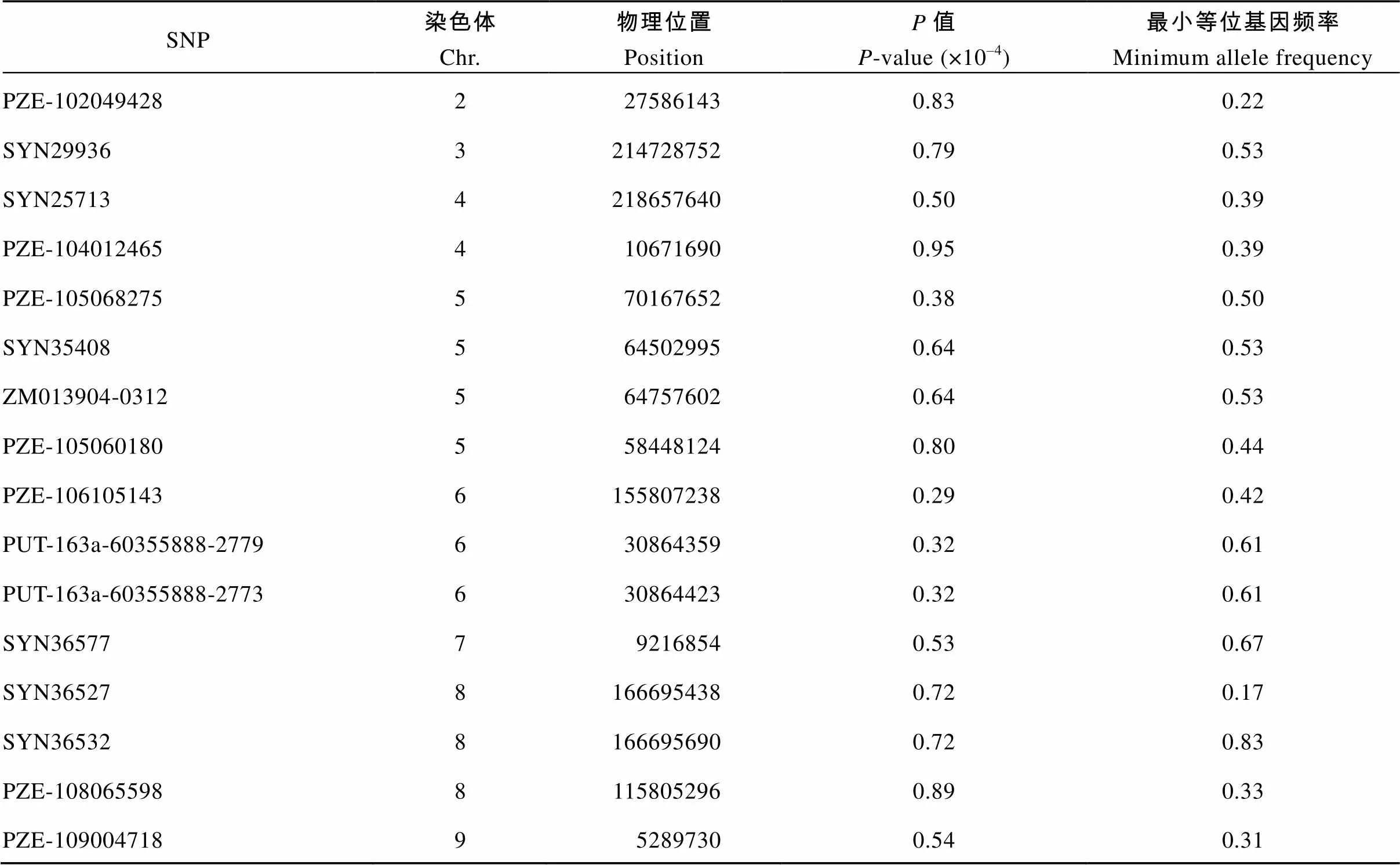
共发掘出16个与穗行数显著关联(<0.0001)的QTN (表3和图4), 分别位于第2、第3、第5、第6、第7、第8、第9染色体上, 其中SYN25713和SYN36577分别位于苏兰1号群体的第4染色体Lancaster特异性遗传区段212.79~243.52 Mb和第7染色体8.19~15.78 Mb范围内(附表3)。
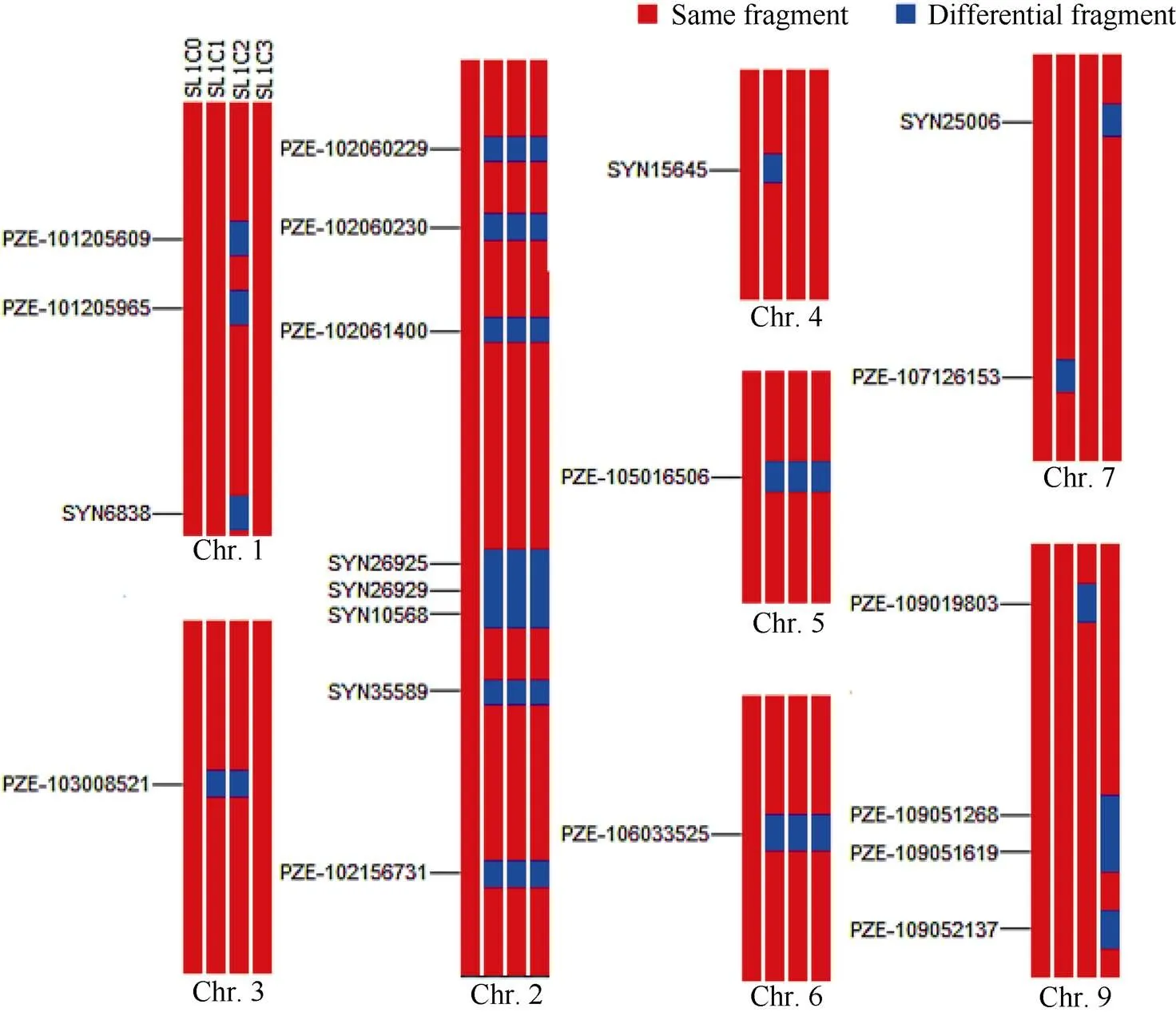
图2 苏兰1号群体不同改良世代间的基因组特征
特异性SNP标记在染色体上的物理位置见附表2。
The physical location of the specific SNP markers on chromosome is shown in Supplementary table 2.
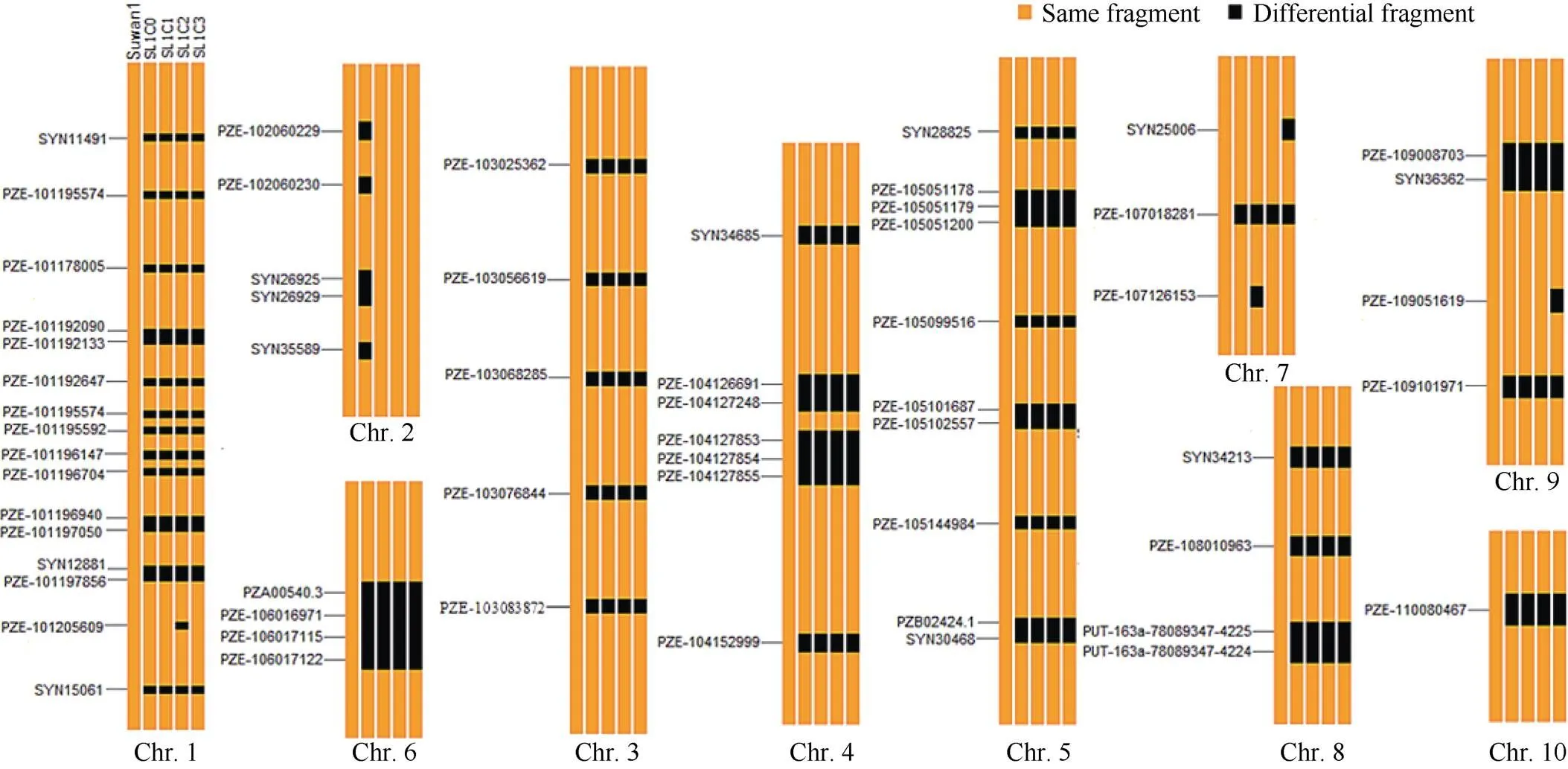
图3 Suwan 1与苏兰1号不同改良世代间的基因组特征
特异性SNP标记在染色体上的物理位置见附表3。
The physical location of the specific SNP markers on chromosome is shown in Supplementary table 3.

图4 穗行数相关QTN
A和B分别代表曼哈顿图和QQ图。A and B represent Manhattan plot and QQ plot, respectively.
穗长关联分析结果显示,共发掘出13个与穗长显著关联(< 0.001)的SNP位点(表4和图5),分别位于第1、第2、第5、第7、第8、第9染色体上,其中PZE-105143697 (196993540)位于苏兰1号群体的第5染色体Lancaster特异性遗传区段157.32~ 197.94 Mb范围内(附表3)。
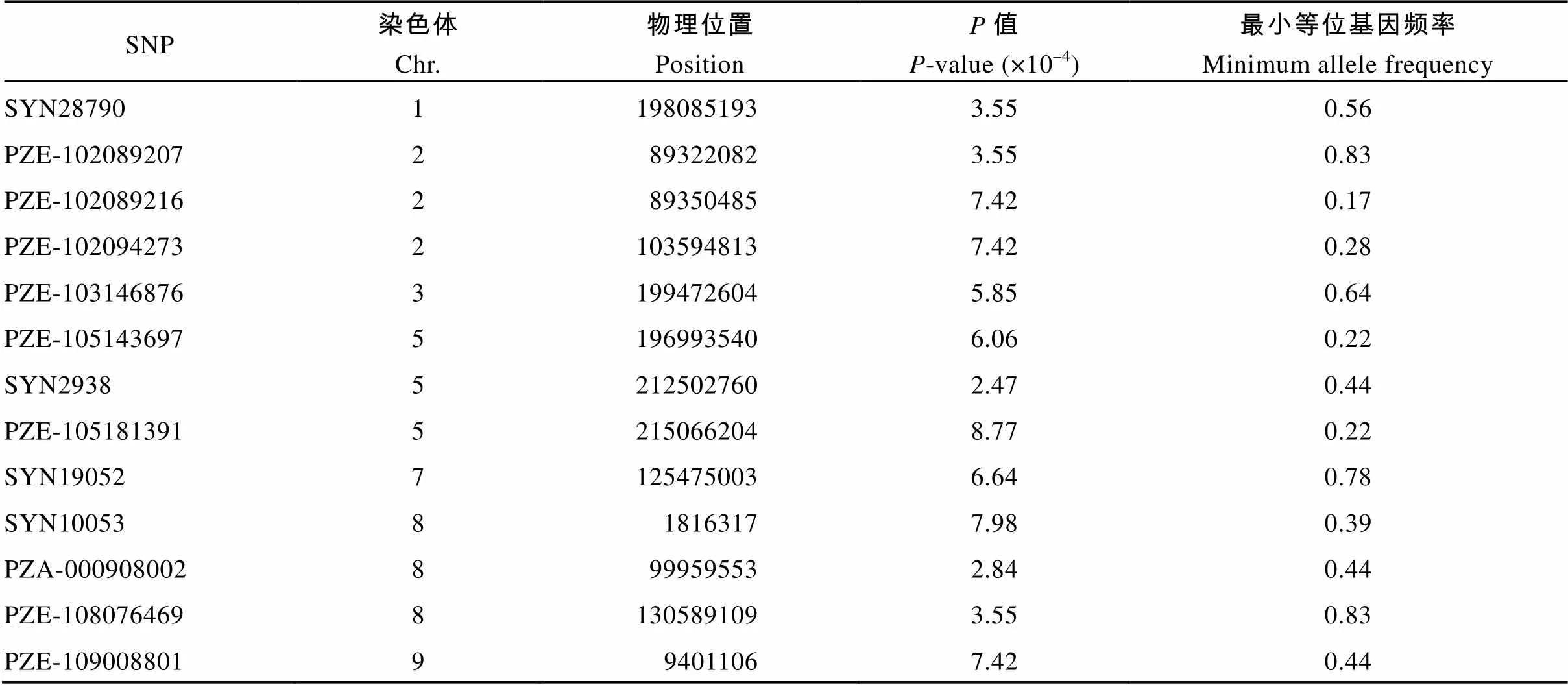
表4 穗长显著关联的SNP位点
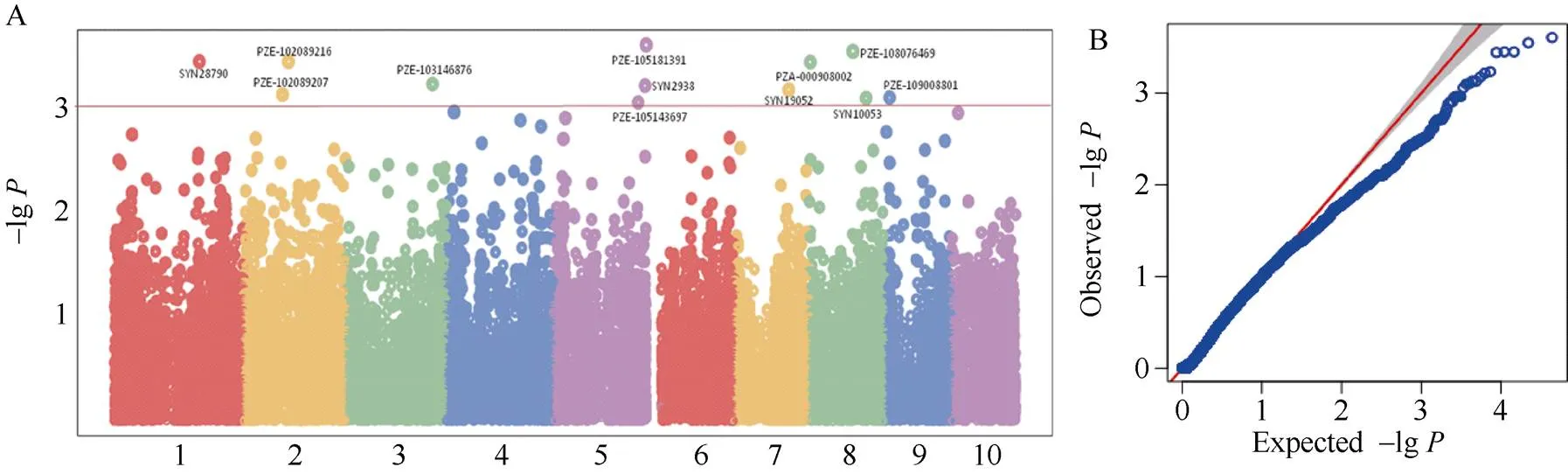
图5 穗长相关QTN
A和B分别代表曼哈顿图和QQ图。A and B represent Manhattan plot and QQ plot, respectively.
3 讨论
3.1 Suwan种质改良过程中的一些重要区段
群体改良是一种打破有利基因与不利基因连锁, 使有利基因频率得到提高, 从而改良玉米育种材料的过程[1,21]。如雍红军等[22]以辽旅综、中综3号、BSCB1等10个玉米群体改良杂交种吉单261的育种利用发现, 供试群体具有改良杂交种性状的利用价值, 能提高杂交种产量和穗行数的潜力; 贵州省农业科学院将Lancaster种质导入Suwan种质形成苏兰1号群体, 与墨瑞1号群体进行半同胞相互轮回选择改良后, 形成新一轮改良群体组配群体杂交组合, 通过田间鉴定表明, 墨瑞1号C1×苏兰1号C1比墨瑞1号C0×苏兰1号C0的产量提高7.84%,群体间的平均杂种优势也从改良前的9.86%提高到改良后的16.29%[16]。李芦江等[23]研究5轮控制双亲混合选择对2个玉米人工合成窄基群体P3C0和P4C0的改良效果发现, 控制双亲混合选择对群体单株产量和主要构成性状及其一般配合力(GCA)改良效果明显, 多数性状及其GCA均大于C0, 但是当选择响应到达最大以后, 持续改良会使群体的选择增益下降, 甚至出现负增益。说明群体在改良过程中, 其农艺性状会随着改良轮次的增加呈现出不同的改良效应。
本研究结果表明, 群体在改良过程中, 保持着群体内丰富的遗传变异, 不同改良世代间有少数基因发生交换重组, 其中在Suwan 1群体的改良世代中仅获得5个差异遗传片段, 苏兰1号C0群体改良世代中共获得18个差异遗传区段, 有8个在其不同改良世代间稳定出现。另外, Suwan种质改良形成苏兰1号群体的过程中, 共获得53个来自Suwan群体的稳定遗传区段和43个来自Lancaster的差异遗传区段, 而且有35个差异遗传片段在苏兰1号C0群体及其改良世代间稳定出现。说明这些Suwan来源的稳定遗传区段可能在保持Suwan种质优势性状方面发挥作用, 所以在育种选择中被保留下来, 而Lancaster来源的差异遗传区段则可能在改良Suwan种质生育期长、株高等性状缺点方面起作用。这些研究结果从分子水平上解释了苏兰1号群体在育种和生产中应用与Suwan种质存在差异的原因, 也为后续Suwan 1及其衍生群体(苏兰1号)的改良利用提供了一定的理论支撑。
3.2 Suwan群体改良过程中候选区段的效应
本研究共发掘出16个与穗行数显著关联的QTN位点, 分别位于第2、第3、第5、第6、第7、第8、第9染色体上, 其中有2个位点(SYN25713和SYN36577)位于苏兰1号群体的Lancaster来源的遗传区段内; 发掘出13个与穗长显著相关联的QTN位点, 分别位于第1、第2、第5、第7、第8、第9染色体上, 有1个位点(PZE-105143697)位于Lancaster来源的特异性遗传区段内, 研究这些位点对理解玉米Suwan种质遗传机制有重要作用。与前人研究结果的比较发现, Lu等[24]利用B73/丹340的F2群体进行QTL定位, 在第4染色体上检测到(umc1294–bnlg1265)和(umc2188–umc1101), 与本文第4染色体上发掘出的2个穗行数QTN (PZE-104012465和SYN25713)位于同一位置, 这一结果与Yan等[25]的定位结果相一致。王辉等[26]利用郑58/HD568构建重组自交系群体进行QTL定位, 检测到(198.52~201.32 Mb)和(211.08~ 219.99 Mb)与本文在第3染色体发掘出的穗长SNP标记PZE-103146876 (199472604)和第4染色体发掘出的穗行数SNP标记 SYN25713 (218657640)位于同一染色体区段的位点; Zhou等[27]利用掖478/ SL17-1构建群体进行QTL定位, 在第7染色体上定位到多效性(umc1393–bnlg657)与本文在第7染色体发掘出的穗长SNP标记SYN19052 (125475003)所在标记区间一致。说明在这些区段内含有控制相关性状的基因位点且可靠性较高, 该区域在玉米产量相关性状改良过程中起到一定作用, 可以作为今后精细定位的候选区域。
4 结论
在Suwan种质改良形成苏兰1号群体的过程中, 共发现53个Suwan来源的稳定遗传区段和43个Lancaster来源的差异遗传区段, 这些区段内存在控制穗行数和穗长的QTN, 对于保持各自优势性状具有重要意义。该研究结果将为Suwan种质改良过程中的优势基因聚合提供很好的借鉴。
[1] 陈泽辉. 贵州玉米育种. 贵阳: 贵州科技出版社, 2011. pp 100–130. Chen Z H. Maize Breeding in Guizhou. Guiyang: Guizhou Science and Technology Publishing House, 2011. pp 100–130 (in Chinese).
[2] Vasal S K, Srinivasan G, Crossa J, Beck D L. Heterosis and combining ability of CIMMYT's subtropical and temperate early- maturity maize germplasm., 1992, 32: 884–890.
[3] 陈泽辉, 祝云芳, 王安贵, 郭向阳, 邬成. 玉米Tuxpeno和Suwan种质的改良研究. 贵州农业科学, 2010, 38(2): 1–4. Chen Z H, Zhu Y F, Wang A G, Guo X Y, Wu C. Improvement of Tuxpeno and Suwan germplasm in maize., 2010, 38(2): 1–4 (in Chinese with English abstract).
[4] 陈泽辉, 高翔, 祝云芳. Suwan与我国四大玉米种质的配合力和杂种优势分析. 玉米科学, 2005, 13(1): 5–9. Chen Z H, Gao X, Zhu Y F. Study on the combining ability and heterosis between Suwan and four major maize germplasm of China.2005, 13(1): 5–9 (in Chinese with English abstract).
[5] 胡学爱. 玉米新品种——雅玉2号. 农业科技通讯, 1993, (8): 39. Hu X A. New maize cultivars—Yayu No.2., 1993, (8): 39 (in Chinese).
[6] 柏光晓, 任洪. 适宜西南山区的高产优质多抗玉米杂交种贵单8号选育研究. 玉米科学, 2007, 15(增刊1): 27–29. Bai G X, Ren H. Breeding study of high yield, good quality and high resistance corn hybrid vareity Guidan No.8., 2007, 15(suppl 1): 27–29 (in Chinese with English abstract).
[7] 祝云芳, 陈泽辉, 任洪, 王安贵, 郭向阳. 国审玉米新品种金玉506的选育及应用. 农业科技通讯, 2014, (9): 176–178. Zhu Y F, Chen Z H, Ren H, Wang A G, Guo X Y. Breeding and application of a new country trial maize cultivars Jinyu 506., 2014, (9): 176–178 (in Chinese).
[8] 黄吉美. 会单4号制种技术. 作物杂志, 1996, (1): 12. Huang J M. Seed production technology of Huidan No. 4., 1996, (1): 12 (in Chinese).
[9] 兰进好, 李新海, 高树仁, 张宝石, 张世煌. 不同生态环境下玉米产量性状QTL分析. 作物学报, 2005, 31: 1253–1259. Lan J H, Li X H, Gao S R, Zhang B S, Zhang S H. QTL analysis of yield components in maize under different environments., 2005, 31: 1253–1259 (in Chinese with English abstract).
[10] 吴迅. 玉米重要自交系的遗传特征鉴定与株型性状关联分析. 四川农业大学博士学位论文, 四川成都, 2013. Wu X. Genetic Characterization of Important Maize Inbred Lines and Association Mapping of Plant Architecture-related Traits. PhD Dissertation of Sichuan Agricultural University, Chengdu, Sichuan, China, 2013 (in Chinese with English abstract).
[11] Yang C, Liu J, Rong T Z. Detection of quantitative trait loci for ear row number in F2populations of maize.2015, 14: 14229.
[12] 杨文鹏, 关琦, 杨留启, 王伟, 张文龙, 祝云芳, 潘敏娜, 沈建华, 赵致. 贵州70份玉米自交系的SSR标记遗传多样性及其杂种优势群分析. 植物遗传资源学报, 2011, 12: 241–248. Yang W P, Guan Q, Yang L Q, Wang W, Zhang W L, Zhu Y F, Pan M N, Shen J H, Zhao Z. Genetic diversity and heterotic group of 70 maize inbred lines in Guizhou by SSR marker., 2011, 12: 241–248 (in Chinese with English abstract).
[13] 闫飞燕, 范继征, 周锦国, 程伟东, 石达金, 钟昌松, 覃兰秋, 孔祥林. 12个不同玉米热带种质比例群体的产量配合力效应及杂种优势分析. 西南农业学报, 2011, 24: 471–477. Yan F Y, Fan J Z, Zhou J G, Cheng W D, Shi D J, Zhong C S, Qin L Q, Kong X L. Combining ability and heterosis of 12 different kinds of tropic maize populations., 2011, 24: 471–477 (in Chinese with English abstract).
[14] 番兴明, 谭静, 杨峻芸, 刘峰, 黄必华, 黄云霄. 外来热带、亚热带玉米自交系与温带玉米自交系产量配合力分析及其遗传关系的研究. 中国农业科学, 2002, 35: 743–749. Fan X M, Tan J, Yang J Y, Liu F, Huang B H, Huang Y X. Study on yield combining ability and genetic relationship between exotic tropical, subtropical maize inbreds and domestic temperate inbreds., 2002, 35: 743–749 (in Chinese with English abstract).
[15] Zhang X, Zhang H, Li L J, Lan H, Ren Z Y, Liu D, Wu L, Liu H L, Jaqueth J, Li B L, Pan G T, Gao S B. Characterizing the population structure and genetic diversity of maize breeding germplasm in Southwest China using genome-wide SNP markers., 2016, 17: 697.
[16] 陈泽辉, 祝云芳, 王安贵, 郭向阳, 赵丽, 胡兴. 玉米Tuxpeno-Reid和Suwan-Lancaster合成群体相互轮回选择效果及杂种优势研究. 玉米科学, 2013, (4): 1–5. Chen Z H, Zhu Y F, Wang A G, Guo X Y, Zhao L, Hu X. Two maize populations of Tuxpeno-Reid and Suwan-Lancaster by reciprocal recurrent selection and the heterosis., 2013, (4): 1–5 (in Chinese with English abstract).
[17] 石云素. 玉米种质资源描述规范和数据标准. 中国农业出版社, 2006. p 62. Shi Y S. Descriptors and Data Standard for Maize (L.). Beijing: China Agriculture Press, 2006. p 62 (in Chinese).
[18] Publishing S. Base SAS 9.2 Procedures Guide: Statistical Procedures. SAS Publishing, 2008.
[19] Wu X, Li Y, Shi Y, Song Y, Wang T, Huang Y, Li Y. Fine genetic characterization of elite maize germplasm using high-throughput SNP genotyping., 2014, 127: 621–631.
[20] Bradbury P J, Zhang Z, Kroon D E, Casstevens T M, Ramdoss Y, Buckler E S. TASSEL: software for association mapping of complex traits in diverse samples., 2007, 23: 2633–2635.
[21] 陈泽辉. 群体与数量遗传学. 贵阳: 贵州科技出版社, 2009. pp 28–53. Chen Z H. Population and Quantitative Genetics. Guiyang: Guizhou Science and Technology Publishing House,2009. pp 28–53 (in Chinese).
[22] 雍洪军, 张芳军, 张德贵, 张晓聪, 李明顺, 潘光堂, 张世煌,
李新海, 荣廷昭. 10个玉米群体改良杂交种吉单261的育种利用分析. 核农学报, 2014, 28: 765–771. Yong H J, Zhang F J, Zhang D G, Zhang X C, Li M S, Pan G T, Zhang S H, Li X H, Rong Y Z. Analysis on breeding potential of ten populations to improve a Chinese maize hybrid ‘Jidan 261’., 2014, 28: 765–771 (in Chinese with English abstract).
[23] 李芦江, 陈文生, 杨克诚, 潘光堂, 荣廷昭. 控制双亲混合选择对2个玉米窄基群体主要性状的改良效果. 中国农业科学, 2010, 43: 4775–4786. Li L J, Chen W S, Yang K C, Pan G T, Rong T Z. Effects of biparental mass selection on two narrow-base maize populations., 2010, 43: 4775–4786 (in Chinese with English abstract).
[24] Lu M, Xie C X, Li X H, Hao Z F, Li M S, Weng J F, Zhang D G, Bai L, Zhang S H. Mapping of quantitative trait loci for kernel row number in maize across seven environments., 2011, 28: 143–152.
[25] Yan J B, Tang H, Huang Y Q, Zheng Y L, Li J S. Quantitative trait loci mapping and epistatic analysis for grain yield and yield components using molecular markers with an elite maize hybrid., 2006, 149: 121–131.
[26] 王辉, 梁前进, 胡小娇, 李坤, 黄长玲, 王琪, 何文昭, 王红武, 刘志芳. 不同密度下玉米穗部性状的QTL分析. 作物学报, 2016, 42: 1592–1600. Wang H, Liang Q J, Hu X J, Li K, Huang C L, Wang Q, He W Z, Wang H W, Liu Z F. QTL mapping for ear architectural traits under three plant densities in maize., 2016, 42: 1592–1600 (in Chinese with English abstract).
[27] Zhou G, Zhu Q, Yang G, Huang J, Cheng S, Yue B, Zhang Z.is a pleiotropic QTL for kernel number per row, ear length and ear weight in maize (L.)., 2015, 203: 429–436.
附表1 Suwan 1群体不同改良世代的特异性标记
Supplementary table 1 Specific markers for different improvement generations of Suwan 1 population
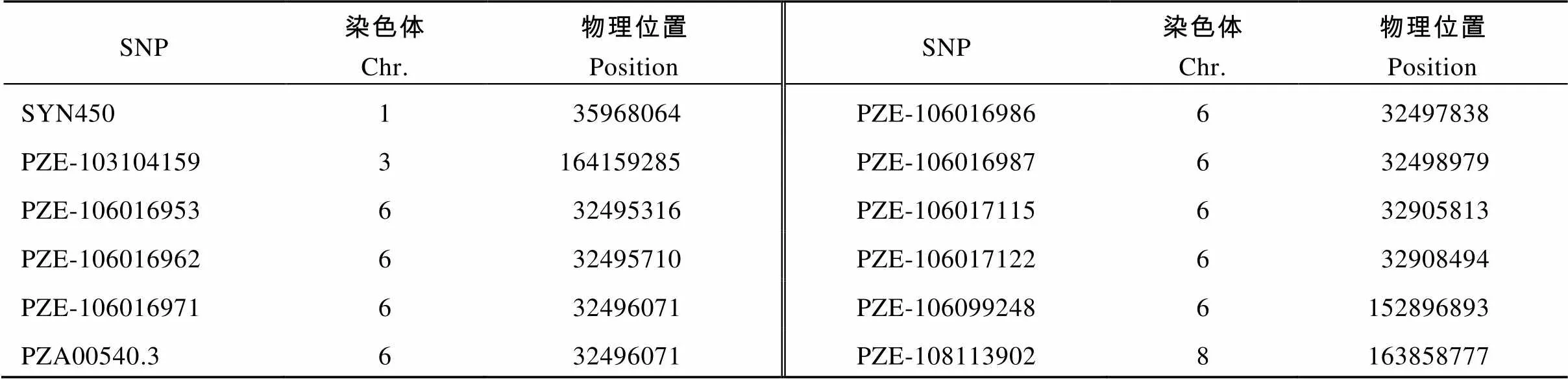
SNP染色体Chr.物理位置PositionSNP染色体Chr.物理位置Position SYN450135968064PZE-106016986632497838 PZE-1031041593164159285PZE-106016987632498979 PZE-106016953632495316PZE-106017115632905813 PZE-106016962632495710PZE-106017122632908494 PZE-106016971632496071PZE-1060992486152896893 PZA00540.3632496071PZE-1081139028163858777
附表2 苏兰1号群体不同改良世代的特异性标记
Supplementary table 2 Specific markers for different improvement generations of Suwan-Lancaster 1 population
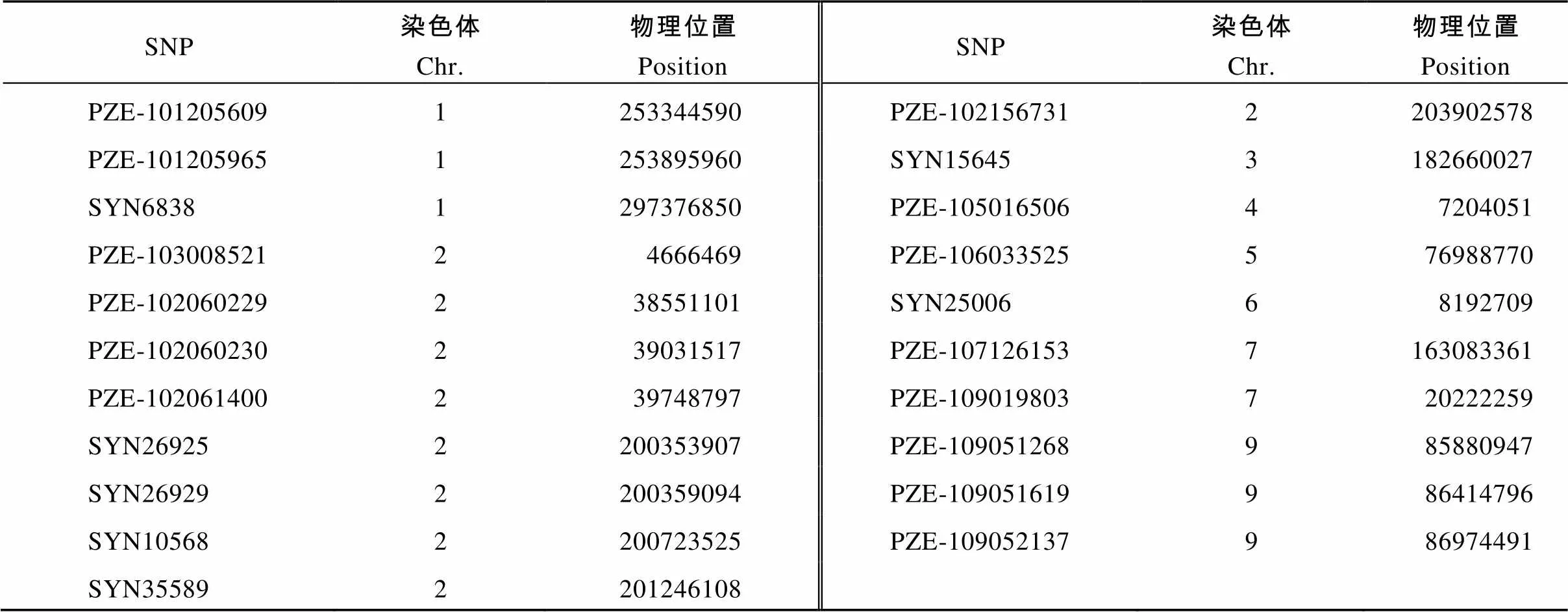
SNP染色体Chr.物理位置PositionSNP染色体Chr.物理位置Position PZE-1012056091253344590PZE-1021567312203902578 PZE-1012059651253895960SYN156453182660027 SYN68381297376850PZE-10501650647204051 PZE-10300852124666469PZE-106033525576988770 PZE-102060229238551101SYN2500668192709 PZE-102060230239031517PZE-1071261537163083361 PZE-102061400239748797PZE-109019803720222259 SYN269252200353907PZE-109051268985880947 SYN269292200359094PZE-109051619986414796 SYN105682200723525PZE-109052137986974491 SYN355892201246108
附表3 Suwan 1与苏兰1号不同改良世代间的特异性标记
Supplementary table 3 Specific markers between Suwan 1 and Suwan-Lancaster 1 in different improved generations

SNP染色体Chr.物理位置PositionSNP染色体Chr.物理位置Position SYN1149113683507PZE-1041278544212788677 PZE-101054452138617583PZE-1041278554212788991 PZE-1011780051222370910PZE-1041529994243521349 PZE-1011920901237838603SYN2882557319620 PZE-1011921331237900682PZE-105051178543960922 PZE-1011926471238680213PZE-105051179543961044 PZE-1011955741242361972PZE-105051200543966297 PZE-1011955921242398910PZE-1050995165146942464 PZE-1011961471243255282PZE-1051016875152095801 PZE-1011967041244083020PZE-1051025575154315332 PZE-1011969401244512792PZE-1051449845197943057 PZE-1011970501244678601PZB02424.15199531408 SYN128811245242156SYN304685199531778 PZE-1011978561245308899PZA00540.3632496071 SYN150611261370341PZE-106016971632496071 PZE-102060229238551101PZE-106017115632905813 PZE-102060230239031517PZE-106017122632908494 SYN269252200353907SYN2500678192709 SYN269292200359094PZE-107018281715776884 SYN355892201246108PZE-1071261537163083361 PZE-103025362317738644SYN3421385090046 PZE-103056619368433447PZE-108010963811645850 PZE-1030682853108233400PUT-163a-78089347-42258169951365 PZE-1030768443123683053PUT-163a-78089347-42248169951478 PZE-1030838723135004208PZE-10900870399247324 SYN346854202660380SYN3636299247324 PZE-1041266914210495187PZE-109051619986414796 PZE-1041272484211708774PZE-1091019719141650742 PZE-1041278534212785374PZE-11008046710134211006
Excavation of main candidate genome regions in Suwan germplasm improvement process of maize
LI Xiu-Shi, WU Xun, WU Wen-Qiang, LIU Peng-Fei, GUO Xiang-Yang, WANG An-Gui, ZHU Yun-Fang, and CHEN Ze-Hui*
Upland Crops Institute, Guizhou Academy of Agricultural Sciences, Guiyang 550006, Guizhou, China
Suwan germplasm with good resistance, strong adaptability and excellent grain quality has played an irreplaceable role in modern breeding, especially in the southern of China. It is important to clarify the genetic mechanism of Suwan germplasm. In this study, modified generations of Suwan 1 (Suwan 1 C10) and its derived population (Suwan-Lancaster 1 C0) were used to be genotyped by using MaizeSNP50 chips containing about 56,000 SNP markers. There was a smaller genome differences among different improved generations for Suwan 1 population, with only five different inherited fragments identified, among which four appeared only in the 11th improved generation (Suwan 1 C11), one appeared only in the 15th improved generation (Suwan 1 C15). For Suwan-Lancaster1 population, among 18 different genetic fragments eight were stably inherited in different improved generations. A total of 43 specific genetic segments of Lancaster germplasm were obtained, among them 35 were stably inherited in different improved generations. Genome-wide association studies (GWAS) showed that 16 QTNs significantly associated with kernel row number were located on chromosomes 2, 3, 5, 6, 7, 8, and 9, respectively, among them SYN25713 and SYN36577 were located in the Lancaster specific genetic fragment of the Suwan-Lancaster 1 population. A total of 13 QTNs related to ear length were located on chromosomes 1, 2, 5, 7, 8, and 9, respectively, among them PZE-105143697 was located in the Lancaster specific genetic fragment. These results provide an important theoretical basis for the subsequent genome-wide association study and molecular marker assisted selection.
maize; population improvement; genome characteristics; genome-wide association study; genetic loci
2018-06-26;
2018-12-24;
2019-01-04.
10.3724/SP.J.1006.2019.83052
陈泽辉, E-mail: chenzh907@sina.com
E-mail: xsli1125@163.com
本研究由国家“七大作物育种”专项(2016YFD0101206-4), 黔农科院自主创新科研专项字(2014)006, 国家自然科学基金项目(31760387), 黔科合支撑[2016]2605, [2016]2549, [2017]2507, [2018]2296和黔科合基础[2017]1413资助。
This study was supported by the National Key Research and Development Program of China (2016YFD0101206), the Innovation Program of QAAS (Special Character of Independent Innovation of Guizhou Academy of Agriculture [2014]006), the National Natural Science Foundation of China (31760387), the Science and Technology Support Project of Guizhou Province (Qiankehe support [2016]2605, [2016]2549, [2017]2507, and [2018]2296), the Science and Technology Project of Guizhou Province (Qiankehe Foundation) [2017]1413.
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20181230.0843.002.html
