原发性肺腺癌乳腺转移2例报道及文献复习
2019-04-03段丽群毕建平黎艳萍张用王明伟孙文佳胡德胜皮国良
段丽群,毕建平,黎艳萍,张用,王明伟,孙文佳,胡德胜,皮国良
0 引言
原发性肺癌发病率与死亡率逐年上升,远处转移最常见的转移部位依次为肺、肝、肾上腺、脑、骨等。乳腺是原发性肺癌罕见的转移部位,因此,乳腺的转移病灶易被误诊为原发性乳腺癌。肺腺癌乳腺转移和原发性乳腺癌,癌细胞的形态学上均为腺癌细胞,最主要的鉴别手段仍然为病理学检查[1-3]。TTF-1、Napsin-A是诊断原发性和转移性肺腺癌最有价值的特异性抗体,而ER、PR、GATA-3、GCDFP-15的表达在诊断原发性和转移性乳腺癌中有重要的意义[2]。本研究报道经病理证实的2例原发性肺腺癌乳腺转移患者的临床资料,总结肺腺癌乳腺转移的临床病理、治疗及预后的特征,避免误诊误治,给患者更合理的治疗。
1 临床资料
患者1,56岁,女性,无吸烟史,2013年9月底外院体检发现左肺肿块并行穿刺活检,2013年10月初就诊我院,会诊外院肺部肿瘤活检组织切片示腺癌,免疫组织化学为:TTF-1(+)、CK7(+)、Napsin A(+)、P63(弱+)、CK5/6(-)、CD56(-)、CgA(-)、Ki-67(Li: 10%)。肺部肿瘤组织未行EGFR基因检测。完善检查后诊断为左肺腺癌肝转移,见图1A。在经过4周期PP方案化疗后,肺部及肝脏病灶进展,2014年3月出现右乳无痛性肿块,胸部CT显示右乳外上象限单个、圆形、密度均匀、大小1.5 cm×2 cm、边界不规则肿块,不伴腋窝淋巴结肿大,见图1B。之后行右乳单纯肿块切除,病理示:低分化癌浸润,免疫组织化学显示:ER(-)、PR(-)、CK7(-)、CK20(-)、TTF-1(+)、Napsin A(+)、GCDFP-15(-)、GATA-3(-),结合患者病史、组织学形态及免疫组织化学结果,符合肺癌乳腺转移,见图2。乳腺肿瘤组织行EGFR基因检测提示18外显子G719X突变,20外显子S768I插入突变。患者继续以全身治疗为主,并于2014年5月开始行凯美纳治疗,2月后肺部及肝脏病灶缩小,见图1C~F。提示靶向治疗有效,之后肺部及肝脏病灶持续稳定,期间出现脑及骨转移并行局部放射治疗,2015年4月肺部及肝脏病灶开始缓慢进展,之后联用单药培美曲塞化疗,2015年9月复查病情稳定后失去随访。至失去随访时间,患者总生存24月,发现乳腺转移后生存18月。本病例中,乳腺肿瘤穿刺组织免疫组织化学指标GATA-3为后期加做。
患者2,34岁,女性,无吸烟史,2017年5月因呼吸困难就诊外院,在外院行胸部CT发现左肺门肿块伴左侧胸腔积液,见图3A。送检胸水,细胞学见腺癌细胞,并石蜡包埋后行组织病理切片提示腺癌,免疫组织化学为:CK20(-)、CK5/6(-)、CK7(+)、CR(-)、Ki-67(Li: 10%)、NapsinA(+)、P40(-)、P63(灶+)、TTF-1(部分+)。外院诊断肺腺癌伴恶性胸腔积液。我院借外院蜡块行EGFR基因检测示18号外显子G719X突变,ALK融合基因、BRAF基因、KRAS基因、ROS1融合基因均为阴性。行4周期PP方案化疗+贝伐珠单抗治疗后出现左侧腋窝淋巴结转移并伴有疼痛,于2017年10月出现左乳外上象限弥漫性增生,伴有红肿热痛、并乳头凹陷,见图3B~C。行粗针穿刺活检示腺癌,免疫组织化学示:CK7(+)、TTF-1(+)、NapsinA(弱+)、P63(灶+)、CK5/6(-)、GATA-3(-)、ER(-)、Calponin(-)、Ki-67(Li: 60%),见图4。2017年11月患者开始口服特罗凯治疗,并每月继续行贝伐珠单抗治疗,特罗凯治疗一月后肺部及乳腺肿瘤缩小,见图3D~E。提示靶向治疗有效,3月后出现脑转移行脑部放疗。2018年6月因病情进展,改为口服阿法替尼+贝伐珠单抗治疗至今,目前生存15月。

图1 患者1治疗前后的胸部CTFigure1 Case One: Chest computed tomography before and after therapy
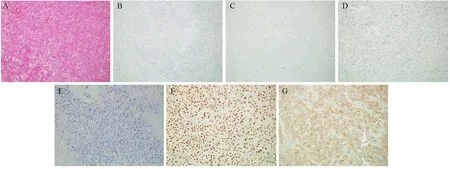
图2 患者1右乳肿瘤切除组织免疫组织化学结果Figure2 Case One: IHC analyses of the right breast cancer tissues from lumpectomy
2 讨论
乳腺原发性恶性肿瘤是女性常见的恶性肿瘤之一,而转移性乳腺癌非常少见,研究显示其约占乳腺恶性肿瘤的0.2%~7%[3],其中最常见的来源为对侧乳腺癌[3],而继发于乳腺外恶性肿瘤的乳腺转移则约占乳腺恶性肿瘤的0.2%~2.7%[1],除白血病及恶性淋巴瘤外,来自实体瘤的乳腺转移的发生率为0.1%~1%[3],较常见的为恶性黑色素瘤、肺癌、卵巢癌、胃肠道癌、泌尿生殖系统肿瘤和软组织肿瘤等[1]。Lee等收集了1994年11月至2009年4月其单位中心来源于乳腺外恶性肿瘤的乳腺患者33例,其中胃癌占24%,肺癌占15%,肝癌、恶性黑色素瘤、血液恶性肿瘤、胸腺恶性肿瘤以及结肠癌占6%,这种发生率与不同地域不同肿瘤类型发生率有关[4]。乳腺转移灶发生率低的原因可能是乳腺富有纤维组织导致血运差或与激素水平有关[1]。

图3 患者2治疗前后的胸部CTFigure3 Case Two: Chest computed tomography scans before and after therapy

图4 患者2左乳肿瘤穿刺活检组织免疫组织化学结果Figure4 Case Two: IHC analyses of the left breast cancer tissues from core needle biopsy
原发性肺癌是一种常见的恶性肿瘤,最常见的转移部位是肝脏、肾上腺、脑、骨等,但转移到乳腺的病例少见[5]。Mirrielees等通过系统性回顾分析了1989~2013年间报道的43例肺癌乳腺转移病例,其中10例为小细胞肺癌,33例为非小细胞癌,其中包括19例腺癌,3例鳞状细胞癌,4例大细胞癌,4例神经内分泌癌,3例未分化癌或其他;该报道涉及38例女性和5例男性患者,在各年龄组中发生比例相似,其中NSCLC患者乳腺转移时的平均年龄为55岁,SCLC患者为58岁,患者年龄在28岁至83岁之间[6]。肺癌乳腺转移的发病率高低与病理类型的相关性仍有待大样本研究。
有研究显示,乳腺转移多表现为增长较快的无痛性乳腺结节,常累及单侧(左侧居多),并多位于外上象限,因为乳腺外上象限的腺体和血运相对丰富,常为单灶或多灶性,但双侧乳腺的多发转移灶也不少见[7];乳腺转移皮肤改变和血性乳头溢液非常罕见,偶有报道乳腺转移灶的表现类似炎性乳腺癌,为伴有皮肤红肿的边界不清的肿物,据文献报道只有4%的患者表现为乳腺弥漫性改变[3]。
乳腺钼靶摄片和B型超声检查作为乳腺癌常用的筛查手段,在转移至乳腺的恶性肿瘤中均不具有特异性。钼靶摄片常显示为边界清楚、密度增强的单发或多发病灶,易误诊为良性病变,还可表现为局部皮肤增厚和皮下软组织水肿,通常不伴钙化,但是原发肿瘤为卵巢癌的乳腺转移多存在微小钙化。Lee等报道了22例接受钼靶检查的乳腺继发恶性肿瘤患者,有4例患者的钼靶图像存在微小钙化,包括1例卵巢癌、2例胃癌和1例肝癌[7];因此,不能根据是否存在微小钙化来判断乳腺结节为原发或继发。B型超声表现为圆形或卵圆形的低回声占位,也可仅表现为局部皮下组织水肿或皮肤增厚改变[2];在CT、MRI影像学上多表现为一个或多个圆形、边界相对清晰的结节,皮肤、乳头常无累及,偶有皮肤广泛增厚,腺体致密、模糊,伴(或不伴)结构紊乱,类似炎性乳腺癌,多不伴钙化,与乳腺癌或乳腺良性肿瘤亦不能完全区分[2];约有50%的乳腺转移患者同时伴有腋窝淋巴结肿大,因此亦不能根据是否存在腋窝淋巴结肿大来判断乳腺结节为原发或继发[2]。
病理学检查是诊断乳腺病灶最准确的方法。有一些研究者也总结了一些转移性乳腺癌的组织学特征,尽管都没有特异性,但是在诊断过程中可以给诊断者警惕和提示,这些组织学特征主要包括:缺乏导管原位癌、缺乏中央弹性组织变性或者结缔组织的形成、存在导管周或小叶周生长模式、肿瘤呈多灶性、病灶位于皮下、病灶缺乏钙化(或者存在砂粒体型钙化)或是见到在原发乳腺癌中很少出现的大量脉管癌栓[3]。免疫组织化学是探讨原发灶不明的转移性恶性肿瘤的一种可靠的和被广泛使用的手段[8]。本病例中,考虑到患者均有肺癌病史,因此主要选用了肺腺癌标志物TTF-1、Napsin A及乳腺癌标志物ER、PR、GCDFP-15和GATA-3来鉴别。在这些标志物中,没有一种对某种肿瘤具有完全特异性。TTF-1主要表达在肺和甲状腺上皮细胞,在肺腺癌中表达约为72.5%[2],在其他来源的恶性肿瘤中很少表达,然而,有研究显示2.4%的乳腺癌可以表达TTF-1[3];Napsin A在84%肺腺癌中有表达,根据以往文献显示在乳腺癌中很少有表达,但最近的一项研究表明超过三分之二的顶浆分泌特征的乳腺癌中Napsin A表达阳性[9];80%的乳腺癌表达ER,60%表达PR,ER/PR多表达于乳腺、子宫内膜和卵巢来源的肿瘤,其他部位来源的肿瘤也偶有表达,但通常表达较弱并呈局灶性[3]。GCDFP-15在原发乳腺癌中表达40%~79% ,但在三阴性乳腺癌中敏感度较低,在一小部分肺癌中也有表达[3]。GATA-3现在被认为是乳腺癌最敏感的免疫标志物,在ER(+)的乳腺浸润性导管癌中阳性率高达91%~100%,在三阴性乳腺癌中阳性率仍可达66.7%,然而,在肺腺癌中仍有8%表达阳性[2]。因此,在临床病史与影像学的帮助下,通过组织形态学以及免疫组织化学分析最终判断转移灶的来源[8]。本例患者1,乳腺病灶TTF-1及Napsin A表达阳性,而ER(-)、PR(-)、GCDFP-15及GATA-3表达阴性;患者2,乳腺病灶TTF-1及Napsin A表达阳性,而ER(-)及GATA-3表达阴性,根据患者已知的肺腺癌病史,以及两者肿瘤的形态及免疫组织化学的一致性,可以诊断乳腺病灶为肺腺癌转移,而不是原发性乳腺癌。
总体来说,转移至乳腺的实体瘤患者已存在其他部位的广泛转移,大部分患者在发现乳腺转移后生存期不超过一年[8]。 在169例不同类型非乳腺来源的实体瘤晚期患者的研究中,诊断乳腺转移之后的患者平均中位生存期为10月(1~192月)[6]。目前没有一个明确针对出现乳腺转移患者的指南,主要还是根据原发恶性肿瘤的病理、症状、分期、身体状况评分去管理治疗[8]。总的来说,根治性的手术在转移性癌症患者中不推荐,可能会导致更高的并发症和死亡率[8]。根据最新ESMO指南,孤立性转移的肺腺癌患者可以考虑在全身治疗的基础上行原发灶及转移灶的根治性治疗,而多发转移的肺腺癌患者以全身治疗为主[10]。
因此,鉴别原发性乳腺癌和恶性肿瘤乳腺转移最重要的三点是:病史、组织病理学特征、免疫组织化学分析。正确区分这两种情况直接影响患者预后和管理治疗,本文2例肺腺癌乳腺转移的病例较为典型,诊断明确,治疗上按目前指南结合个体化分子病理学特征予以合理的处理,属晚期肺腺癌乳腺转移的正常转归,特予以报道并初步总结目前国内外相关类似报道,希望对临床有所借鉴。
