壳聚糖微球制备及其应用研究进展
2019-04-02郭亮亮刘泽员张静
郭亮亮,刘泽员,张静
(郑州大学 化工与能源学院,河南 郑州 450001)
壳聚糖价廉易得,且具有止血、抑菌、抗癌等多种生理功能,且无毒、无刺激、可自然降解[1],这使得壳聚糖得以被广泛应用。在肿瘤治疗[2-3]、组织工程[4-6]、药物递送[7-10]、水处理[11-13]、食品包装[14-16]等方面,壳聚糖均有被研究及应用;此外壳聚糖在其它方面[17]也有应用。
由于优异的止血性能,壳聚糖类止血材料成为近几年止血材料的研究热点之一。有研究表明,壳聚糖某些衍生物在水溶性、止血性等方面优于壳聚糖。将壳聚糖特定衍生物制成微球,可提高其比表面积等参数。本文综述壳聚糖复合微球的几种制备方法及其在止血、抗癌、药物递送、药物缓释方面的应用。
1 壳聚糖复合微球制备方法
1.1 反相乳化法
反相乳化法是乳化法中的一种,常与其它方法结合使用。反相乳化法是指以壳聚糖溶液为分散相,液体石蜡、石油醚等为连续油相,配制成油包水(W/O)的壳聚糖乳剂,再根据要求加入定量戊二醛等交联剂或通过其它方式进行固化,分离干燥得到壳聚糖微球。其中戊二醛与壳聚糖交联的反应机理见图1[18]。
薛海燕等[19]应用该方法制备出了以壳聚糖和丙烯酸为主要基材的改性壳聚糖复合微球,复合微球的力学性能、规整程度受到基材比例、搅拌速率、反应温度、中和度、水油比、乳化剂用量以及乳化时间等因素的影响,后续的花青素吸附实验[20]中,在优化后的条件下,吸附率可达95.60%,这表明了复合微球对花青素吸附的可行性。反相乳化法的优点是毋庸置疑的,例如所包裹的药物不受亲水性、亲油性限制,反应条件、操作流程简单易行且所制备的微球外形规整、大小均一,但其也有一定的不足之处,比如反应所需的交联剂大都有一定毒性,此外交联剂还会致使某些药物失去活性。因此低毒性交联剂成为了研究人员的关注点。
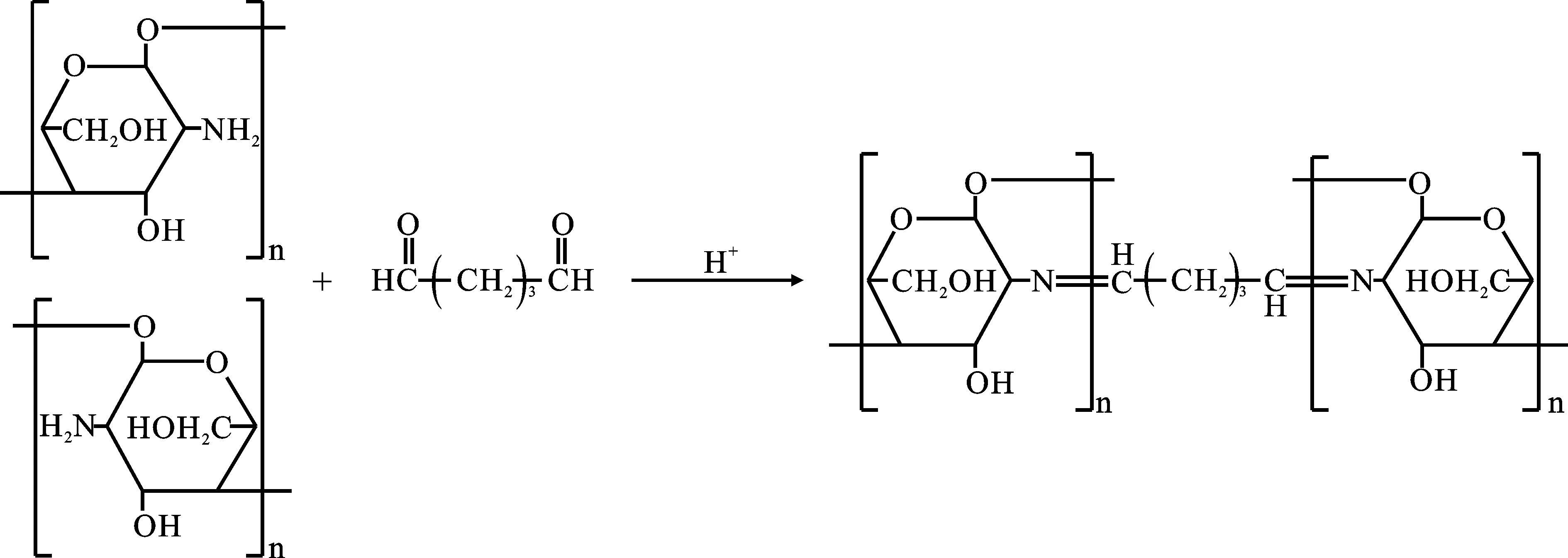
图1 戊二醛与壳聚糖交联的反应机理Fig.1 Reaction mechanism of cross-linking of glutaraldehyde with chitosan
1.2 离子交联法
离子交联法是指根据壳聚糖在酸性条件下表面带有正电荷,而一些聚离子如三聚磷酸钠带负电荷的特性,控制适当条件,使得二者通过分子间的静电作用相互交联形成网状或体形而生成壳聚糖微球的方法。三聚磷酸钠与壳聚糖交联的原理图见图2。

图2 三聚磷酸钠与壳聚糖交联的原理图Fig.2 Schematic diagram of cross-linking of sodium tripolyphosphate and chitosan
Tan等[21]结合离子交联法和喷雾干燥法,制备了负载有阿莫西林的纳米壳聚糖微球,微球中的壳聚糖与阿莫西林相互作用,显著增强了后者的抗菌性,复合微球的MIC值比阿莫西林低3倍。该方法所需反应条件温和,操作简单。其最大优点在于避免了有毒副作用的交联剂的使用,用于药物包裹等医药领域时,能够最大限度保留药物活性甚至一定程度上起到增强作用。但此方法制得的微球机械强度较差,规整程度有待提高。
1.3 喷雾干燥法
喷雾干燥法是指通过一种雾化器,将液体物料雾化成小液滴,混入热风中,使液滴中的溶剂瞬间挥发进而形成微球的方法。Mishra等[22]结合离子交联与喷雾干燥两种方法,制备出包封两种抗生素(盐酸多西环素、左氧氟沙星盐酸盐)的壳聚糖聚电解质复合物微粒,该微粒缓释效果优良、靶向效率高且没有明显细胞毒性。通过喷雾干燥制备的壳聚糖聚电解质复合物微粒适合作为替代载体,用于吸入类药物来递送抗生素。该方法要求热风不与液体物料反应,对于热敏型物料不适用。该方法中的原料液浓度、气流速度、进口气流温度均对产品质量有影响。喷雾干燥是目前最适合大规模生产的一种方法,应用前景广泛。
1.4 凝聚法
由于壳聚糖单体环上存在氨基基团且其在酸性条件下易发生质子化,这使得壳聚糖表面存在正电荷而溶于弱酸。凝聚法就是利用这个特点,通过降低壳聚糖在溶液中的溶解度,析出沉淀进而来制备微球。复凝聚法是凝聚法中的一种,适合用于制备亲水性药物微球。单凝聚法与复凝聚法的区别在于,单凝聚法是利用物理或化学等手段降低壳聚糖溶解度而将其析出来制备微球,而复凝聚法是利用另一种带有负电荷的高分子材料与壳聚糖相互交联共同沉淀制备微球。Kim等[23]通过含有阴离子的黄原胶与含有阳离子的壳聚糖相互凝聚,制备了壳聚糖-黄原胶微球,该微球体外释放为非Fickian扩散,对人真皮层纤维细胞无毒性且对牙龈卟啉单胞菌生长有选择性抗菌作用,动物模型试验有待进一步进行。凝聚法具有一定的优势,在反应过程中不需要使用额外的溶剂,避免了溶剂残留可能造成的毒性;但其仍有不足之处,包封率低、释放速率快等问题有待解决[24]。
2 壳聚糖复合微球制备及应用
2.1 止血方面
血液凝固的“瀑布学说”由MacFarlane、Davies和Ratnoff于1964年提出,该学说将血液凝固过程大致分为凝血酶原激活物形成、凝血酶形成、纤维蛋白形成三个阶段,被广泛认同[25]。目前使用的止血药物也都是通过激发血液凝固瀑布机制中某一环节[26]。壳聚糖止血大致分为三种方式:①壳聚糖本身的阳离子特性以及其本身结构和分子量,可使得红细胞大量吸附红细胞而止血;②壳聚糖的正电特性刺激血小板,后者活化后不仅能迅速在壳聚糖表面聚集形成血凝块,而且进一步发生凝聚,使凝块更牢固;③壳聚糖由于其本身独特的分子结构,能通过在体内的一系列生化反应后,结合几乎所有的主要血浆蛋白,及一些重要的凝血因子,从而起到进一步牢固血凝块的作用[27]。近年来壳聚糖在止血方面的应用研究发展迅猛。
Li等[28]把反相乳化法与热致相分离法结合起来,以壳聚糖的醋酸溶液为分散相,石油醚为连续相,司盘80和吐温60为表面活性剂,NaOH、乙醇的水溶液为相转化液,制得多孔壳聚糖微球。该微球的表面积、孔隙率、吸水率分别为28.2~31.5 m2/g、 98%、15.5~23.2 g/g,表面孔径在2.0 μm以下。大鼠肝切口模型实验表明,多孔壳聚糖微球与普通壳聚糖微球相比,止血时间大大缩短,失血量显著降低。组织学测试表明,在肝脏裂伤的应用中,多孔壳聚糖微球具有良好的生物相容性及生物活性。
Sun等[29]同样结合反相乳化和热致相分离两种方法,在壳聚糖溶液中加入高岭土,司盘80为乳化剂,乙醇为反相溶液,其它步骤与制备多孔壳聚糖微球相同,制备出壳聚糖/高岭土多孔复合微球。与纯壳聚糖多孔微球相比,壳聚糖/高岭土多孔复合微球在大鼠尾截肢和肝裂伤模型中的止血时间均有明显降低。全凝血动力学表明,在相同时间内,与纯壳聚糖多孔微球、市售celox止血王(速效止血粉)相比,多孔复合微球所形成的血块更大。其研究结果表明,多孔复合微球有作为快速止血剂,用于创伤止血的巨大潜力。
Pan等[30]以Li、Sun等的研究为基础,在制备多孔壳聚糖微球的过程中,向乳液中添加含有β-(1,4)-甘露糖醛酸酯(M)和α-L-古洛糖醛酸酯(G)单元嵌段的阴离子天然聚合物(SA)溶液、ZnCl2溶液,制备出了含锌离子的多孔壳聚糖微球。与纯壳聚糖多孔微球相比,在大鼠肝裂伤和尾切除模型中,CS@ZnAlg微球的血液凝块更大、凝血时间更短、出血量更短。孙双等[31]采用离子交联法,将叶酸与月桂酸钠的二甲基亚砜共溶液加入到O-羧甲基壳聚糖的醋酸-醋酸钠缓冲液溶液中进行反应,获得叶酸-O-羧甲基壳聚糖 (FA-O-CMCS)复合微球。经检测,该微球结构稳定,粒径在0.9~1 μm,比较均匀。最后采用断尾取血法探究FA-O-CMCS复合微球的凝血、止血性能,结果显示,凝血、止血时间分别为139 s和266 s,效果显著。
2.2 药物载体方面
壳聚糖安全无毒、可降解、生物相容性良好,是一种天然聚阳离子多糖,可根据其具有正电荷这一特性将其制备成微球,并负载或者包裹目标药物,用于止血、疾病治疗等方面。近年来,壳聚糖微球作为药物载体一直是人们的研究热点。
2.2.1 抗癌 壳聚糖抗癌有两种形式:第一,壳聚糖本身具有抗癌活性;第二,壳聚糖作为药物载体负载或包裹抗癌药物实现抗癌。对于第一种形式,壳聚糖可通过直接作用于肿瘤细胞,抑制其生长,诱导癌细胞凋亡,调节和增强机体免疫功能三种途径实现抗癌作用[32]。对于第二种形式,壳聚糖经常被用于包裹或负载抗癌活性药物实现抗癌,近年来研究较多。
Anitha等[33]首先将壳聚糖制备成N,O-羧甲基壳聚糖(N,O-CMC),随后通过离子交联法,在恒速搅拌下将离子交联剂三聚磷酸钠(TPP)加入到N,O-CMC溶液中,首先制得N,O-CMC纳米微粒。进一步地,在连续搅拌条件下,向N,O-CMC溶液中逐滴加入姜黄素的乙醇溶液,之后再加入TPP,得到负载姜黄素的纳米N,O-羧甲基壳聚糖微粒。这些微球平均直径(150±30)nm分布,为球形状态,MTT测试表明,该微球对正常细胞无毒,并对癌细胞有特异毒性。同年Anitha等[34]还开发了负载5-氟尿嘧啶的N,O-羧甲基壳聚糖纳米颗粒,并进行了抗癌活性研究,与常规化疗相比,该颗粒不仅显示出了乳腺癌细胞的毒性,而且副作用很低,血液相容性良好,药物包封率达65%。
殷启风等[35]也利用该方法,制备出包裹C-藻蓝蛋白的纳米微球(C-PC/CMC-NPs)。该纳米微球形状规整,平均粒径为120 nm。进一步地,他们又在C-PC/CMC-NPs上负载CD59sp(CD59 配体),从而制备出羧甲基壳聚糖包裹C-藻蓝蛋白负载CD59 配体的靶向纳米微球(C-PC/CMC-CD59sp-NPs)。MTT测试表明,该微球在体外对HeLa 细胞增殖有明显的抑制作用,具有良好的靶向性。在适宜pH条件下,120 h内释放率可达80%,并且无溶血现象发生。
Sriram等[36]通过离子交联法制备出负载有CuO-姜黄素的壳聚糖-苯丙酮复合载药微球,该微球的药物释放遵循非Fickian定律。由于壳聚糖中的芳基酮以及亲水性纳米CuO的存在,姜黄素得以有效释放。他们研究了所制备微球对M19-MEL、MCF-7和HeLa的抗癌活性,结果显示复合微球的抗癌活性与游离苯丙酮相当,其IC50值为12~19 μg/mL,抗癌活性显著。
2.2.2 药物递送 药物递送系统系采用多学科的手段将药物有效地递送到目的部位,与传统制剂相比,其可以提高药物稳定性,减轻药物毒副作用,提高药物利用率,在靶向区维持所需药物浓度,目前已发展建立了多种类型的新型药物递送系统[37]。
Yan等[9]以三价铝离子为交联剂,使用离子交联法制备了羧甲基壳聚糖/聚谷氨酸复合微粒(CMCS/PGA),性能测试结果表明,CMCS/PGA复合微粒的溶胀性能对pH值敏感,CMCS微球的亲水性随着PGA的引入大大提高。随后的研究中,又将亲水性药物左氧氟沙星(LFX)封装为模型药物以测试CMCS/PGA复合微粒的包封性能和体外释放性能,结果表明,CMCS/PGA复合微粒的体外释放性优异,持续给药,包封率达到28.6%,是理想的药物递送载体。
王大卫等[38]采用喷雾干燥法,以壳聚糖及两种提取物原花青素、白芨多糖为原料,制备出了原花青素/白芨多糖/壳聚糖微球。经一系列表征得,粒径分布在2~15 μm之间,形状规整,有良好的溶胀特性,具有缓释作用,有望成为肺吸入给药的良好载体。
李纳等[39]将离子交联法与喷雾干燥法结合起来,首先制备出姜黄素磷脂复合物(Cur-PS)水分散液,再将壳聚糖的醋酸溶液与之混合均匀,在搅拌条件下将三聚磷酸钠逐滴加入到混合液中,静置后经喷雾干燥制得姜黄素磷脂复合物壳聚糖微球。该微球呈表面光滑的完整球形,平均粒径可低至(5.19±0.4)μm,有望用于肺部给药。
2.2.3 药物缓释 在日常伤口处理以及临床给药方面,时常会有持续给药的要求,多次给药会造成病人痛苦,增加成本。缓释药物能有效减少给药次数,控制药物释放速率,延长药物作用时间,维持有效的药物浓度,降低药物的毒副作用[40],增加病人的顺应性。壳聚糖理化性质优良,可被制成药物载体用于药物缓释。Webber等[41]将壳聚糖添加到醋酸溶液中,搅拌至溶解,加入蒸馏水稀释后将其加入到还原型谷胱甘肽(GSH)的水溶液中,调节相关参数,经喷雾干燥器制得包裹有GSH的壳聚糖微球,该微球表面光滑,具有一定的缓释性能。
Helbling等[42]结合离子交联法和喷雾干燥法,将不同质量分数的黄体酮分散到壳聚糖的醋酸溶液,并加入合适量的乳化剂吐温80,搅拌均化,将交联剂三聚磷酸钠(TPP)逐滴加到均化后的溶液中,调节干燥器的进口温度、液体流量、干燥空气流量等参数,经喷雾干燥制得包裹黄体酮的壳聚糖微粒。经过测试,所制备的复合壳聚糖微球平均粒径分布在1~7 μm之间。复合壳聚糖微球的球形度随着乳化剂用量的增加而增加,随着交联剂的增加而减小,对黄体酮的包封率在69%~75%之间。在中性的缓冲溶液中,黄体酮持续释放,这为黄体酮在人体内的持续给药提供了可能。
Unagolla等[7]应用凝聚法,首先配制低分子量壳聚糖的乙酸溶液,过滤后加入万古霉素溶液并搅拌,完全溶解后将混合溶液滴加到三聚磷酸钠溶液中,以一定速度搅拌2 h,过滤后室温下风干过夜制备出包裹万古霉素的壳聚糖微球。同时,他们用该方法制备了包裹万古霉素的壳聚糖-藻酸盐微球。首先,配制壳聚糖、氯化钙的共溶液,加入万古霉素溶液并搅拌,连续搅拌下将共混液逐滴加入海藻酸盐/TPP溶液中,一段时间后将所得颗粒于室温风干过夜。经表征测试得,微球表面粗糙,均匀分布。其中,经冻干获得的万古霉素的壳聚糖-藻酸盐微球具有最优良的控释性能,该微球平均每天释放万古霉素22 μg,且持续长达14 d。万古霉素的释放速率并未随藻酸盐浓度增加而增加。
Xin等[43]首先将明胶与海藻酸钠水溶液均匀混合,加入定量大蒜素油,均质后将乳化液逐滴加入到氯化钙溶液中,随后将所得微球加入到壳聚糖溶液中,可得大蒜素/海藻酸钠/明胶/壳聚糖复合微球。经测试表征,微球粒径在0.8~0.9 mm 之间分布,形状规则,对pH敏感,具有良好缓释性能,且明胶的加入可延长药物缓释时间。
Scalera等[10]配制不同浓度壳聚糖溶液并加入聚山梨酯80作为表面活性剂,将过滤后的氢氧化钠溶液逐滴加入到壳聚糖溶液中,得到壳聚糖微球。该微球平均直径在150~400 nm范围内,其中最小的微球在水溶液中能够稳定存在3 d,说明该微球可用于短时间药物递送。
3 展望
近年来壳聚糖因其优异的特性、低廉的价格已得到广泛研究,在生物、医学、水处理、食品包装等诸多领域均有应用,但进一步的精细研究必不可少。新型止血材料的研究日渐增多,发展迅速,市场上已存在各种剂型的止血材料,但一些不足之处例如经济性、生物相容性、持久性、应用范围受限等依然存在,尤其是不可挤压止血的体内大面积出血,目前仍没有有效的止血材料可以解决此类问题,这都是我们努力的方向。壳聚糖微球近几年成为止血材料的研究热点,多孔壳聚糖微球、壳聚糖复合止血微球因其优良性能脱颖而出。然而对于这类材料来说,只拥有止血、无毒这些性能是远远不够的,优良的降解性能也是止血材料所必备的特性。此外,止血材料不仅不能引起炎症等不良反应的发生,而且在止血的同时,其本身也应具备抗菌性,防止感染的发生。再者有些伤口如烧伤创面的愈合是无法在短时间内完成的,这就要求止血材料具有长效止血、长效抑菌的特性。所以将可降解、具有更强止血性能的壳聚糖衍生物制备成缓释微球将是今后止血材料的发展方向。
