水稻条斑病抗感品种根际微生物群落结构和功能分析
2019-04-02杨俊王星付丽娜汪娅婷刘棋苗新利王凡魏兰芳姬广海
杨俊, 王星, 付丽娜, 汪娅婷, 刘棋, 苗新利, 王凡, 魏兰芳, 姬广海*
水稻条斑病抗感品种根际微生物群落结构和功能分析
杨俊1, 王星1, 付丽娜1, 汪娅婷1, 刘棋1, 苗新利3, 王凡1, 魏兰芳2, 姬广海1*
1. 云南农业大学植物保护学院, 昆明 650201 2. 云南农业大学农科基础实验教学中心, 昆明 650201 3. 云南省楚雄师范学院数学与统计学院,楚雄 675000
通过抗感水稻细菌性条斑病(简称细条病)的品种的水根际可培养细菌群落结构和代谢功能多样性分析, 探讨其根际细菌多样性差异与水稻抗细条病的相关性。采集孕穗期水稻品种CG2和IR24的植株根际土壤, 采用多种培养基进行可培养细菌的分离、鉴定, 并通过 16S rRNA序列构建系统进化树; 利用Biolog 技术分析不同品种根际微生物的代谢功能差异。结果显示: 不同水稻品种的根际土壤可培养细菌分析发现抗病品种CG2以芽孢杆菌为优势菌群, 而感病品种IR24以节杆菌为优势种群; 对条斑病菌有抑制的菌株, 筛选后以芽孢杆菌为主, 且抗病品种的比率达47%以上, 而感病材料中只有2.3%; 抗病品种根际微生物群落的Shannon多样性指数(H′), Shannon均匀度指数(SE), Simpson指数(D), McIntos指数(U)和McIntosh均匀度指数(ME)分别增加了8.80%, 48.49%, 11.76%, 41.88%和0.52%; 主成份分析表明抗病品种CG2的根际土壤微生物与感病品种IR24相比, 对碳水化合物, 氨基酸类、酯类、醇类、胺类和酸类的利用率分别提高了12.52%、66.53%、3.78%、7.49%、27.98%和40.67%。研究表明, 从根际土壤细菌数量和种类上看, 抗病品种CG2的根际土壤细菌数量和种类与感病品种相比, 细菌群落结构多样性更为丰富, 发挥生防作用的菌群更多, 为水稻条斑病的生物防治提供了思路和资源。
水稻条斑病; 根际微生物; 群落结构; 代谢功能
0 前言
水稻是世界上重要的粮食作物, 尤其是在亚洲。水稻细菌性条斑病是由水稻黄单胞属()细菌通过气孔或者伤口入侵寄主植物, 定殖于水稻叶片的薄壁组织细胞间并扩展形成病斑, 病斑不断融聚导致全叶枯死。近年来, 随着农业种植环境的改变, 水稻细菌性条斑病形成的危害越来越严重, 在中国条斑病引起的水稻减产已经从10%—20%发展到减产40%[1]。
植物内生菌是生存于寄主植物组织中, 与宿主植物建立了共生或互生关系并对植物不造成伤害的一类微生物[2]。植物内生菌可以促进宿主的生长, 增加宿主的抗病、抗逆性, 其种群组成与寄主种类、定殖部位、寄住的生长状况及生长环境等相关[3]。根际细菌是从根际分离所得, 有研究报道内生细菌来源于根际, 并从根际进入植物组织内部, 有益的根际细菌还能促进植物的能量代谢, 提高寄主的抗病、逆性和合成促进植物生长的激素[4-5]。由此证明, 植物内生细菌与根际细菌具有一定的功能相关性[6-7]。植物根际微生物的种群结构[8-9]和代谢功能特异性对植物寄住的生长发育和抵抗胁迫的影响[10-12], 根际微生物的种群结构和代谢功能的差异对作物的抗病性在棉花、烟草、西瓜和大豆上有所报道。李连洪等对棉花抗黄萎病品种(春矮早和86-6)和感病品种(中棉17和豫棉12)的根际真菌区系进行了分析, 结果表明抗病品种根际微生物的群落结构比感病品种更为复杂, 对枯萎病菌具有抑制作用的真菌种数和比率都高于感病品种, 而且抗病品种根际真菌的优势种对棉花黄萎病菌的抑制作用较强[13]。蔡秋华等对青枯病和黑胫病不同抗性烤烟品种‘红花大金元’、‘云烟-87’和‘K326’的群落结构和代谢功能多样性进行分析, 发现烤烟根际可培养细菌、放线菌数量和微生物总量皆与品种抗性呈正相关, 而真菌数量与品种抗性基本呈负相关[14]。雷娟利等发现西瓜抗枯萎病性与根际细菌的数量具有相关性,在生长发育各个阶段, 无论是土培还是基质培养均表现为: 抗病材料的根际细菌数量高于感病材料, 且根际真菌与放线菌数量与西瓜的抗感枯萎病性没有相关性[15]。陈宏宇等发现对大豆根腐病抗病性不同的大豆品种根际可培养细菌总数存在差异, 抗根腐病品种S10根面可培养细菌数量显著高于感病品种H25[16]。
目前关于水稻细菌病害的生物防治的资源发掘主要集中于水稻内生菌和根际微生物, 很多研究从水稻的叶片、茎内生菌和根际微生物发掘出很多对病害具有生防价值的菌株[17-18], 但针对水稻细菌性条斑病不同抗性水平的水稻品种根际细菌的微生物群落结构和代谢功能差异进行研究的报道鲜有。本研究前期通过抗性筛选得到一个对水稻细菌性条斑病具有高抗水平的水稻籼稻地方品种CG2, IR24作为感病对照品种, 通过对水稻抗感品种的根际可培养细菌的分离、鉴定、群落多样性和代谢多样性的差异。对阐述水稻品种、根际有益细菌、病原细菌和环境之间的相互关系有更进一步的认识, 也为抗水稻细菌性病生物资源的挖掘提供依据。
2 材料与方法
2.1 水稻材料
水稻种植于云南省德宏傣族景颇族自治州芒市芒核村水稻实验田(经纬度N24°25′57′′, E98°32′55′′, 海拔: 837 m), 试验田采用小区设计, 共6个小区(每个品种各三个小区, 按照单因素随机区组设计), 每个小区为单一水稻品种, 小区内水稻种植呈3行10列, 行间距25 cm, 列宽20 cm。移栽时间为2017年5月15日。
2.2 土样采集
采集时间为2017年6月29日, 水稻处于孕穗期, 每个小区采用五点采样法。采集时掘取整株水稻, 水稻根部土壤掘取至少15 cm的深度, 保持整个根系的完整, 轻轻抖落根系表面的大块土壤 ,收集附着在根系上的土壤作为根际土壤, 采集后立即将水稻带回实验后收集根际土壤, 水稻“CG2”品种根际土壤编号为“CG2”, 水稻“IR24”品种根际土壤编号为“IR”, 收集完成存于4 ℃[19]。
2.3 水稻根际土壤可培养细菌分离
将10 g水稻根际土加入到含90 mL无菌水三角瓶中, 150 r·min-1、28 ℃摇床条件下放置15 min后采用梯度稀释3次后, 将10-1、10-2、10-3梯度涂布于牛肉膏蛋白胨琼脂培养基[20], 28 ℃培养24—48 h。待单菌落长出, 进行平板计数后保存于25%甘油的液体牛肉膏蛋白胨培养基中。
2.4 根际土壤细菌16S rRNA 鉴定
采用LB平板复壮保存的单菌落后, 转接至液体LB培养基(不含琼脂)中, 160 r/min, 28 ℃培养12 h后, 采用细DNA提取试剂盒进行基因组DNA提取, 扩增引物为27F: 5'-AGAGTTTGATCCTGGC TCAG-3’; 1492R:5’-TACGGCTACCTTGTTACGAC TT-3’。PCR扩增程序: 94 ℃ 4 min(预变性); 94 ℃ 1 min, 55 ℃ 45 s, 72 ℃ 1 min, 35个循环; 72 ℃ 10 min; 4 ℃保存。PCR产物通过1%的琼脂糖凝胶电泳检测后送昆明硕擎生物科技有限公司测序, 测序结果通过NCBI NBLAST 进行相似性比对, 选取同源性比较高的典型菌株的16S rRNA基因序列作为参比对象, 构建系统进化树, 并以属进行群落结构分析。
2.5 水稻根际土壤细菌对条斑病的抑制作用分析
采用平板对峙法筛选对条斑病病原菌具有抑制作用的根际土壤细菌: 在灭菌培养皿中加入浓度为3×108cfu·mL-1的菌悬液 100 µL, 再加入 20 mL 培养基, 无菌操作台晾干后, 在平板中心用无菌牙签接种已培养24 h的根际土壤细菌, 每个菌三个重复, 28 ℃培养, 48 h后观察结果, 并测量抑菌圈直径。条斑病菌选用本实验室已进行致病性测定和基因组测序的菌株YM15。
2.6 根际土壤微生物活性测定及其数据分析
根际微生物代谢功能多样性采用Biolog-ECO (31 种碳源)进行分析测定。Biolog ECO微平板中具有6 类碳源, 共31 种, 各孔碳源包括糖类10 种, 氨基酸类6 种, 羧酸类 7 种, 多聚物类 4 种, 酚酸类 2 种, 胺类化合物 2 种, 酚类2种。
称取10.0 g土壤加入90 mL无菌生理盐水(0.85%)溶液中, 在摇床上振荡30 min, 4 ℃冰箱静置10 min, 待分层稳定取上清液梯度稀释10-3, 取150 µL稀释液至 Biolog-ECO 板的微孔中, 接种好的平板置于25 ℃恒温培养, 分别于24、48、72、96、120、144、168 h在Biolog EmaxTM 自动读盘机上用 Biolog Reader 4.2软件(Biolog, Hayward, CA, USA)读取 OD590 nm值[20]. 采用培养 72 h 的数据进行土壤微生物碳源利用分析和主成分分析, 微生物多样性指数分析采用EXCEL2010, 根际微生物群落的Shannon多样性指数(H′)Shannon均匀度指数(SE), Simpson指数(D), McIntos指数(U)和McIntosh均匀度指数(ME)的计算方法见(表1)[21], 其中Pi为第i孔的相对吸光值(C-R)与整个平板相对吸光值总和的比率; S为颜色变化的孔的数目; ni是第i孔的相对吸光值(C-R); N是相对吸光值总和。采用软件PAST进行主成份分析, 各碳源利用情况的热力图使用MetaboAnalyst 3.0 在线生成,其中聚类方法中样本归类距离为欧氏距离 Euclidean。
3 结果与分析
3.1 水稻根际可培养细菌鉴定
首先通过对培养24 h的培养平板进行单菌落计数, 将分离保存的98株菌进行16S rRNA PCR扩增测序, 经过NCBI同源性比较与相似性达到99%~100%的菌株确定为同一分类学地位, 剔除重复重复序列菌株构建系统进化树(图1)。经分析89株细菌集中在以下19个属, 并且两个水稻品种的根际细菌

表1 微生物群落多样性指数计算方法

CG2代表CG2品种的根际可培养细菌, IR24代表IR24品种的根际可培养细菌。
Figure 1 Phylogenetic tree was constructed based on the 16S rRNA gene sequences showing the evolutionary relationships of rice rhizosphere bacteria CG2
3.2 水稻根际土壤可培养细菌拮抗细菌的筛选
上述鉴定得到的单菌落对水稻条斑病病原菌YM15进行抑菌测定, 8株菌对条斑病病原菌YM15具有明显的抑菌作用, 6株来源于CG2, 2株来源于IR24, 除菌株F为Microbacterium属, 其他有抑菌作用的全为Bacillus属,其中菌株A、C、D、和H的抑菌效果较强, (表3)。
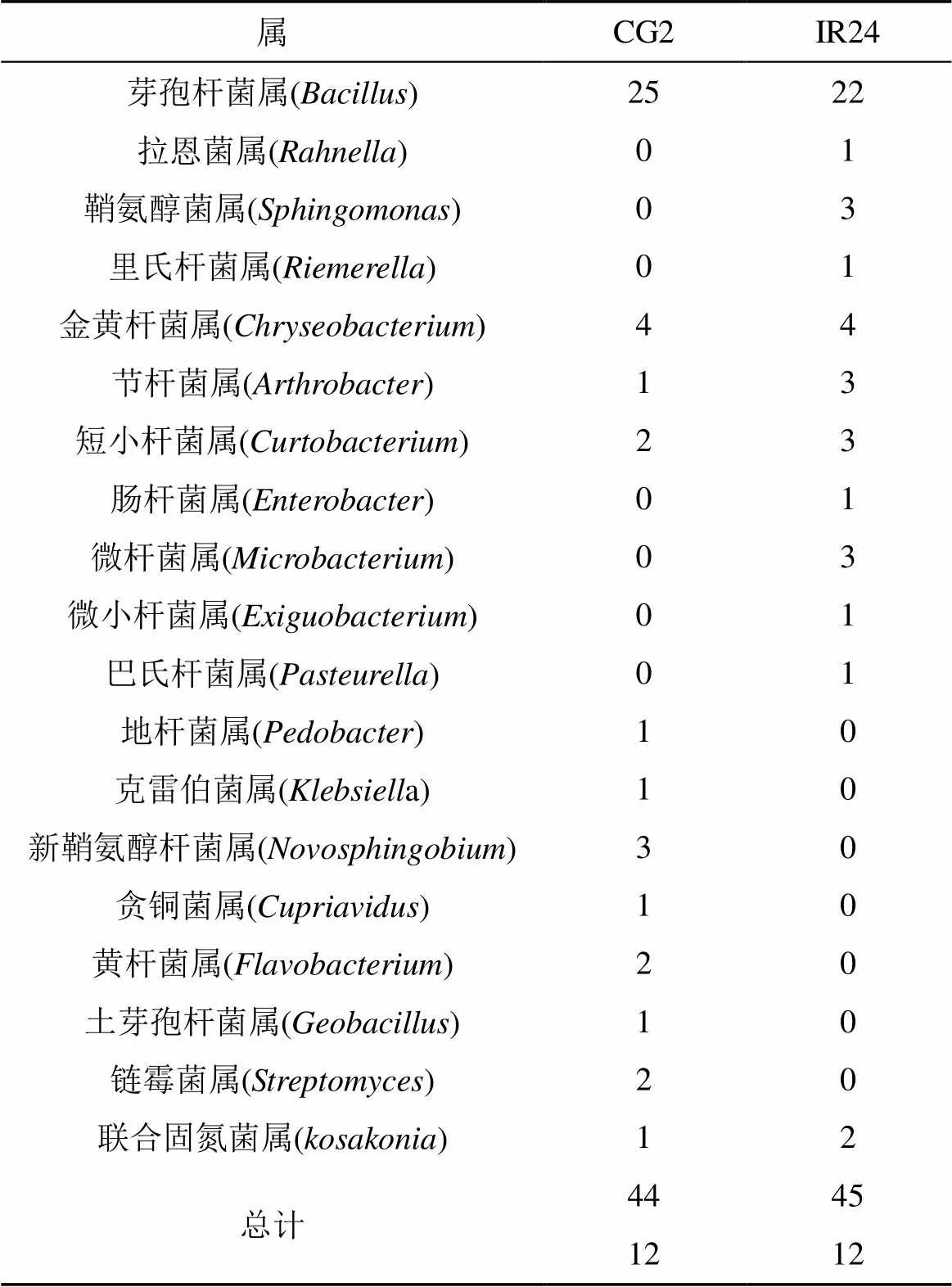
表2 不同水稻品种根际土壤细菌的属间差异
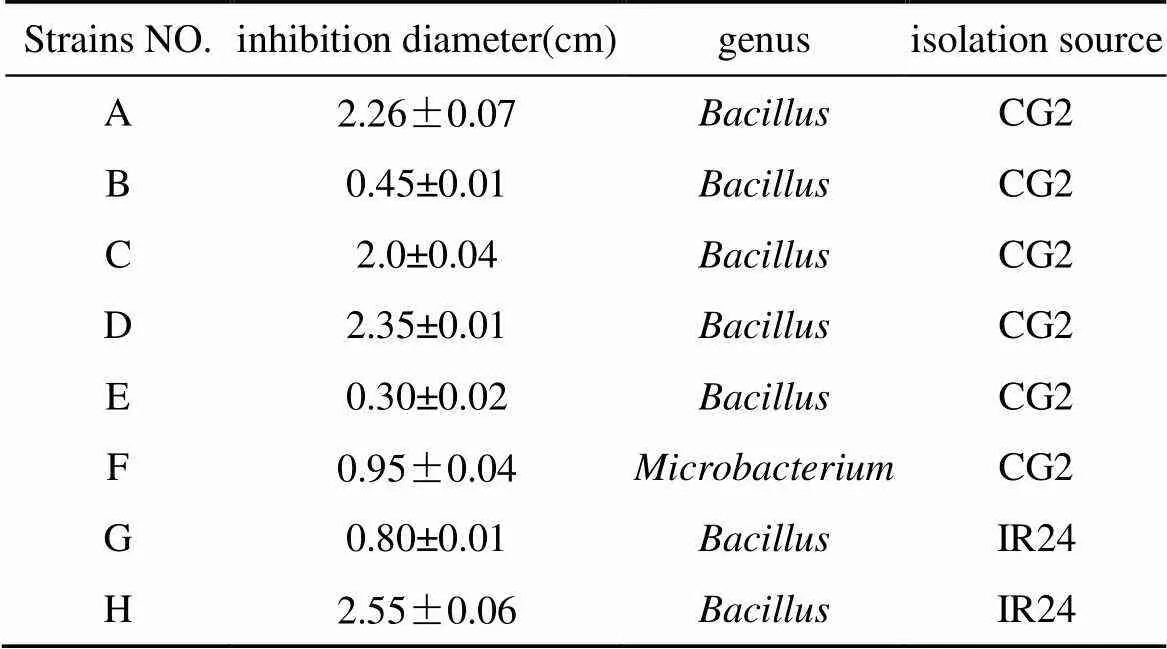
表3 生防菌对水稻条斑病原菌的拮抗效果测定
3.3 不同品种水稻根际细菌对总碳源的利用情况
平均颜色变化率(AWCD)是反映土壤微生物活性的重要指标。两个不同抗性品种的根际微生物群落的AWCD值在24 h以前均变化不明显; 在24 h—120 h之间变化明显, AWCD值急剧升高; 120 h后, AWCD值趋于平缓达到稳定状态。在整个培养过程的各个阶段, 水稻品种CG2的AWCD值均高于水稻品种IR24, 以培养96 h时AWCD值来比较, 抗病品种CG2比感病品种IR24提高了36%(F=2.28270, P>0.05), 这表明抗病品种CG2的根系微生物的对测试底物的利用能力高于感病品种IR24(图2)。
3.4 不同品种对根际微生物多样性指数的影响
不同的多样性指数可以表示土壤微生物群落利用碳源类型的情况。Shannon多样性指数评估丰富度和均度; Simpson评估某些最常见种的优势度指数; McIntosh指数基于群落物种多维空间上的Euclidian距离的多样性指数, 由McIntosh指数计算得出的均匀度对培养 96 h 各处理土壤进行测定, 计算各品种根际微生物代谢功能多样性指数。由表 4 可知, 在培养 72 h 后,水稻抗病品种CG2的根际微生物代谢功能多样性和感病品种IR24相比,抗病品种根际微生物群落的Shannon多样性指数(H′)Shannon均匀度指数(SE), Simpson指数(D), McIntos指数(U)和McIntosh均匀度指数(ME)分别增加了8.80%(F= 1.766 P-value=0.255), 48.49%(F=3.472 P-value=0.136), 11.76%(F=0.762 P-value=0.432), 41.88%(F=3.689 P- value=0.127)和0.52%(F=0.001 P-value=0.994)。
3.5 不同品种根际微生物对不同类型碳源利用的差异
如图 3所示, 抗条斑病品种CG2的三个小区根际土壤微生物利用碳源的效率聚为同一类, 同样的感条斑病品种IR24的三个小区根际土壤微利用碳源的效率聚为同一类。数据分析表明, 抗条斑病品种CG2的根际土壤微生物与感病品种IR24相比, 对碳水化合物, 氨基酸类, 酯类, 醇类, 胺类和酸类的利用率分别提高了12.52%, 66.53%, 3.78%, 7.49%, 27.98%, 和40.67%。
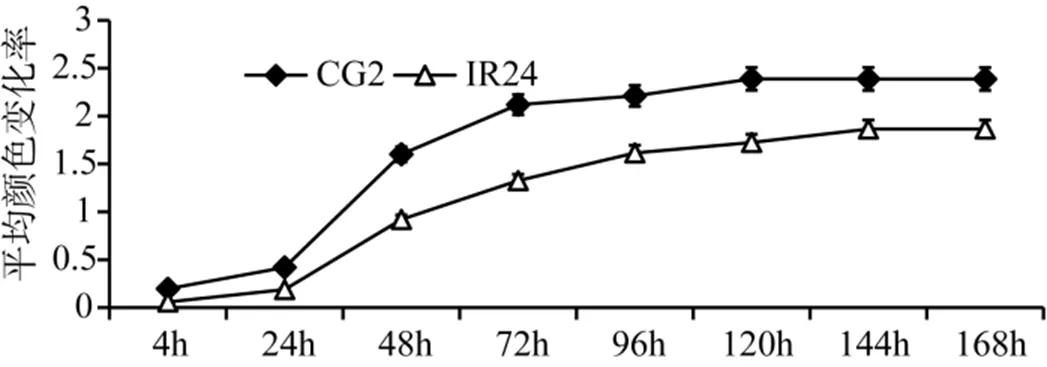
图2 不同细菌性条斑病抗性水稻品种根际土壤微生物平均颜色随时间的变化率
Figure 2 Average well color development (AWCD) changes with incubation time of different resistance rice cultivars
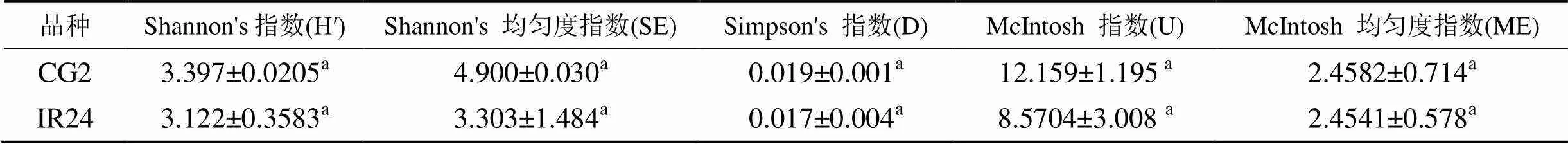
表4 水稻抗感品种根际土壤微生物群落代谢功能多样性指数
注: 同列数据后不同字母分别代表两个品种在 p<0.05 水平下差异显著
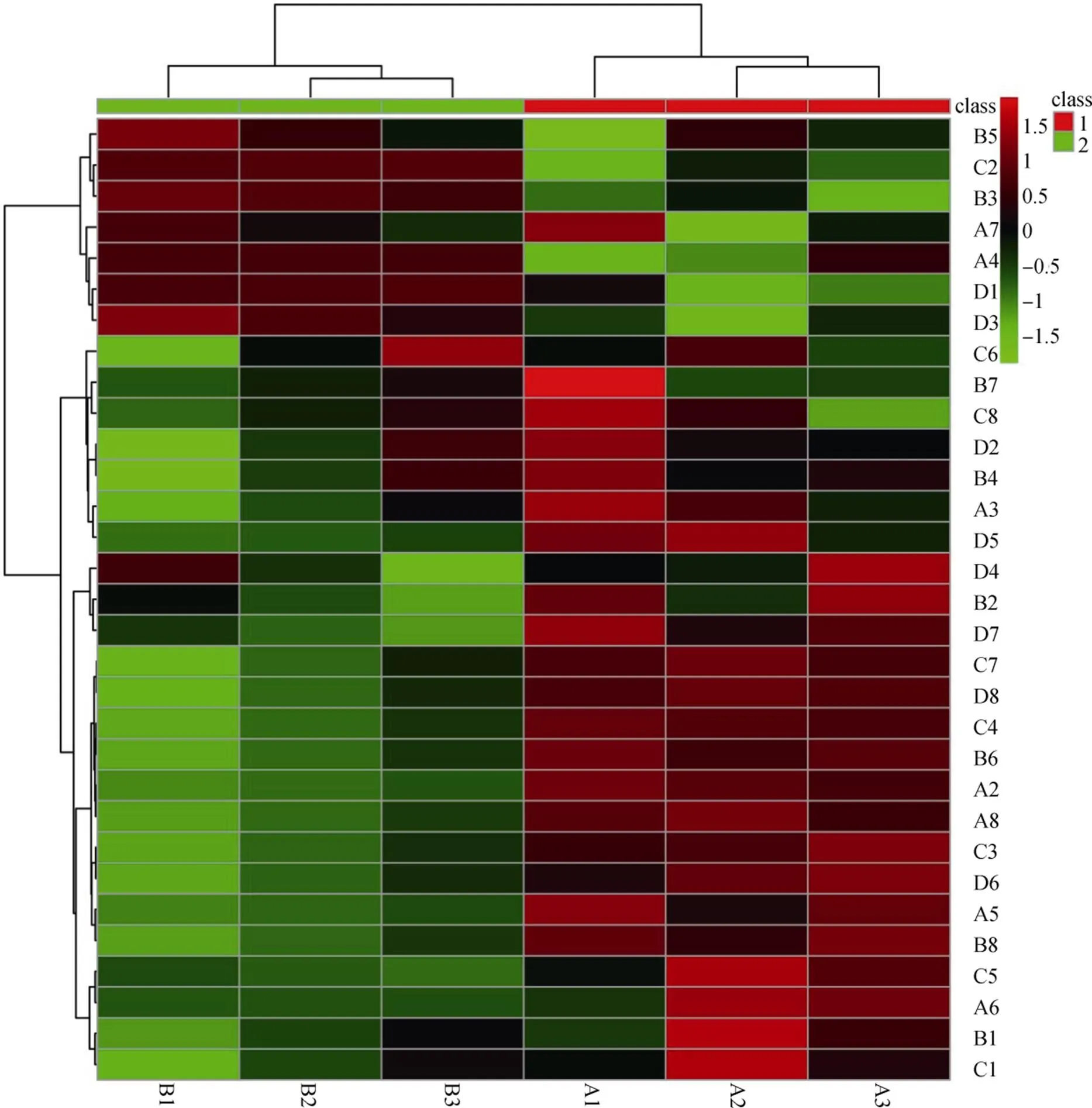
B1: 丙酮酸甲酯; C1: 吐温 40; D1: 吐温 80; E1: α-环式糊精; F1: 肝糖; G1: D-纤维二糖; H1: α-D-乳糖; A2: β-甲基-D-葡萄糖苷;B2: D-木糖; C2: i-赤藓糖醇; D2: D-甘露醇; E2: N-乙酰基-D-葡萄糖胺; F2: D-葡萄糖胺酸; G2: 葡萄糖-1-磷酸盐; H2: D,L-α-甘油磷酸盐; A3: D-半乳糖酸-γ-内酯; B3: D-半乳糖醛酸; C3: 2-羟基苯甲酸; D3: 4-羟基苯甲酸; E3: γ-羟基丁酸; F3: 衣康酸; G3: α-丁酮酸; H3:D-苹果酸; A4: L-精氨酸; B4: L-天冬酰胺酸; C4: L-苯基丙氨酸; D4: L-丝氨酸; E4: L-苏氨酸; F4: 葡萄糖-L-谷氨酸; G4: 苯基乙胺; H4:腐胺。CG1~3 分别代表品种CG2的 3 个重复试验小区, IR1~3 分别代表品种IR24的3 个重复试验小区。
Figure 3 Utilization of 31 sole carbon sources by microorganisms in rhizosphere soils of different resistant rice variety
以培养96 h的测定数据为依据进行主成分分析。水稻抗病品种CG2根际土壤微生物主成分PC1的变异为 83.7%,主成分 PC2 的变异为 10.9%,两主成分的总贡献率为94.6%, 其余的主成份由于贡献率较小不做分析, 因此主成分PC1和主成分PC2能反映明显的差异。两个品种在PC1轴上被较好的分离开,CG2的主要集中于第一、四象限, 相对应的IR24的主要集中于二、三象限(图4)。结果说不同抗性水平的水稻品种根际土壤微生物的群落对碳源的利用能力不同, 说明两个品种的群落结构结构有明显的差异。某一碳源的初始载荷因子决定了该碳源对主成份的影响, 初始载荷因子越大, 则影响越大。根据Choi建立的选择标准, 在主成份1和主成份2上绝对值大于0.18的载荷因子碳源对主成份有较大影响[22]。
3.6 不同水稻品种根际土壤微生物碳源利用特征的主成份分析
对主成分1影响较大的碳源有10种, 2种为碳水化合物: a-环式糊精(E1),葡萄糖-1-磷酸盐(G2); 3种为羧酸类: 2-羟苯甲酸(C3), γ-羟基丁酸(E3), 衣康酸(F3); 3种为氨基酸类: L-苯基丙氨酸(C4), L-苏氨酸(E4), 甘氨酰-L-谷氨酸(F4); 1中为胺类: 腐胺(H4); 1种为醇类: D,L-a-甘油(H2)。10种碳源全部为正相关。
对主成份2影响较大的碳源有4种, 1种碳水化合物: a-D-乳糖(H1)呈正相关; 2种羧酸类: 2-羟苯甲酸(C3)呈负相关, γ-羟基丁酸(E3)呈负相关; 1种胺类: 苯乙基胺(G4)呈正相关(表5)。
4 讨论
土壤是植物赖以生存的物质基础, 土壤中的微生物对植物的生长发育有着直接关系。不同的植物品种和不同土壤性质中的微生物的群落结构有着很大的差异。林文雄等基于基因组总DNA 的T-RFLP 分析旱直播模式下5 叶期和7 叶期化感水稻根际土壤微生物的组成和结构具有差异性, 表明水稻根际微生物受水稻品种和生理期的影响[23]。潘丽媛等对高产示范田和常规水稻田的同一水稻品种的微生物数量进行比较, 高产示范田水稻根际微生物数量是常规水稻田的2倍多, 说明水稻根际微生物越丰富, 水稻越高产; 并且得出细菌绝对优势菌群, 放线菌, 真菌只占微生物总数的0.16%, 由此证明细菌的群落结构对水稻高产起着重要作用[24]。本研究结果显示, 水稻条斑病抗性差异品种之间的水稻根际微生物的多样性存在着差异, 且抗病品种的多样性和感病品种相比均有增加。
近年来通过研究植物的内生菌和根际微生物与寄主植物互作增加植物对病原菌抗性的研究已有报道, Yanti对大葱的根际微生物进行分离鉴定, 得到一株粘质沙雷氏菌介导了大葱对大葱叶斑病()抗性[25]。Ke对198株根际微生物细菌生物防治不同的植物病害菌进行筛选, 得到28株具有广谱抗性的根际微生物细菌对四种不同的病原菌引起的植物病害,()引起的番茄疮痂病(bacterial spot of tomato),()引起的番茄斑点病(bacterial speck of tomato)[26]。本研究从, ()引起的水稻细菌性条斑病(rice leaf streak)作为出发点对水稻抗感品种根际土壤中可培养细菌具有生防能力细菌的种类和数量进行分析发现, 抗病品种“CG2”分离得到克雷伯菌属(), 新鞘氨醇杆菌属()和链霉菌属()菌, 而在感病品种根际土中并未分离得到, 这三个菌属在以往的研究中多报道为具有生防潜力的有益菌[27–29], 是否是这些菌属的存在对水稻的抗性有影响需要更深入的研究; 对两个品种中“CG2”水稻根际土壤细菌中对具有抑菌作用的主要菌属为芽孢杆菌属, 从筛选的结构来看, 抗病品种根际土壤可培养生防菌数量比感病品种多, 对抗病品种的抗病是否起到作用及作用机制有待进一步的研究。
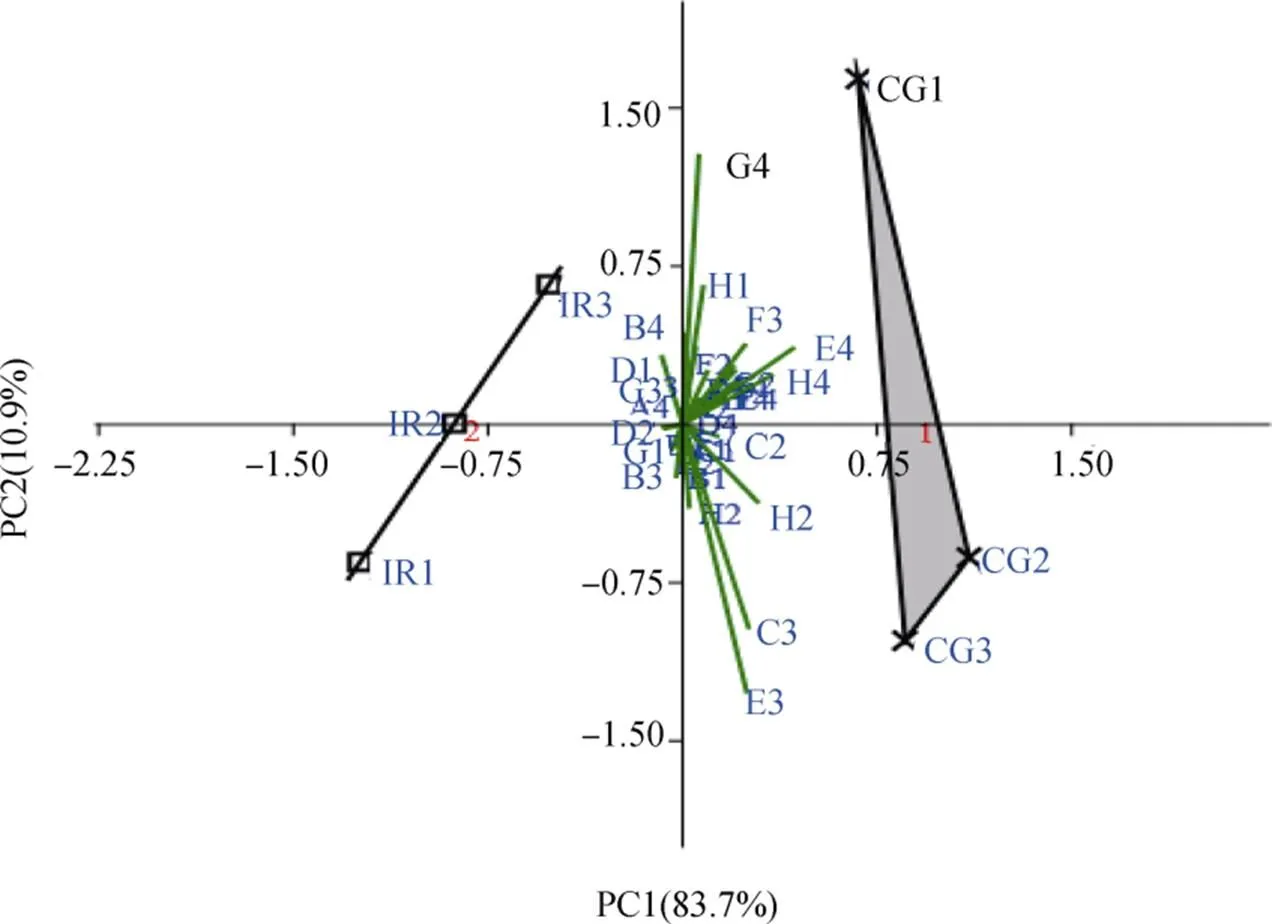
图4 不同抗性水稻根际微生物碳源利用特征的主成分分析
Figure 4 Principal components analysis of carbon utilization profiles in different resistance rice rhizosphere microbial community
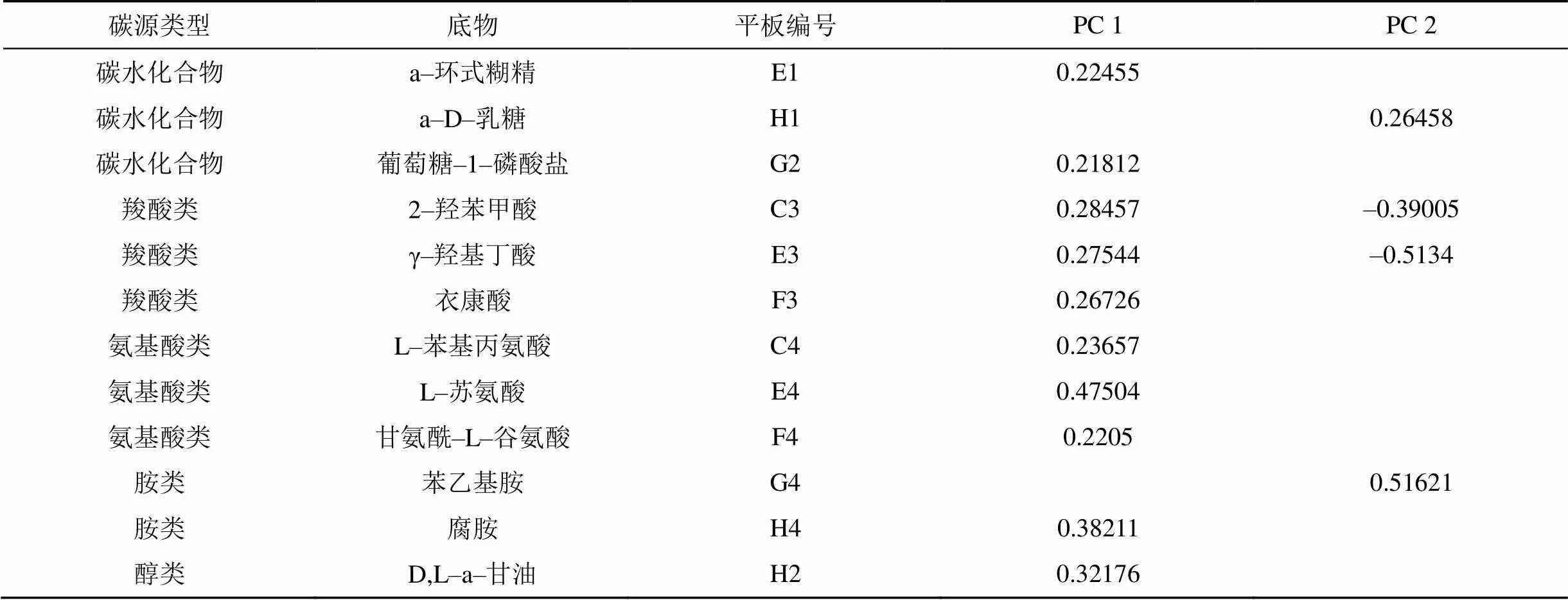
表 5 抗条斑病水稻品种与感病品种根际土壤微生物对 31 种碳源利用在主成份1、主成份2 上的载荷(Loading>0.18 和 Loading<-0.18)
5 结论
本研究以水稻抗水稻细菌性条斑病抗性差异品种的根际土壤微生物作为研究对象, 对根际土壤中可培养的细菌分离和分子生物学鉴定, 利用采用平板对峙法筛选对具有抑制作用的生防菌, 平板计数法明确抗感水稻品种根际土壤可培养细菌的群落结构, 结合Biolog ECO微生物多样性分析系统对抗感水稻品种的代谢功能差异经行分析, 最后得出以下结论:
水稻抗感细菌性条斑病品种的根际土壤可培养细菌群落结构存在很大的差异, 抗病品种CG2的细菌属中作为生防菌的居多, 且直接有抑菌作用的菌株数量也更多; 从根际土壤微生物生代谢多样性分析, 抗病品种CG2的各种多样性指数叶高于感病品种CG2。这不仅为水稻细菌性条斑病的生物防治提供了思路和资源, 也为植物、根际微生物与病原微生物之间互作关系提供理论基础, 能更好的利用生态多样性对病害进行控制。
[1] CAI Lulu, CAO Yanyan, XU Zhengyin, et al. A transcription activator-like effector Tal7 of Xanthomonas oryzae pv. oryzicola activates rice gene Os09g29100 to suppress rice immunity[J].Scientific Reports, 2017. 7(1), 50–89.
[2] SWARTHOUT D, HARPER E, JUDD S, et al. Measures of leaf-level water-use efficiency in drought stressed endophyte infected and non-infected tall fescue grasses[J].Environmental and Experimental Botany, 2009.66(1), 88–93.
[3] DE L F, LEIA C, FERNANDA L, ARAÚJO W. Epicoccum nigrum P16, a sugarcane endophyte, produces antifungal compounds and induces root growth[J]. PLoS One, 2012, 7(6): e36826.
[4] SINGH M, SINGH D, MESAPOGU S, et al. Concomitant colonization of nifH positive endophytic Burkholderia sp. in rice (Oryza sativa L.) promotes plant growth[J]. World Journal of Microbiology and Biotechnology, 2011, 27(9): 2023–2031.
[5] EDWARDS J, JOHNSON C, SANTOS-MEDELLÍN C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences, 2015, 112(8): E911–E920.
[6] THIJS S, VAN DILLEWIJN P, SILLEN W, et al. Exploring the rhizospheric and endophytic bacterial communities of Acer pseudoplatanus growing on a TNT-contaminated soil: towards the development of a rhizocompetent TNT- detoxifying plant growth promoting consortium[J]. Plant and soil, 2014, 385(1-2): 15–36.
[7] 赵丹, 赵娟, 刘涛, 等. 元阳梯田水稻品种‘月亮谷’根系内生及根际细菌的群落结构[J]. 云南农业大学学报(自然科学), 2017, 32(01): 17–26.
[8] MENDES L, KURAMAE E, NAVARRETE A, et al. Taxonomical and functional microbial community selection in soybean rhizosphere[J]. The ISME journal, 2014, 8(8): 1577–1587.
[9] YAN Y, KURAMAE E, DE HOLLANDER M, et al. Functional traits dominate the diversity-related selection of bacterial communities in the rhizosphere[J]. The ISME journal, 2017, 11(1): 56–66.
[10] PII Y, MIMMO T, TOMASI N, et al. Microbial interactions in the rhizosphere: beneficial influences of plant growth- promoting rhizobacteria on nutrient acquisition process. A review[J]. Biology and fertility of soils, 2015, 51(4): 403–415.
[11] CHAPARRO J, BADRI D, VIVANCO J. Rhizosphere microbiome assemblage is affected by plant development[J]. The ISME journal, 2014, 8(4): 790–803.
[12] CARVALHAIS L C, DENNIS P G, BADRI D V, et al. Linking jasmonic acid signaling, root exudates, and rhizosphere microbiomes[J]. Molecular Plant-Microbe Interactions, 2015, 28(9): 1049–1058.
[13] 李洪连, 袁红霞, 王烨, 等. 根际微生物多样性与棉花品种对黄萎病抗性关系研究——Ⅰ.根际微生物数量与棉花品种对黄萎病抗性的关系[J]. 植物病理学报, 1998(04): 341–345.
[14] 蔡秋华, 左进香, 李忠环, 等. 抗性烤烟品种根际微生物数量及功能多样性差异[J]. 应用生态学报, 2015, 26(12): 3766–3772.
[15] 雷娟利, 寿伟松, 董文其, 等. 抗感枯萎病西瓜根际微生物比较研究[J]. 微生物学通报, 2008, (07): 1034–1038.
[16] 陈宏宇, 李晓鸣, 王敬国. 抗病性不同大豆品种根面及根际微生物区系的变化Ⅰ.非连作大豆(正茬)根面及根际微生物区系的变化[J]. 植物营养与肥料学报, 2005, (06): 98–103+109.
[17] ADAME-ÁLVAREZ R, MENDIOLA-SOTO J, HEIL M. Order of arrival shifts endophyte–pathogen interactions in bean from resistance induction to disease facilitation[J]. FEMS microbiology letters, 2014, 355(2): 100–107.
[18] D’ALESSANDRO M, ERB M, TON J, et al. Volatiles produced by soil-borne endophytic bacteria increase plant pathogen resistance and affect tritrophic interactions[J]. Plant, cell & environment, 2014, 37(4): 813–826.
[19] SPENCE C, ALFF E, JOHNSON C, et al. Natural rice rhizospheric microbes suppress rice blast infections[J]. BMC plant biology, 2014, 14(1): 130.
[20] 陆晓菊, 官会林, 张正芸, 等. 三七连作根际土壤微生物区系的16S rRNA系统遗传多样性[J]. 微生物学报, 2015, 55(02): 205–213.
[21] WEBER K, GROVE J, GEHDER M, et al. Data transformations in the analysis of community-level substrate utilization data from microplates[J]. Journal of Microbiological Methods, 2007, 69(3): 461–469.
[22] 董艳, 董坤, 汤利, 等. 小麦蚕豆间作对蚕豆根际微生物群落功能多样性的影响及其与蚕豆枯萎病发生的关系[J]. 生态学报, 2013, 33(23): 7445–7454.
[23] CHOI K, DOBBS F. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203–213.
[24] 熊君, 林辉锋, 李振方, 等. 旱直播条件下强弱化感潜力水稻根际微生物的群落结构[J]. 生态学报, 2012, 32(19), 6100–6109.
[25] 潘丽媛, 肖炜, 董艳, 等. 超高产生态区水稻根际微生物物种及功能多样性研究[J]. 农业资源与环境学报, 2016, 33(6): 583–590.
[26] YANTI Y. Peroxidase Enzyme Activity of Rhizobacteria- Introduced Shallots Bulbs to Induce Resistance of Shallot towards Bacterial Leaf Blight ()[J]. Procedia Chemistry, 2015, 14(1): 501–507.
[27] 赵明富, 李梦娇, 张芬芬, 等. 变栖克雷伯菌在石斛体内的定殖动态及其对石斛黑斑病的防效试验[J]. 西南林业大学学报, 2015, 35(03): 14–19.
[28] 任慧爽, 徐伟芳, 王爱印, 等. 桑树内生细菌多样性及内生拮抗活性菌群的研究[J]. 西南大学学报(自然科学版), 2017, 39(01): 36–45.
[29] 田新莉, 曹理想, 杨国武, 等. 水稻内生放线菌类群及其对宿主病原菌的抗性研究[J]. 微生物学报, 2004, (05): 641–646.
Study on rhizosphere microbial community and functional diversity of different resistant rice varieties to rice leaf streak disease
YANG Jun1, WANG Xing1, FU Li-na1, LIU Qi1, MIAO Xinli3, WANG Fang1, WEI Lanfang2, JI Guanghai1*
1. College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China 2. Experimental Agricultural Center, Yunnan Agricultural University, Kunming 650201, China 3. School of Mathematics and Statistics,Chuxiong Normal University,Chuxiong 675000, China
We analyzed the rice rhizosphere microbiome composition and metabolism of different resistance rice cultivars, to explore the relationship between the rhizosphere soil microbial diversity and resistance to rice bacterial leaf streak. We collected the rhizosphere soil of plants CG2 and IR24 rice varieties in booting stage, using a variety of culture medium to cultivate bacteria isolation, purification, counting, and through the 16S rRNA homology comparison and phylogenetic tree analysis, and microbial metabolic function difference was studied by using Biolog. The results showed that 1057 single colony different varieties were isolated from the culture medium, andthey were divided into 15 types, 6 genera:,,,,,. Plate count in rhizosphere soil of different rice varieties of culturable bacteria showed bacillus was the dominant species in resistance cultivar CG2 and Arthrobacter was dominant species in the susceptible cultivar IR24. Shannon diversity index () and Shannon evenness index (), Simpson index (), McIntos index () and McIntosh evenness index () of the rhizosphere microbial community of resistance cultivar CG2 were increased by 8.80%, 48.49%, 11.76%, 41.88% and 0.52%, as compared to the susceptible cultivar IR24.The principal component analysis showed that the use of carbohydrates, amino acids, esters, alcohols, amine and acid were increasedby 12.52%, 66.53%, 3.78%, 7.49%, 27.98%, and 40.67% for the resistance cultivar CG2 rhizosphere soil microorganisms as compared with susceptible variety IR24. The research shows that the colony number and kind of the resistant cultivars CG2 rhizosphere soil bacteria are more than the susceptible cultivars IR24. The bacterial diversity is more abundant; the community structure is more stable; niche competition is stronger than pathogenic bacteria. The results can provide ideas and resources for the biological control of rice bacterial leaf streak.
rice leaf streak; rhizosphere microbial; community structure; metabolic function
10.14108/j.cnki.1008-8873.2019.01.003
X172
A
1008-8873(2019)01-017-09
2018-01-08;
2018-03-20
云南省科技厅农业基础研究联合专项项目(2017FG001-005); 国家重点研发计划(2018YFD0200308); 国家重点研发计划项目 (2018YFD0200703); 国家重点研发计划项目(2017YFC1702502); 国家自然基金(31460458).
杨俊( 1989—), 男, 云南楚雄人, 博士研究生, 从事植物微生物互作研究。729747016@qq.com
姬广海, 男, 博士, 教授,主要从事农业微生物微生物生态学研究 E-mail: jghai001@aliyun.com
杨俊, 王星, 付丽娜, 等. 水稻条斑病抗感品种根际微生物群落结构和功能分析[J]. 生态科学, 2019, 38(1): 17-25.
YANG Jun,WANG Xing, FU Li-na, et al. Study on rhizosphere microbial community and functional diversity of different resistant rice varieties to rice leaf streak disease[J]. Ecological Science, 2019, 38(1): 17-25.
