神经肽Y双侧室旁核显微注射在瘦素调节2型糖尿病大鼠交感神经活性和压力反射功能中的作用
2019-04-02李宝新郭淑芹董越华辛欢欢常文龙王翯李娜田茜张云良
李宝新,郭淑芹,董越华,辛欢欢,常文龙,王翯,李娜,田茜,张云良
(1保定市第一中心医院,河北保定 071000;2河北医科大学)
糖尿病与交感神经活性(SNA)增强均影响着高血压的发生和发展[1,2]。瘦素(LPN)是由白色脂肪分泌的一种神经内分泌因子,与肥胖、能量代谢等密切相关,能激活交感神经系统,使压力敏感性降低[3],与糖尿病和高血压的发生、发展密切相关。神经肽Y(NPY)为与动物摄食、能量平衡及肥胖等相关的神经递质,LPN参与机体能量的调节可能是通过下丘脑NPY实现的。LPN可与NPY神经元上的LPN受体结合,抑制NPY合成与分泌,脑室内输入LPN可抑制NPY的表达[4,5]。有研究报道,在侧脑室输注NPY可降低血压、心率及SNA[6]。因此,NPY可能参与LPN对糖尿病与高血压的调节机制,但其具体作用部位尚未明确,且对压力感受性反射功能影响尚不清楚。2016年4月~2017年10月,本研究探讨了NPY调节LPN对2型糖尿病大鼠SNA和压力感受性反射功能的影响。
1 材料与方法
1.1 实验动物、试剂及仪器 雄性SD大鼠20只,体质量220~250 g,购自北京维通利华实验动物技术有限公司,饲养于河北大学医学部实验动物中心SPF级动物室,室内通风良好,室温保持在18~20 ℃。基础饲料喂养,自由饮食饮水。适应性喂养1周后开始实验。Biopac MP100数据获得和分析系统(美国Biopac Systems公司),α-氯醛糖(美国Sigma公司),异氟醚(美国Sigma公司),瘦素(美国R&D Systems公司),NPYx(英国Tocris Bioscience公司)。
1.2 2型糖尿病模型的制备 实验期间给予20只SD大鼠高糖高脂饲料(常规饲料中加入20%蔗糖、15%熟猪油、2.5%胆固醇)喂养8周,禁食12 h后左下腹腔给予链脲佐菌素(0.1 mmol/L,柠檬酸钠配制,pH 4.2)30 mg/kg注射。于实验第9周末选取尾静脉空腹血糖≥7.8 mmol/L且伴有胰岛素抵抗者作为2型糖尿病动物模型[7],2只大鼠血糖未达标予以淘汰。
1.3 实验分组 将18只2型糖尿病大鼠依据室旁核显微注射人工脑脊液(aCSF)和NPY受体激动剂NPYx随机分为PVN-aCSF组和PVN-NPYx组,每组9只。
1.4 SNA和压力感受性反射功能观察 两组均予5%异氟醚诱导麻醉,氧气吸入后逐渐减为2%异氟醚维持。使用直肠热敏电阻监测,体温保持在(37±1)℃。气管插管保持人工通气,然后股动脉(1支)和股静脉(3支)导管植入用于监测动脉压和药物输注。在下腹部取正中切口,找到腰椎神经,应用轻量级有机硅材、双极不锈钢电极定位和液体胶定位和固定神经,以电脑显示出现神经传导信号为准,然后应用立体定位仪定位侧脑室和室旁核注射部位,大鼠需稳定60 min以上开始进行下述实验。①两组基础SNA、平均动脉压(MAP)、心率(HR)应用Biopac MP100数据获得和分析系统记录,2 000 Hz进行采样。SNA经带通滤过和放大,数据采集后SNA信号整合成1 s,以%表示。压力感受性反射曲线是静脉微量注射泵注射硝普钠使血压快速下降至50 mmHg,而后应用盐酸苯肾上腺素使血压缓慢上升,3~5 min升至175 mmHg,观察由血压、HR变化而形成的拟合S曲线。根据基础数值(SNA、MAP、HR),绘制基础压力感受性反射曲线。MAP、HR、SNA在反射曲线中的关系是应用Boltzmann方程进行比较的:HR或SNA=(P1-P2)/[1+exp(MAP-P3)/P4]+P2。P1是HR或SNA最大值(Max),P2是HR或SNA最小值(Min),P3是MAP在HR或SNA取中值时的血压(BP50),P4是宽度。baroreflex最大值、最小值和中点均在曲线图中标出。压力感受性反射功能变化由SNA压力反射曲线中的Max、Min和BP50来反映和表示[8]。②应用立体定位仪定位大鼠头部,使其暴露出扁平的头骨,使用前囟和硬膜的背表面为基准(计为零),带有细小管尖的单筒玻璃移液管用于侧脑室输注LPN(5 μg/h)。套管定位坐标如下(毫米前囟):尾1.0 mm,侧1.4 mm,背4.2 mm。输注1 h后(T1),绘制压力感受性反射曲线。实验结束后将2.5%阿利新蓝溶解在醋酸钠中注入100 nL,去除脑后发现脑室有染料存在,证实输注部位正确。③两组继续输注LPN的同时,使用微量玻璃移液管(管尖周径20~40 μm)在显微镜下进行室旁核药物注射,仍使用前囟和硬膜的背表面为基准(计为零),微量移液管进行坐标定位:尾侧1.8~2.0 mm,外侧0.5 mm,腹侧7.4 mm。双侧室旁核应用压射系统进行显微注射NPYx(0.5 mmol/L,60 nL)或aCSF(配制:氯化钠氯化钾2.6 mmol/L、氯化钙1.3 mmol/L、氯化镁0.9 mmol/L、碳酸氢钠20 mmol/L、磷酸氢二钠1.3 mmol/L、葡萄糖2.0 mmol/L,pH为7.4)注射60 nL。注射10 min后(T2),绘制压力感受性反射曲线。实验结束后同样应用2.5%阿利新蓝60 nL进行注射,取组织制成冷冻切片。应用标准解剖图谱确认部位正确。

2 结果
2.1 两组SNA、MAP、HR比较 见表1。
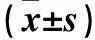
表1 两组大鼠SNA、MAP、HR比较
注:与本组基础时比较,*P<0.05;与本组T1时比较,△P<0.05;与PVN-aCSF组同期比较,#P<0.05。
2.2 两组压力反射功能参数SNA的Max、Min及BP50比较 见表2、图1。
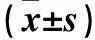
表2 两组交感神经压力反射功能参数SNA的Max、Min及BP50比较
注:与本组基础时比较,*P<0.05;与本组T1时比较,△P<0.05;与PVN-aCSF组同期比较,#P<0.05。
3 讨论
糖尿病与高血压的发病率逐年上升,二者相互影响[9]。LPN和NPY都与能量代谢、肥胖有关。有研究认为,NPY可能与高血压有关[10,11],而且,LPN对高血压和糖尿病均有影响[12],因此推测,二者可能共同参与影响高血压。SNA增加又是高血压发病的重要机制之一[13],所以它们可能对交感神经均有影响,但具体通过何种途径影响尚不清楚。本研究通过对2型糖尿病大鼠输注LPN观察SNA、HR、MAP等的变化,同时室旁核显微注射NPY激动剂NPYx,观察由LPN引起的交感神经的变化是否受NPYx的影响,探讨NPY在LPN调控SNA机制中的作用。
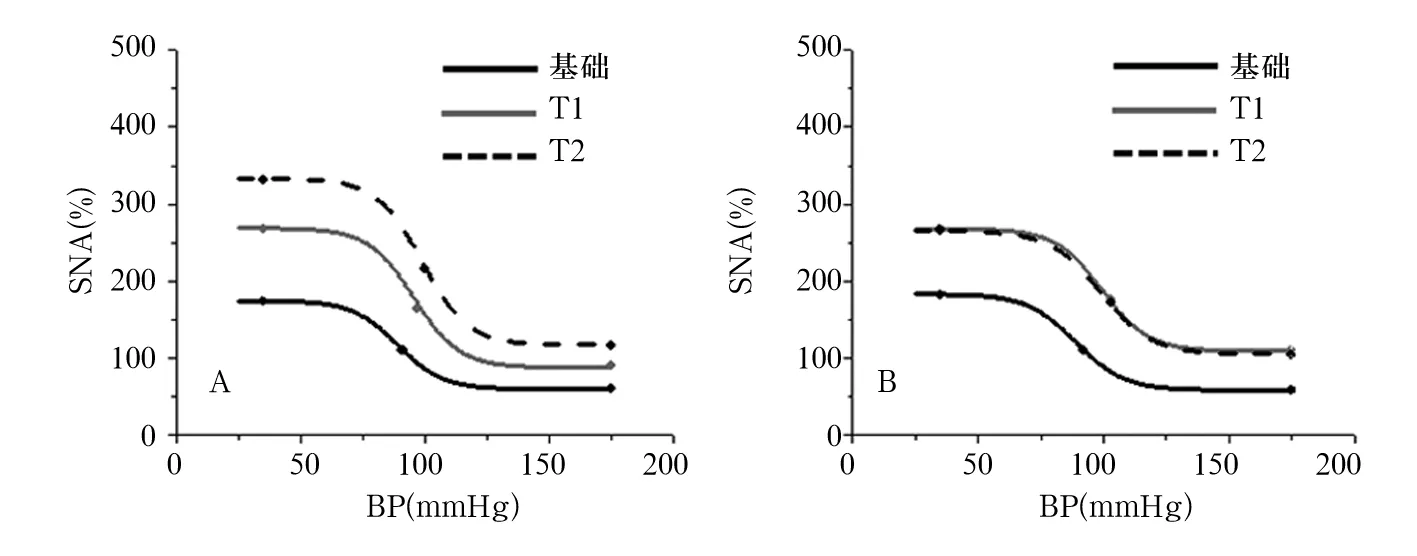
注:A为PVN-aCSF组;B为PVN-NPYx组。
图1两组SNA压力感受性反射曲线图
LPN由肥胖基因编码,脂肪细胞分泌,是一种由67个氨基酸组成的、相对分子质量约为16 kD的蛋白质类激素[14],它可以通过作用于中枢神经系统,激活交感神经系统、损害孤束核压力反射中枢而影响高血压的发生、发展[15];同时,它可通过中枢神经系统下行通路,抑制肝糖原异生,促进骨骼肌对外周组织摄取和利用血糖,降低升血糖的激素,改善胰岛素抵抗,从而降低血糖[16]。NPY是一种由交感神经节后神经元合成和分泌的含有36个氨基酸残基的多肽,它具有比去甲肾上腺素更强更持久的缩血管作用,并能增强血管对缩血管物质的反应,减弱血管对舒血管物质的反应,在高血压的发生发展中起重要作用[17];研究[18]发现无论高血压患者或是自发性高血压大鼠,其血浆中NPY的水平均明显升高。目前多个下丘脑核团已被确定为靶点可诱导LPN启动SNA增加,包括腹内侧下丘脑、弓状核、背内侧核和下丘脑外侧区,LPN也被证实在室旁核能使血压增加[19],但是否增加SNA及压力感受性反射功能尚未观察到。虽然LPN在许多脑区启动交感兴奋性效应,但这些效应均需与神经介导的LPN受体结合并可能投射至室旁核后方起作用。另有报道认为,室旁核可通过许多部位从而增加SNA,NPY受体亚型(Y1-R)在中枢系统广泛表达,室旁核也可表达Y1-R[20,21]。有研究报道,2型糖尿病大鼠下丘脑神经水平与LPN呈正相关性,LPN可与NPY神经元上的LPN受体结合,抑制NPY分泌,二者形成LPN—下丘脑NPY轴,参与摄食,影响糖脂代谢[22],这表明LPN可能参与调节下丘脑NPY水平,故本研究通过动物实验来探究NPY调节LPN对2型糖尿病大鼠SNA和压力感受性反射功能的影响。本研究结果显示:两组在基础及T1时输注LPN后SNA、MAP、HR值无明显统计学差异。在PVN-aCSF组中,与基础时相比,T1、T2时的SNA、MAP、HR值明显升高,以T2时最高。在PVN-NPYx组中,与基础时相比,T1、T2时SNA值明显升高,以T1时最高。提示LPN可使2型糖尿病大鼠的SNA、MAP、HR值升高。本研究结果还发现,PVN-NPYx组室旁核显微注射NPYx后的SNA、MAP、HR值较同时间段的PVN-aCSF组明显降低。说明室旁核注射NPYx后抑制了LPN对2型糖尿病大鼠的作用,由压力反射曲线可知室旁核注射NPYx后的曲线与1 h输注LPN后的曲线并未完全重合,推测NPY可能部分参与了LPN对2型糖尿病大鼠SNA的影响,且作用部位为下丘脑的室旁核。有研究报道,2型糖尿病大鼠下丘脑NPY与LPN受体水平呈负相关性[23],故我们推测可能NPY激动剂使NPY的活性大大增加,食欲增加,通过LPN—下丘脑NPY轴的负反馈调节作用,LPN分泌减少,同时LPN的受体水平下降,导致LPN无法与受体结合发挥作用,导致了LPN抵抗,进而部分抑制了LPN对2型糖尿病大鼠SNA的作用。
压力感受性反射功能对维持正常交感输出具有关键作用,反射功能低下可导致交感活动反射性抑制功能缺乏,从而导致交感输出的增加,即外周交感神经活动亢进[24]。高血压患者的压力反射感受功能均有一定程度的受损[25]。糖尿病早期已经发生了自主神经小纤维的神经病变,由于慢性血糖升高导致的自主神经功能和结构受损,胰岛素抵抗进一步加重了自主神经的损伤,导致糖尿病患者的压力反射感受功能比正常人降低。有研究表明,LPN可作用于中枢,增加SNA,进而降低压力感受性反射功能[26];亦有研究发现,随着血压分级的增高,2型糖尿病患者血清NPY水平逐渐增加,NPY水平升高可加重肥胖、胰岛素抵抗,同时对糖尿病患者的自主神经病变也有影响[27,28]。但NPY如何参与到LPN对2型糖尿病大鼠压力感受性反射功能的影响中尚不清楚。本研究根据Boltzmann方程中的各数值关系,选择交感神经压力反射功能参数Max、Min、BP50值的大小来反映压力感受性反射功能的变化。本研究结果显示,在PVN-aCSF组中,与基础时相比,T1、T2时Max、Min、BP50值明显升高;在PVN-NPYx组中,与基础时相比,T1、T2时Max值明显升高,PVN-NPYx组室旁核显微NPYx后的Max、Min值较同时间段PVN-aCSF组大鼠明显降低。表明NPY减弱了LPN增强2型糖尿病大鼠的压力感受性反射功能的作用。结合压力感受性反射曲线,1 h输注LPN后、室旁核显微注射NPYx后Max、Min、BP50值较基础时升高,但未降至基础时水平,进一步证实了NPY可能部分参与调控了LPN影响交感神经系统的途径。
综上所述,NPY双侧室旁核显微注射可逆转LPN增加2型糖尿病大鼠SNA的作用,减弱LPN增强2型糖尿病大鼠压力感受性反射功能的作用。
