洋葱花青素提取物的HPLC特征图谱构建及谱—效关系
2019-03-30肖瑞希王馨悦陈华国
肖瑞希 王馨悦 陈华国 周 欣
(1. 贵州师范大学贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 550001;2. 贵州师范大学贵州省药物质量控制及评价技术工程实验室,贵州 贵阳 550001;3. 贵州师范大学天然药物质量控制中心,贵州 贵阳 550001)
洋葱(AlliumcepaL.)为百合科草本植物,又名玉葱、球葱等,富含花色苷,具有很强的抗氧化活性、抗菌、预防心血管疾病、降血糖、降胆固醇等作用[1-3]。花青素(又称花色素)是广泛存在于植物中的一类可溶于水的天然色素,具有抗氧化、抗癌、抗衰老、降血糖、改善视力[4-6]等多种药理作用,成为众学者研究的热点。目前,对洋葱花青素提取物主要集中在提取、含量测定及活性的研究[7-8],但是其花青素提取物及其含量及部分生物活性的相关性研究较缺乏,本试验通过高效液相色谱方法,检测10个不同地区的洋葱花青素提取物的指纹图谱,确定共有峰,建立特征图谱;并通过Pearson相关分析及灰色关联度分析共有峰与其抗氧化活性及AChE抑制活性的相关性,探究谱—效关系,可较系统、整体地评价洋葱花青素提取物质量。结果显示不同地区洋葱花青素提取物共有峰的峰面积与含量、抗氧化能力、AChE抑制活性都有较好的相关性,可为洋葱花青素提取物的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
洋葱:分别购于广东(惠州)、山东(济南)、新疆(乌鲁木齐)、重庆、浙江(杭州)、福建(福州)、四川(成都)、山西(太原)、湖北(武汉)、江西(南昌)、贵州(贵阳);
高效液相色谱仪:Agilent 1260型,安捷伦科技有限公司;
Hypersil GOLD C18柱:250 mm × 4.6 mm,美国Thermo Scientific公司;
微量移液器:Eppendorf research plus型,德国Eppendorf 公司;
酶标仪:Spectra Max Plus 384型,美国Molecular Device公司;
冷冻干燥机:FD-80型,北京博医康实验仪器有限公司;
明澈纯水/超纯水系统:Millipore Milli-QA10型,法国Millipore公司;
万分之一天平:AL 204型,梅特勒-托利多仪器上海有限公司;
微波炉:EM-202MS1型,合肥荣事达三洋电器有限公司;
无水乙醇:分析纯,天津市富宇精细化工有限公司;
甲醇:分析纯,国药集团化学试剂有限公司;
盐酸:优级纯,国药集团化学试剂有限公司;
矢车菊-3-O-葡萄糖苷:纯度≥99%,贵州迪大有限公司;
乙腈:色谱纯,美国Tedia公司;
冰乙酸:分析纯,天津市致远化学试剂有限公司;
甲酸:分析纯,重庆茂业化学试剂有限公司;
ABTS:纯度≥98%,美国Sigma公司;
AChE:纯度≥99%,大连美仑生物技术有限公司。
1.2 试验方法
1.2.1 花青素提取制备
(1) 花青素的提取:根据参考文献[9]修改如下,将洋葱粉碎匀浆后,以1∶10 (g/mL)的料液比加入52%的乙醇溶液,微波提取4 min(功率469 W),3 500 r/min 离心5 min,取上清液,减压浓缩,冷冻干燥后得洋葱花青素粗提物置于干燥罐中存放,备用。
(2) 花青素的纯化:将洋葱花青素粗提取物加水稀释至浓度为0.75 mg/mL,HCl调节pH=1。将稀释后的提取物以5 BV/h的速度上聚酰胺树脂柱(60~100目)5 BV,3 BV纯水洗脱,再用pH=3的80%乙醇以5 BV/h 的速度洗脱3.5 BV,洗脱液经减压浓缩后真空冷冻干燥得到洋葱花青素提取物样品,置于棕色瓶中保存。
1.2.2 供试品溶液制备 精确称取纯化后各样品,加适量水复溶,配制成浓度为60 mg/mL的储备液,存于-20 ℃ 中。准确量取各样品储备液,加入适量纯净水,稀释后冷却至室温,0.45 μm的水相微孔滤过,即得。
1.2.3 对照品溶液的制备 准确称取矢车菊素-3-O-葡萄糖苷标准品4.46 mg,加入适量纯净水溶解,冷却至室温,定容至5 mL,0.45 μm的水相微孔滤过,即得。
1.2.4 花青素含量测定 取1 mL各样品溶液(以溶剂为空白)至10 mL比色管中,加入1%盐酸甲醇溶液5 mL显色,震荡摇匀,50 ℃水浴10 min,冷却至室温,于530 nm 处测定其吸光度值。以矢车菊-3-O-葡萄糖苷为对照品,按上述条件,测定对照品530 nm处吸光值(Ac)。根据式(1)计算样品中的花青素含量。
(1)
式中:
Ac——对照品的吸光度值;
As——样品的吸光度值;
Cc——对照品物质的量浓度,mg/mL;
Cs——样品物质的量浓度,mg/mL。
1.2.5 色谱条件 Hypersil GOLD C18柱(250 mm×4.6 mm,5 μm),流动相:1%的甲酸水溶液(A)—乙腈(B);0~10 min,92%~88% A;10~20 min,88%~86.5% A;20~25 min,86.5%~86.0% A;25~30 min,86.0%~83.5% A;30~60 min,83.5%~83.0% A;60~70 min,83%~60% A;70~80 min,60%~20% A;80~82 min,20%~92% A;进样量20.0 μL,柱温35 ℃,检测波长530 nm。
1.2.6 方法学考察
(1) 精密度考察:取适量贵州样品,按1.2.2所述方法制备供试品溶液,按1.2.5的色谱条件连续进样5次,检测得到液相色谱图,计算主要色谱峰的相对保留时间和相对峰面积RSD(%)值。
(2) 稳定性考察:取适量贵州样品,按1.2.2所述方法制备供试品溶液,按1.2.5的色谱条件分别在0,3,6,12,24 h进样,检测得到液相色谱图,计算主要色谱峰的相对保留时间和相对峰面积的RSD(%)值。
(3) 重复性考察:准确称取适量贵州样品5份,按1.2.2 所述方法制备供试品溶液,按1.2.5的色谱条件,分别制成供试品溶液进行分析,检测得到液相色谱图,计算主要色谱峰的相对保留时间和相对峰面积的RSD(%)值。
1.2.7 样品指纹图谱测定 按1.2.2所述方法制备供试品,采用1.2.5的色谱条件对不同地区的洋葱花青素提取物进行测定,记录色谱图。
1.2.8 清除DPPH自由基活性 根据文献[10]修改如下:称取9.86 mg DPPH溶于无水乙醇溶液中,定容至100 mL,现配现用。取40 μL不同批次的相同浓度样品溶液加至酶标板中,复孔3次,再加入DPPH溶液160 μL,于37 ℃ 避光反应30 min,以乙醇作对照,空白溶液以相同体积纯净水代替,在波长517 nm处测定吸光度,计算样品DPPH自由基清除率。
1.2.9 清除ABTS自由基活性 根据文献[11]ABTS自由基溶液由14 mmol/L ABTS溶液和5 mmol/L K2S2O8水溶液以1∶1的体积比混合后避光反应12~16 h,稀释20倍。样品溶液的制备,分别取50 μL不同地区的同浓度样品溶液加至酶标板,复孔3次,再加入200 μL ABTS自由基溶液混合均匀,室温避光反应6 min,于734 nm处测定吸光度值(Ai)。分别以200 μL水和相同体积的水代替ABTS溶液和样品溶液作为对照(Aj)及空白(Ao),测吸光度。根据式(2) 计算样品ABTS自由基清除率。
B=(Ao-Ai-Aj)÷Ao×100%,
(2)
式中:
B——ABTS自由基清除率,%;
Ao——空白吸光度值;
Aj——对照吸光度值;
Ai——734 nm处测定吸光度值。

(3)
式中:
C——AChE活性抑制率,%;
AUb——空白吸光度值;
AUo——空白组不加酶的吸光度值;
AUs——样品吸光度值;
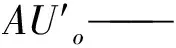
1.3 数据处理
采用Excel 2016、OriginLab OriginPro 8.5、IBM SPSS Statistics 21、DPS V15.10和SIMCA 14.1对试验数据进行统计分析。
2 结果与分析
2.1 含量测定
如图1所示,除贵州洋葱外其他10批次洋葱花青素提取物含量较为接近,其范围为0.3~1.2 mg/g,由于贵州地区的洋葱挑选的颜色较深,花青素含量相对较高,可达5.00 mg/g,而湖北地区洋葱花青素含量相对较低,不同地区样品中花青素含量存在差异,其洋葱花青素提取物含量大小依次为:贵州>山东>山西>广东>四川≈浙江≈重庆>福建>湖北>新疆>江西。

图1 不同地区洋葱花青素的含量Figure 1 The content of anthocyanins extrat in onion from different areas
2.2 方法学考察
2.2.1 精密度 共有峰相对保留时间及相对峰面积RSD值分别为:0.14%~0.31%,1.12%~2.62%(均<3.0%);符合指纹图谱的要求,仪器精密度良好。
2.2.2 稳定性 共有峰相对保留时间及相对峰面积RSD值分别为:0.21%~0.31%,0.83%~3.28%;符合指纹图谱的要求,该供试品溶液在24 h内其化学性质稳定。
2.2.3 重复性 共有峰相对保留时间及相对峰面积RSD值分别为:0.12%~0.18%,0.52%~1.78%;符合指纹图谱的要求,该方法重现性较好。
2.3 样品指纹图谱测定
采用“中药色谱指纹图谱相似度系统A(2004版)”以S4(贵州洋葱)为参照图谱,按照平均值生成对照图谱并设置时间窗为0.3进行自动匹配后生成指纹图谱,得到10个地区洋葱花青素提取物的HPLC指纹图谱,见图2。
2.4 特征图谱的构建
根据不同地区洋葱花青素提取物的指纹图谱及相对保留时间的特点,选择其共有峰且响应值较高的峰作为特征指纹峰,最终有1、2、3、5、6、12号峰可作为洋葱花青素提取物的特征峰,可初步认定这6个峰代表物质为洋葱中共有的花青素,其中1号峰为矢车菊-3-O-葡萄糖苷,特征图谱如图3所示,峰面积见表1。
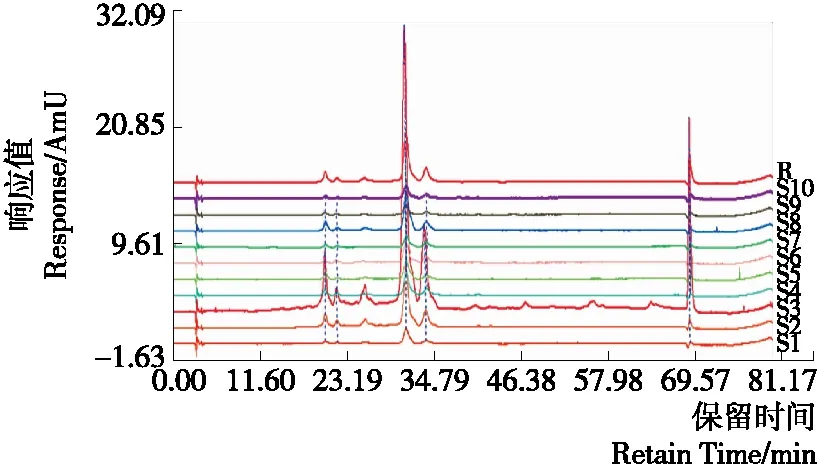
S1~S10分别代表福建、广东、贵州、江西 、山东、山西、四川、新疆、浙江、重庆
图2 不同地区洋葱花青素提取物的HPLC指纹图谱
Figure 2 HPLC fingerprint chromatogram of anthocy-aninsextrat in onion from 10 areas
2.5 相似度评价
不同地区洋葱花青素提取物指纹图谱与对照指纹谱图的相似度为0.986~0.997,均>0.9,符合指纹图谱的要求,结果见表2。
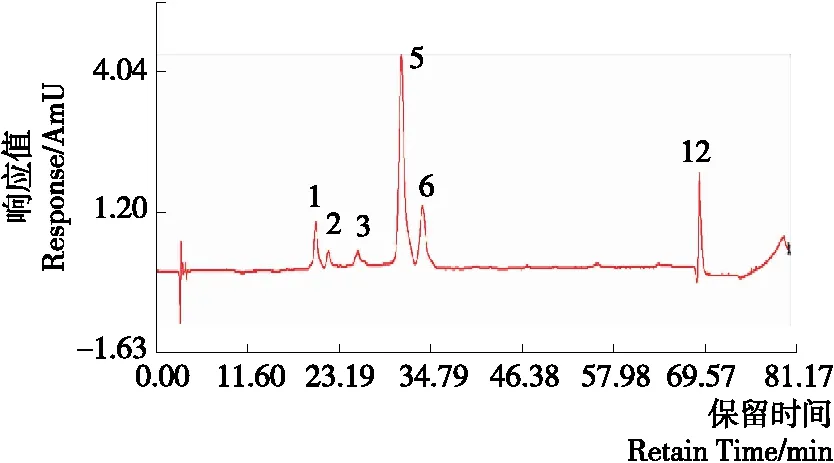
图3 洋葱花青素提取物的特征指纹图谱Figure 3 The characteristic fingerprint chromatogram of anthocyanins extrat in onion
2.6 生物活性的研究
2.6.1 抗氧化活性 由图4可知,11批洋葱花青素提取物(浓度10 mg/mL)的ABTS自由基清除率皆在50%以上,ABTS、DPPH 2种评价方法的趋势基本一致,其中广东和山东地区洋葱的差异较大,可能是不同地区洋葱中不同的花青素物质造成的,贵州、广东、新疆、重庆地区洋葱青素提取物的ABTS自由基清除率较高,分别为96.98%,85.03%,77.88%,70.88%,皆在70%以上。山东、山西、江西等7个地区的洋葱的ABTS自由基清除率在50%~70%。

表1 不同地区洋葱花青素提取物的HPLC指纹图谱6共有峰峰面积†Table 1 Six common peaks of HPLC fingerprint chromatogram of anthocyanins extrat from onion in 10 areas
† S1~S10分别代表福建、广东、贵州、江西、山东、山西、四川、新疆、浙江、重庆。

表2 洋葱花青素提取物指纹图谱相似度†Table 2 Similarity of fingerprints chromatogram of anthocyanins extrat in onion
† S1~S10分别代表福建、广东、贵州、江西、山东、山西、四川、新疆、浙江、重庆;S为对照图谱。

图4 洋葱花青素提取物抗氧化活性比较Figure 4 Comparison of antioxidant activities in anthocyanins extrat from onion
2.6.2 AChE制活性 如图5所示,11批洋葱花青素提取物(浓度10 mg/mL)的AChE抑制率大多在10%~20%,贵州地区的AChE抑制率最高为20%。湖北地区的最低为4.5%;其AChE活性抑制的大小顺序为:贵州>四川>江西>山西>广东>福建>山东>浙江>新疆>重庆>湖北。
同时从洋葱花青素含量及其生物活性研究可发现这11个地区中贵州地区洋葱颜色较深,其花青素含量、抗氧化活性及AChE制活性最高,颜色较浅的湖北地区洋葱花青素含量偏低,ABTS自由基清除率及AChE制活性也相对较低,说明样品的颜色深浅程度可能会影响花青素含量及其部分活性,这与已有研究[13]报道的结果相一致。
2.7 谱—效关系分析
2.7.1 Pearson相关性分析(PCA) 通过PCA建立10个不同地区洋葱花青素提取物特征图谱的共有峰峰面积、含量、DPPH自由基清除率和ABTS自由基清除率、AChE抑制率5个变量之间的关系,结果用Pearson系数来表示,见表3。
由表3可知,ABTS和DPPH 2种评价抗氧化活性的结果在0.05 水平(双侧)上显著相关,且相关系数为0.793,说明2种方法评价抗氧化能力结果一致;含量与6个色谱峰峰面积都有较好的相关性,且都在 0.05 水平(双侧)上显著相关,说明这6种物质是洋葱中的花青素主要物质;6个色谱峰的峰面积以及总花青素含量都与抗氧化能力呈显著正相关,与AChE抑制活性也有良好的相关性,说明这6种物质可能对抗氧化能力及AChE的抑制活性起主要作用。

图5 洋葱花青素提取物抑制AChE活性比较Figure 5 Comparison of AChE inhibitory activitives in anthocyanins extrat from onion

表3 洋葱相关性分析†Table 3 Correlation analysis of onion
† ** 表示在 0.01 水平(双侧)上显著相关;* 在 0.05 水平(双侧)上显著相关。
2.7.2 灰色关联度分析(GRA) 采用GRA分析洋葱花青素提取物特征图谱中各共有峰与其抗氧化活性、抑制AChE活性作用的关联度,探索洋葱花青素提取物特征图谱与其生物活性的联系。
由表4可知,DPPH、ABTS、洋葱花青素提取物含量、AChE抑制活性与其6个共有特征峰的峰面积的关联顺序分别为:X2>X3>X1>X5>X4>X6,X2>X3>X1>X4>X5>X6,X2>X5>X4>X1>X6>X3,X2>X3>X1>X5>X4>X6;4个因变量都与共有峰峰面积的关联系数都>0.77,说明6个共有峰峰面积对洋葱花青素提取物的生物活性有较强的关联性,生物活性均具有协同作用,2号、3号峰代表的洋葱花青素提取物对其活性起主要作用,其中2号峰代表的洋葱花青素提取物与花青素含量的关联性最强。
表4洋葱花青素提取物共有峰峰面积与生物活性关联度†
Table 4 The correlation between the area of onion common peak and biological activity
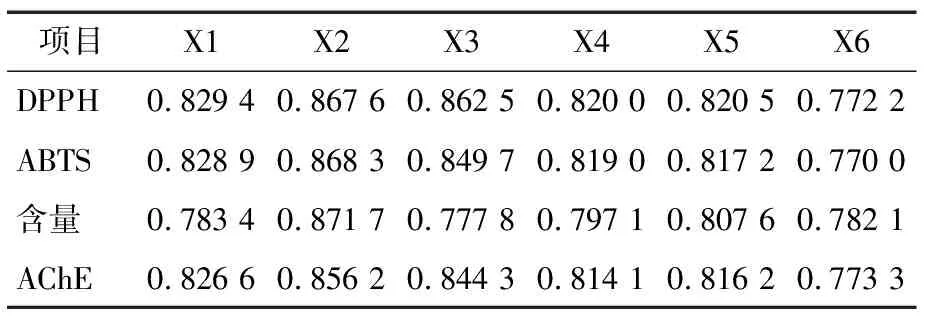
项目X1X2X3X4X5X6DPPH0.829 40.867 60.862 50.820 00.820 50.772 2ABTS0.828 90.868 30.849 70.819 00.817 20.770 0含量0.783 40.871 70.777 80.797 10.807 60.782 1AChE0.826 60.856 20.844 30.814 10.816 20.773 3
† X1~X6分别表示峰1、2、3、5、6、12。
3 结论
本研究采用HPLC色谱方法,建立10个地区的洋葱花青素提取物的指纹特征图谱,其指纹图谱与对照指纹图谱的相似度为0.986~0.997,均>0.9;确定了6个共有峰为特征吸收峰,可初步认定洋葱中含有6种共有的花青素提取物。体外活性试验检测洋葱花青素的抗氧化性及AChE抑制活性,每个地区的洋葱花青素提取物均有一定的抗氧化活性及AChE抑制活性;同时通过PCA和GRA初步探索洋葱花青素谱—效关系,发现洋葱花青素提取物共有峰的峰面积与含量、抗氧化能力、AChE抑制活性都有较好的相关性,可为洋葱花青素的利用及研究提供新参考。 洋葱中含有的6中共有花青素,其他5种花青素物质及其洋葱花青素在体内的活性等还有待研究。
