筋膜源性干细胞的分离和鉴定研究
2019-03-30史简铭田进翔辛超飞龚汉普常英健李广恒许建中
史简铭 田进翔 辛超飞 龚汉普 常英健 李广恒 许建中
(郑州大学第一附属医院骨科,郑州 450052)
骨关节炎在60岁以上的老年人群中的发病率达10%,而软骨自我修复的能力非常有限,加之老龄化的加剧,骨关节炎在各国的发病率逐年上升[1]。目前骨关节炎早期的治疗措施主要包括抗炎药物的使用、关节腔使用润滑剂;骨关节炎后期的治疗主要为外科手术治疗。近年来动物实验和临床研究显示间充质干细胞在骨关节炎治疗上具有良好的应用前景[2-4],间充质干细胞能够进行自我更新和具有多向分化的能力,而当前的研究中间充质干细胞的来源主要有骨髓源性干细胞、脂肪源性干细胞、滑膜源性干细胞等[5,6]。而骨髓源性干细胞的来源比较局限,取材时给患者造成一定创伤,且有感染的风险;脂肪源性干细胞虽来源丰富但其成软骨分化能力较弱,而近来研究虽然表明关节腔周围存在固有间充质干细胞,但是骨关节炎患者滑膜存在严重炎性改变,使其难以成为理想的来源[7]。本实验旨在探究鼠筋膜源性干细胞的分离,体外培养和鉴定,并在多向分化的潜能上进行研究,以明确筋膜源性干细胞是否具有诱导成软骨分化能力。
1 材料与方法
1.1 实验大鼠来源
本实验所用大鼠软骨细胞和筋膜源性干细胞均由SD 大鼠体内分离所得,大鼠来源于北京维通利华有限公司【SCXK(京)2016-0011】。实验大鼠均为SPF级,8周龄,体重约240 g,实验过程中对动物的处置符合赫尔辛基宣言动物伦理学标准。
1.2 主要试剂
DMEM/F12培养基(Gibco,11330-032),胎牛血清(Thermo Fisher,10099141),Ⅱ型胶原酶(索莱宝,C8150),胰酶(Thermo Fisher,25200056)PE标记的小鼠抗大鼠CD29 单克隆抗体(Thermo Fisher,25029180)、小鼠抗大鼠CD90 单克隆抗体(Thermo Fisher,12090081),FITI标记的小鼠抗大鼠CD45单克隆抗体(Thermo Fisher,11046180),APC 标记的小鼠抗大鼠CD71 单克隆抗体(Thermo Fisher,17071082),BMP4(Peprotech,12005)、TGF-β3(Peprotech,10036E),成脂诱导分化试剂盒(Cyagen,RASMD-90031),成软骨诱导分化基础培养液(CCM005,R&D systems),成软骨诱导分化添加剂(CCM020,R&D systems),流式细胞仪(BD FASCAria III),细胞计数仪(IC1000,上海睿钰公司),培养用显微镜(CKX53,OLYMPUS),离心机(湘仪L500,离心腔直径Ф320 mm,离心直径Ф300 mm)。
1.3 筋膜细胞的分离
将大鼠用10%水合氯醛腹腔麻醉过量处死,用电动剃须刀给予大鼠后肢备皮处理,将大鼠浸泡于75%乙醇溶液10 min,用吸水纸擦干大鼠表面的乙醇,转移至无菌操作台中,用无菌齿镊提起大鼠臀大肌表面的皮肤,用组织剪横行剪开,用组织剪钝性分离至臀大肌表面筋膜,用剪刀小心分离筋膜组织[8],取出后的筋膜组织用组织洗液(含有10%青链霉素)清洗数遍至筋膜组织呈现近似透明的絮状,把组织转移至10 cm培养皿中,并置于冰上,尽可能剔除血管、脂肪等组织,用眼科剪剪碎筋膜组织至糊状,用移液管转移剪碎的筋膜组织至15 ml离心管中,加入等体积的0.25%的Ⅱ型胶原酶,振荡混匀后于37℃恒温培养箱中消化1 h,每间隔30 min混匀振荡1次,后再加入0.2%的胰酶消化30 min,消化完成后转移至50 ml离心管中,用10倍体积的完全培养基(含10%的FBS)中止消化,中止消化后,1000 r/min离心5 min,离心机半径为15 cm,离心后去除上层悬液,用完全培养基重悬细胞,用100目的尼龙滤网过滤,滤过的细胞悬液接种在25 cm培养瓶中,置于37℃,5%CO2的恒温培养箱中,72 h后首次换液,以后每48 h换液1次,当细胞融合至70%的时候用0.25%胰酶消化后传至新的培养瓶中继续扩增培养。
1.4 软骨细胞的分离
取4只SD大鼠,过量麻醉处死后,浸泡于75%的酒精中30 min,在股骨近端处切下大鼠的双侧后肢,剪去皮层,置于50 ml 离心管中,用组织洗液反复洗涤数遍,在培养皿中打开大鼠的膝关节,用眼科剪,沿着软骨下分别减去股骨髁和胫骨平台,剪下的组织置于50 ml离心管中用组织洗液反复洗涤10遍,在无菌的培养皿中仔细分离剪下的软骨组织,把软骨周围的滑膜组织,软骨下骨彻底分离,收集取得的软骨,用手术刀片反复切取组织,直至组织变的粘稠状,转移至15 ml离心管中,加入0.15%Ⅱ型胶原酶3 ml,置入恒温培养箱中消化1 h,期间每隔20 min 振荡混匀一次,1 h 后加入0.25%胰酶2 ml 消化30 min,把消化后的组织倒入50 ml离心管中,加入带有血清的培养基20 ml中止消化,并用100目的滤网进行过滤,收集过滤后的液体,1000 r/min 离心5 min,离心机半径为15 cm,弃上清,用含有10%FBS 的DMEM/F-12 重悬细胞,重悬后接种至25 cm的培养瓶中,置于37℃,5%CO2的恒温培养箱中,当细胞融合至80%的时候常规消化后传至新的培养瓶中继续扩增培养。
1.5 筋膜源性干细胞生长曲线绘制
取第3、5、7代筋膜间充质干细胞,用完全培养基重悬,用全自动细胞计数仪计数,把细胞悬液浓度调整至1.5×105/ml,以每孔200 μl 接种于96 孔板内,96孔板周边各孔中加入200 μl 磷酸缓冲盐溶液(phosphate buffer saline,PBS),其中左侧边缘加入200 μl完全培养基,共接种6 块96 孔板,置于37℃,5%CO2、饱和湿度的细胞培养箱中培养。每日同一时间取1 块96孔板,每孔加入水溶性甲臢化合物19 μl,吩嗪硫酸甲酯(phenazine methosulfate,PMS)1 μl,继续放置培养箱培养,4 h后取出96孔板,于酶标仪中测定490 nm处的吸光度(A),取96 孔A 的平均值,以A 为纵坐标,时间(d)为横坐标绘制生长曲线。
1.6 筋膜源性干细胞表面免疫表型鉴定
取5 个1.5 ml 的离心管,每管中重悬第3 代的筋膜源性干细胞1×106,1000 r/min离心5 min,离心完成后弃上清,再次用50 μl的PBS重悬细胞,后将重悬的细胞悬液置于冰盒中,将适量PE 标记的抗CD29(Thermo Fisher,25029180)、CD90(Thermo Fisher,12090081)抗体,FITI 标记的抗CD45(Thermo Fisher,11046180)抗体,APC 标记的抗CD71(Thermo Fisher,17071082)抗体,分别用50 μl的PBS稀释混匀后加入对应的单细胞悬液中,其中空白对照组加入50 μl 的PBS,手指弹匀各管后,置于冰盒中避光孵育20 min,孵育后,各管中加入800 μl的PBS,1000 r/min离心5 min,弃上清,重复此操作1 次,后用500 μl PBS 重悬后上机检测,用NovoExpress软件分析结果。
1.7 筋膜源性干细胞的成脂诱导分化
使用成脂诱导分化试剂盒,取第2 代的脂筋膜源性干细胞消化重悬,按2×104/cm²的细胞密度接种在12孔板中,均分为诱导分化组与未诱导分化组,诱导分化组每孔加入1 ml 完全培养基,将细胞置于37℃、5%CO2的培养箱中进行培养,每隔3 d 换液,直到细胞融合度达到100%或者过融合;吸走完全培养基后向六孔板中加入2 ml 诱导分化A 液,诱导3 d 后更换成诱导分化B液,24 h后换回A液进行诱导,A液和B 液交替作用3 次,继续用B 液维持培养4 d,诱导分化完成;未诱导分化组采用常规完全培养基,吸走12孔板中的培养基,用PBS洗涤细胞2遍,后每孔中加入1 ml的4%中性甲醛固定细胞20 min,固定完成后用PBS洗涤3遍,后每孔中加入油红O 1 ml作用10 min,用PBS清洗3遍后在倒置相差显微镜下观察。
1.8 筋膜源性干细胞的成软骨诱导分化
取第3 代的软骨细胞、筋膜源性干细胞消化计数,取27 个15 ml 离心管,9 个标记为软骨细胞组(A组),18个标记为筋膜源性干细胞组,均分为B、C组,软骨细胞组(A组)离心管中各重悬2×105个软骨细胞,筋膜源性干细胞组(B、C)组离心管中各重悬2×105个筋膜源性干细胞,室温下1000 r/min离心5 min,离心机半径为15 cm,弃上清,软骨细胞组(A组)用5 ml常规完全培养基重悬,筋膜源干细胞组(B、C组)用5 ml的成软骨诱导分化基础培养液重悬,各组再次室温下1000 r/min 离心5 min,离心机半径为15 cm,弃上清后,软骨细胞组(A组)、筋膜源性干细胞C组用0.5 ml常规完全培养基重悬,筋膜源性干细胞B组用0.5 ml的诱导分化完全培养基(TGF-β3 10 ng/ml,BMP4 100 ng/ml)重悬[9,10],再次室温下1000 r/min离心5 min,离心机半径为15 cm,保留培养基,拧松各离心管盖子,垂直放在37℃,5%CO2培养箱中,每隔2 d 更换诱导分化培养基,于诱导分化的第28 天收取培养的细胞团块,获取的细胞团块用4%中性甲醛固定24 h,24 h后用尺子测量所获取的细胞团块大小,并进行统计分析,测量后用被酒精浸泡过的擦镜纸包裹细胞团块,置于包埋盒中,伊红染液中浸泡1 min,用PBS清洗2 遍后进行梯度脱水(75%、85%、95%、100%乙醇溶液各5min)、透明、浸蜡、包埋等步骤。将包埋好的细胞团块6°冷台预冷,调整切片机层厚为4 μm 进行切片,切片后做免疫组化染色,通过Image J软件进行对3D pellet 切片进行免疫组化显色后的半定量分析,以经鉴定培养的软骨细胞作为对照。
1.9 统计学方法
采用SPSS 22.0 软件进行统计分析,计量资料以均数±标准差表示,所有数据用Levene检验方法进行方差齐性分析,多组数据采用单因素方差分析(ANOVA),对方差分析有意义者行Bonferroni 法进行两两比较,检验水准α=0.05,以P<0.05 为差异有统计学意义。
2 结果
2.1 分离培养的细胞形态学观察
筋膜源性干细胞分离接种后48 h,可见细胞贴壁生长,细胞呈多角形、长梭形,原代细胞在7 d 达到70%融合,细胞传代后成漩涡状生长,3 d达90%融合(图1)。
分离培养的原代软骨细胞呈圆球形,悬浮状态,接种后24 h 开始贴壁,48 h 大部分贴壁伸展,呈多角形、短梭形、三角形,72 h 大部分贴壁,分裂增殖加快。约8 d 汇合成单层铺满整个培养皿底面。传代后生长速度加快,约4 d 左右即可传代,细胞周围可见具有折光性的细胞外基质,细胞长成一片呈明显铺路石样外观(图1)。

图1 分离培养的细胞形态学观察及筋膜源性干细胞的生长曲线
2.2 筋膜源性间充质干细胞的生长动力学分析
根据生长曲线图可见,第3代与第5代间充质干细胞增殖能力差别不大,一般有2 d左右的潜伏期,随即进入对数生长期,5~7 d后进入平台期。第7代细胞的增殖能力较前代降低,在5~6 d进入平台期(图1)。
2.3 筋膜源性干细胞表面免疫表型特征
间充质干细胞表达CD29、CD44、CD71、CD90 等基质细胞和间质细胞的特异性标志抗原,而不表达CD34、CD45、CD14 等特异性表面抗原。此次选择CD29、CD45、CD71、CD90 进行流式细胞仪检测,其中,筋膜源性干细胞表面CD29 呈阳性表达、筋膜源性干细胞表面CD71呈阳性表达、筋膜源性干细胞表面CD90 呈阳性表达,而筋膜源性干细胞表面CD45呈阴性表达,这一结果也显示了分离的筋膜细胞具有间充质干细胞的特性(图2)。
2.4 筋膜源性干细胞的成脂肪诱导分化
诱导分化12 d 后可见部分细胞胞质中出现透亮的微小折光性好的颗粒,并且相互融合,经油红O 染色后呈现红色(图3)。
2.5 筋膜源性干细胞的成软骨诱导分化
3D pellet培养后,筋膜源性干细胞诱导分化组随着诱导时间的延长,pellet 变圆,变白,形成的团块形状与软骨细胞相近,而未经诱导分化培养基诱导的筋膜源性干细胞pellet 小球,较小且无光泽(图4A~C);软骨细胞组和筋膜源性干细胞诱导分化组的细胞团块经石蜡切片后进行软骨标志物Ⅱ型胶原蛋白免疫组化显色,显微镜下显示:Ⅱ型胶原蛋白含量丰富,软骨细胞数量较多,团块边缘连续、清晰,而单纯的筋膜源干细胞组显微镜下显示其软骨细胞稀疏,II型胶原蛋白含量低,细胞团块边缘连续性差、清晰度低(图4)。3个细胞组的细胞团块直径之间的差别有统计学意义(F=10.07,P=0.0004),进一步两两比较,软骨细胞组与筋膜源性干细胞诱导分化组的细胞团块直径之间的差异无统计学意义(P>0.05),软骨细胞组与筋膜源性干细胞组、筋膜源性干细胞诱导分化组与筋膜源性干细胞组的细胞团块直径差异有统计学差异(P<0.01)。随后对各组pellet 的石蜡切片用免疫组织化学法检测Ⅱ型胶原蛋白的表达,并用Image J 对各组结果分析,软骨细胞组平均光密度值大于筋膜源性干细胞诱导分化组、筋膜源性干细胞组(P<0.05),筋膜源性干细胞诱导分化组平均光密度值大于筋膜源性干细胞组(P<0.05,表1)。
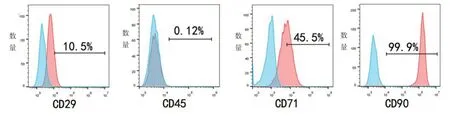
图2 筋膜源性干细胞免疫表型的单参数直方图
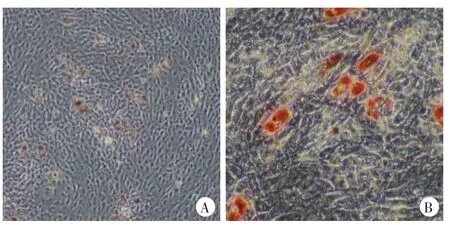
图3 光镜下成脂肪诱导分化的筋膜源性干细胞
3 讨论
当前,组织工程技术的发展突飞猛进,但在骨与关节疾病方面组织工程细胞的来源相对比较局限,骨髓间充质干细胞、脂肪干细胞、滑膜干细胞是应用相对较多的种子细胞[8,11-13]。但在取材和分离方面风险较多,为利用带来了诸多难题[14-16]。
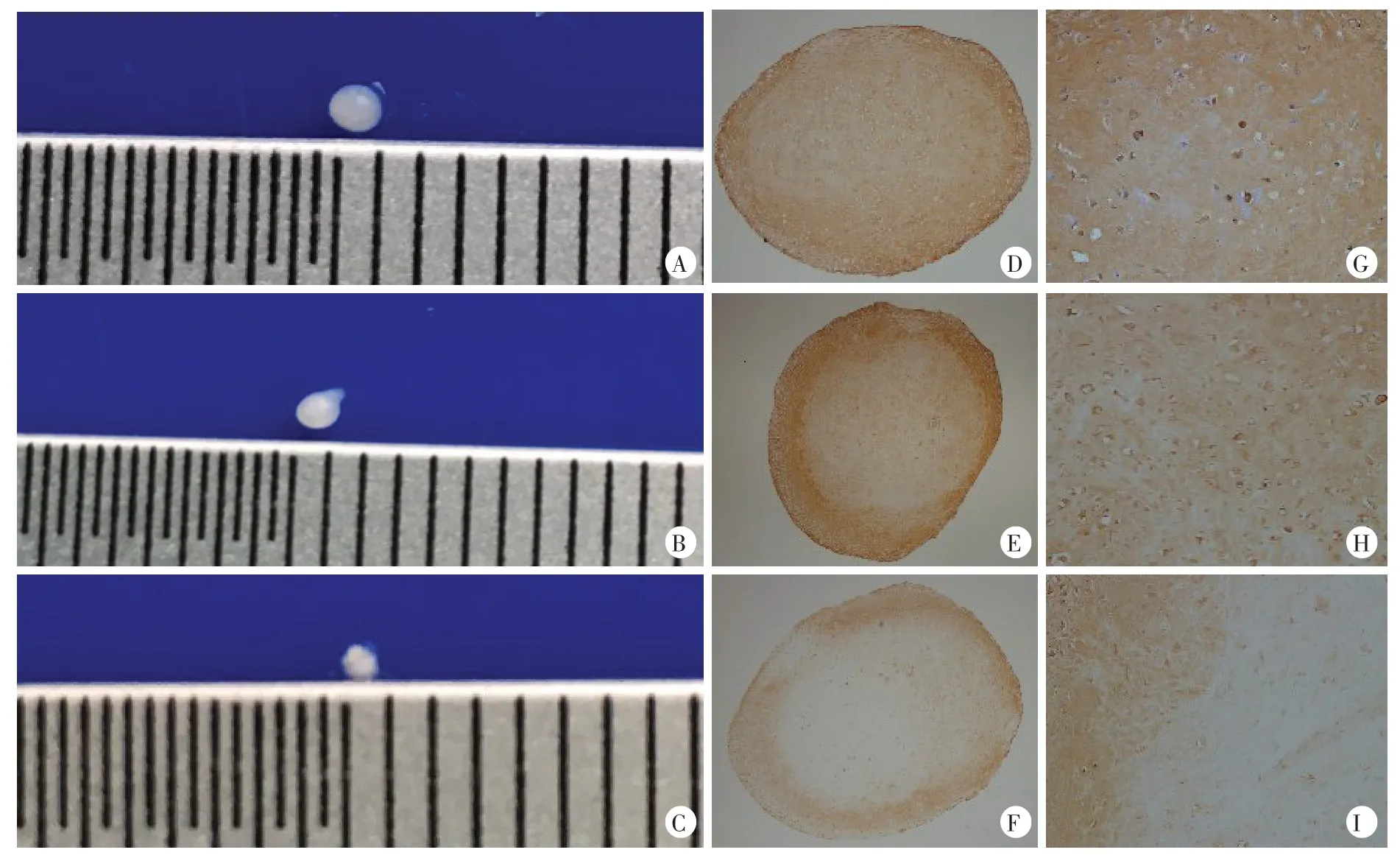
图4 3D pellet 培养至28 d的3组细胞团块大体观及细胞团块石蜡切片后进行软骨标识物Ⅱ型胶原蛋白免疫组化显色在40倍和200倍的显微镜下观
间充质干细胞治疗骨关节炎是一种新的选择,骨髓基质细胞、滑膜基质细胞、骨膜分离的细胞、脂肪干细胞等在体外成软骨诱导分化培养基中均可以见到软骨组织的形成[17,18],但由于成分复杂,纯化起来相对困难;间充质干细胞的获取到应用相对受限,本研究从大鼠的骨骼肌筋膜中分离出筋膜源性细胞,通过体外3D pellet培养,并在培养基中添加BMP4和TGF-β3进行体外诱导分化,诱导分化培养下形成透明的软骨组织,在外观上与正常软骨组织接近,形成的软骨组织经软骨细胞特异性Ⅱ型胶原蛋白的免疫组化检测,糖胺聚糖的番红O 染色、阿尔新兰染色均显示软骨形成的特性,且筋膜源性细胞表达CD29、CD90、CD71,而不表达CD45,本研究证实了从骨骼肌筋膜分离出的非肌源性细胞具有成软骨分化的能力,筋膜源性细胞与从骨骼肌中分离的肌源性干细胞不同,筋膜源性表达间充质干细胞表面分子,而极少表达内皮细胞表面分子;筋膜源性细胞从包裹骨骼肌的筋膜中很容易分离,这也使得其成为软骨修复可能的间充质干细胞来源。间充质干细胞治疗骨关节炎的机制目前还没有得到充分的解释[19,20],目前广泛接受的合理解释有2个方面,其一是移植的间充质干细胞能够分化为软骨细胞并充填于软骨缺损处[21],其二是移植的间充质干细胞能够通过旁分泌方式分泌一些细胞因子参与调节关节腔的微环境[22-26]。筋膜源性干细胞的取材来源较广,分离难度及风险相对较低,有较强的成软骨分化能力,且体外培养时具有较强的增殖能力,这为其日后进行软骨修复提供了可能,也为体外大量扩增培养提供可能。
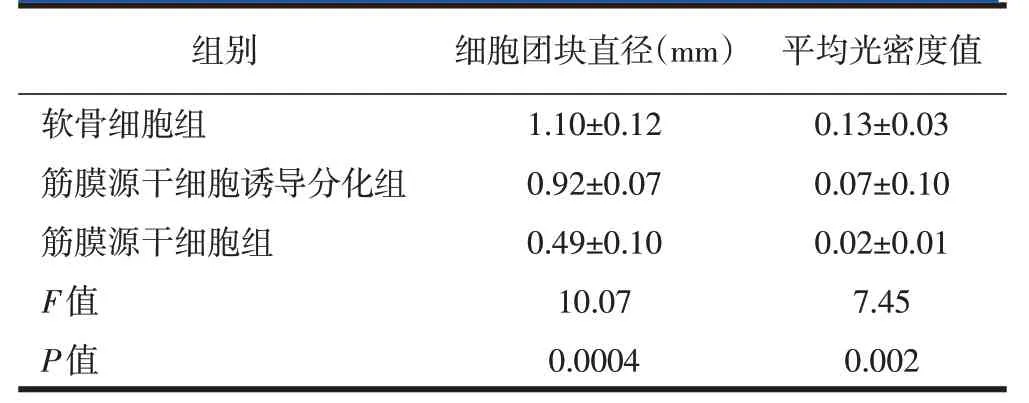
表1 各组细胞团平块均直光径密和度石值.(蜡n切=9片,x免±s)疫组织化学染色
目前将间充质干细胞与其他相关生物材料或生物制剂结合治疗骨关节炎已成为越来越引人注目的研究方向,例如将间充质干细胞与生物支架或生物材料相结合协同治疗骨关节炎[27];间充质干细胞以不同种类、不同比例搭配混合治疗骨关节炎[28];以及间充质干细胞与富含血小板的血浆协同改善骨关节炎等[29],间充质干细胞已经体现出了其在骨关节炎治疗上的前景,而在临床实践中广泛使用之前,仍有许多问题需要解决,这要求科研工作者们继续发掘对比不同来源的间充质细胞及其效果[30],筋膜源性干细胞的分离和鉴定正与此要求相符,为其提供了另一种选择及新的研究思路,丰富了细胞治疗骨与关节疾病的细胞来源,在组织工程中具有很大的应用前景。
