四氢姜黄素对H22腹水瘤模型小鼠的防治作用
2019-03-29俞斐章浙忠陈琳鲁遥
俞斐 章浙忠 陈琳 鲁遥
作者单位:310000 浙江中医药大学附属第一医院
原发性肝癌(primary liver cancer,PLC)是临床上最为常见的消化道恶性肿瘤之一,起病隐匿,病死率高,在肿瘤致死原因中位居第二位[1]。绝大数患者确诊时已为中晚期,从而失去了外科手术治疗的机会而采用化疗,但不良反应较多[2]。姜黄素(CUR)自从被报道具有抗癌活性以来,广泛受到国内外学者的关注。现代药理研究表明,CUR可抑制癌细胞的生长,在肿瘤的治疗方面,CUR的作用显著。但由于其水溶性和稳定性差,在肠道易发生葡萄糖醛酸转移酶介导的Ⅱ型代谢,口服后在体内代谢快,血药浓度较低,生物利用度差,严重地限制了其临床应用[3]。四氢姜黄素(THC)作为姜黄素的体内代谢产物,本实验对THC进行抗肿瘤活性评价及其初步的机制探讨,为更好的开发和利用姜黄素类化合物的药用价值提供实验依据和研究基础。
1 材料与方法
1.1 动物及肝癌细胞株 健康雄性昆明KM小鼠90只,体质量(20±2)g,浙江中医药大学动物实验中心提供;小鼠腹水型H22肝癌细胞株购于中国科学院上海细胞库。
1.2 主要试剂与仪器 THC购于国药集团化学试剂有限公司;环磷酰胺(CTX)购于上海国药控股有限公司;冰醋酸、Tween-80购于广东光华化学厂有限公司;蛋白定量试剂盒购于上海贝博生物科技有限公司。AR1140电子天平(美国奥豪斯公司);SW-CJ-1F超净工作台(苏净集团安泰公司);DHG-9023A电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.3 方法 (1)药物剂量设计:本节实验研宄中(除了用以初步探讨作用机制的H22腹水瘤小鼠模型),雄性KM小鼠被随机分成6组,每组各10只。所有小鼠在实验前适应性饲养7d。正常组(Intact)和模型组(Vehicle)给予预防药物的相应溶剂(0.5%Tween-80),预防给药组小鼠给予低、中、高剂量的THC(5、10、20mg/kg)、环磷酰胺(CTX,30mg/kg),按0.1ml/10g体重给药1次/d,连续给药7d。(2)小鼠造模:将H22腹水瘤细胞冻存管从液氮罐中取出,置于37℃的温水中使其融化,然后用吸管吸取适量细胞悬液至离心管内,加入10倍量无菌PBS缓冲液,混匀后于台式离心机中离心5min(1000r/min),弃去上清液,收集H22细胞,重复清洗操作三次;之后用无菌PBS缓冲液调整为1×107/ml的细胞悬液,取100μl置于1ml EP管内,向其中加入等体积的0.4%台盼蓝染液,混匀后通过显微镜观察,利用台盼蓝拒染法进行细胞计数,观察H22细胞的存活率。经观察后计算,细胞存活率>96%。随后向每只小鼠腹腔注射H22细胞悬液0.2ml复制H22腹水瘤小鼠模型(相当于瘤细胞数2×106/只),正常组除外。
1.4 H22腹水瘤模型小鼠生存周期实验 小鼠腹水瘤造模成功24 h后,将KM小鼠随机分为6组:空白对照组,模型对照组,阳性对照(CTX)组,THC低、中、高剂量组,每组各10只,除阳性对照(CTX)组腹腔注射(0.1ml/10g)给药外,其余各组灌胃给药1次/d,连续7d,每日观察各组小鼠生活、饮食情况以及毛色等外观状况,统计各组小鼠的生存周期,比较各组之间的差异。
1.5 细胞计数分析仪检测细胞活力与Western Blot检测蛋白表达 鼠腹水瘤造模成功24h后,将KM小鼠随机分为3组:模型对照组、阳性对照(CTX)组和THC(20mg/kg)组,每组各10只,除阳性对照(CTX)组腹腔注射给药外,其余各组灌胃给药,按0.1ml/10g体重给药1次/d,连续给药7d。每次灌胃前,测量统计各小组的体重。末次给药1h后,脱颈处死各组小鼠,用无菌注射器抽取每只小鼠的腹水,取200μl用PBS缓冲盐溶液处理后,立即检测其细胞活力(全自动细胞计数分析仪),另外腹水收集后采用Western Blot检测H22腹水瘤细胞中的Bax、Bcl-2的蛋白表达水平。取各组小鼠的胸腺和脾脏组织,精密称重后记录各组小鼠的免疫脏器重量。
1.6 统计学方法 采用SPSS22.0统计软件。计量资料以(±s)表示,各组间的差异比较采用方差分析(One-way ANOVA),实验结果以P<0.05表示差异有统计学意义。
2 结果
2.1 THC对H22腹水瘤模型小鼠生存周期的影响 THC对H22腹水瘤小鼠生存周期的影响如图1所示,在接种H22腹水瘤细胞4~5 d后,各组小鼠饮食和活动均开始减少,腹部开始出现膨胀,喜欢群居和蜷卧,体重也明显增加。与模型组相比,THC(5、10、20mg/kg)给药组能延长小鼠的生存周期,平均生存时间随着给药剂量的升高而提高,且与模型组差异显著(THC低剂量组:P<0.05,其余各组:P<0.001),结果提示,THC能显著延长小鼠的生存周期。因此,在后续实验中,选取THC的高剂量组(20 mg/kg)对H22腹水瘤小鼠模型进行初步的机制探讨。
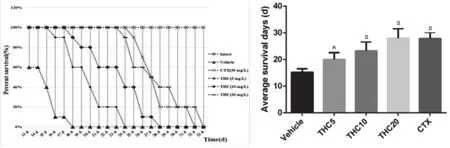
图1 THC对H22腹水瘤模型小鼠生存周期的影响(n=10,⋆P<0.05,#P<0.001)
2.2 THC对H22腹水瘤模型小鼠体重及腹水瘤细胞活力的影响 如图2、3所示,给小鼠接种H22腹水瘤细胞后,小鼠的体重显著上升,与模型组小鼠相比,THC在第5天后能明显抑制小鼠的体重(5~7d,P<0.001);与模型组相比,THC治疗后H22腹水瘤细胞活力显著下降(P<0.001),提示THC对小鼠恶性腹水有抑制作用。
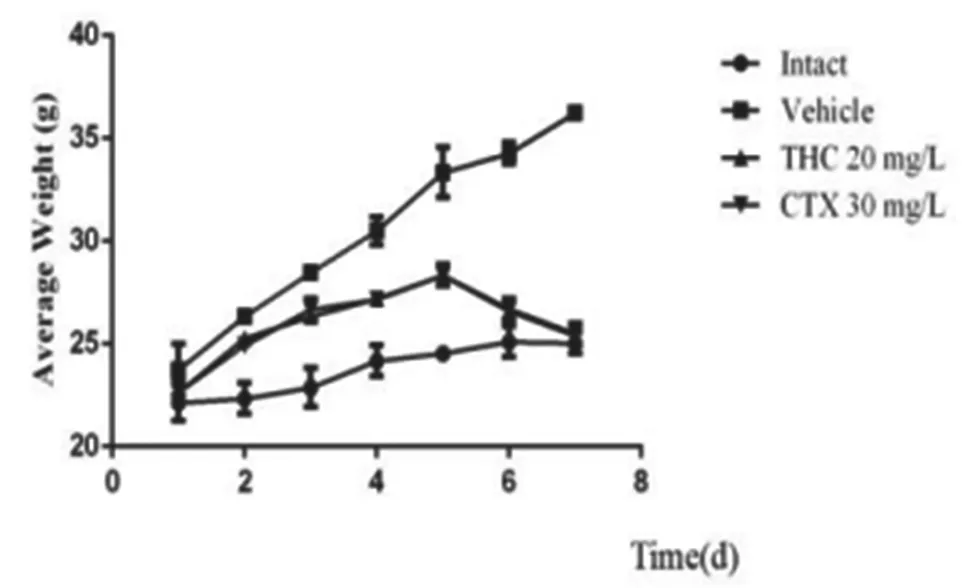
图2 THC对H22腹水瘤模型小鼠体重的影响
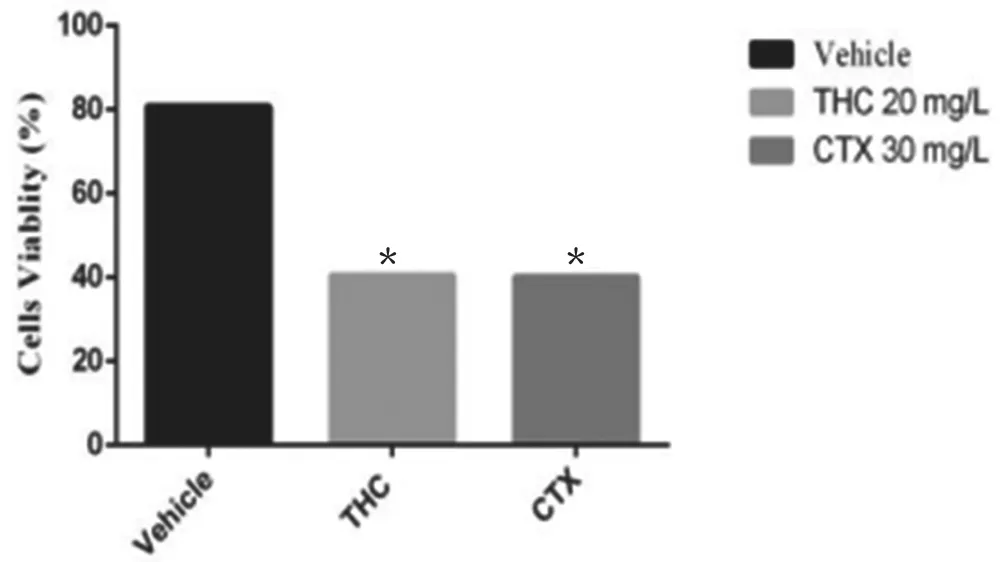
图3 THC对H22腹水瘤细胞活力的影响(n=10,⋆P<0.05,⋆⋆⋆P<0.001)
2.3 THC对H22腹水瘤模型小鼠免疫器官的影响 THC对腹水瘤小鼠免疫脏器的影响如图4所示,由图可知与空白组小鼠相比,接种H22腹水瘤细胞后小鼠的免疫器官无明显影响,而在给予THC干预后,小鼠的脾脏指数和胸腺指数也均无明显变化,表明给予THC后对小鼠的免疫器官无明显影响;相反,给予阳性药CTX治疗后,小鼠的脾脏指数(P<0.001)和胸腺指数(P<0.001)均显著下降,表明阳性药CTX可能对小鼠的免疫器官有毒副作用。
2.4 THC对H22腹水瘤模型小鼠Bax、Bcl-2蛋白表达水平的影响 THC对腹水瘤小鼠Bax、Bcl-2蛋白表达的影响如图5所示,在分析统计各组小鼠条带的灰度值后发现,THC给药组与模型组小鼠相比能显著提高Bax的蛋白表达(均P<0.01)和抑制Bcl-2的蛋白表达含量(均P<0.01),提示THC可能参与了Bcl-2介导的线粒体凋亡通路并能改善Bcl-2体系的蛋白表达。
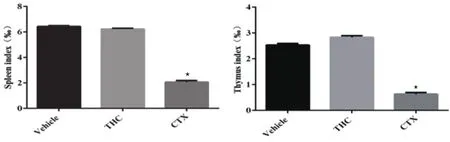
图4 THC对H22腹水瘤模型小鼠免疫器官的影响(n=10,⋆P<0.001)
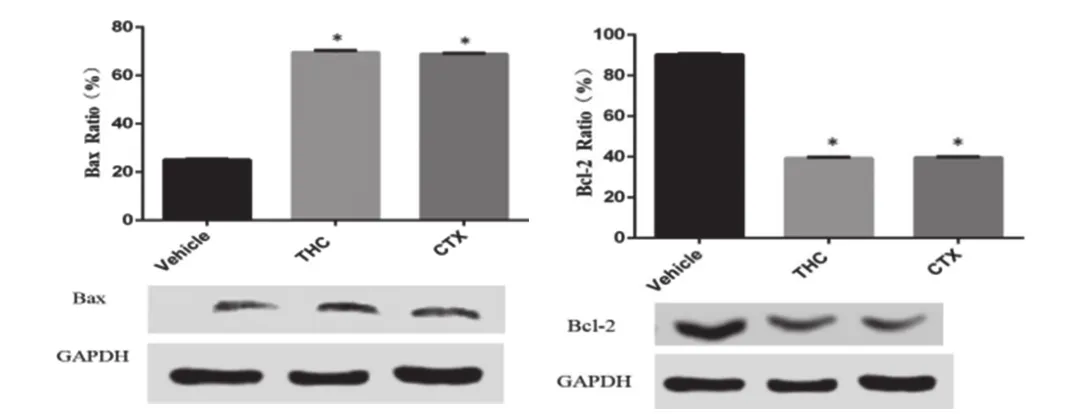
图5 THC对H22腹水瘤模型小鼠Bax、Bcl-2蛋白表达水平的影响(n=3,⋆P<0.01)
3 讨论
在H22腹水瘤模型小鼠生存周期实验中,THC能显著延长小鼠的生存周期。而在后面对各组小鼠的体重、细胞活力和免疫器官指数进行统计分析的时候发现,THC能有效抑制腹水瘤小鼠体重,抑制小鼠腹水细胞的活力,与阳性药CTX相比THC不影响小鼠体内的免疫器官,提示THC基本无毒副作用。因此在后续的实验中,初步探究THC对H22腹水瘤模型小鼠的作用机制。
细胞的增殖和凋亡的动态平衡与肿瘤的发生发展密切相关。许多蛋白在细胞凋亡的发生和发展过程中发挥了重要的作用[4]。Bcl2家族蛋白是细胞内一组结构上同源功能上相关的蛋白。主要分为两大类:一类是抑制细胞凋亡,如Bcl2、Bcl-xl等;另一类是促进细胞凋亡,如Bax、Bcl-xs等。其中Bcl2、Bax的表达为代表。Bcl2和Bax蛋白水平表达的高低,与细胞凋亡直接相关。Bax和Bcl-2通过形成同源或异源二聚体来调节细胞凋亡,当Bax形成同源二聚体时诱导细胞凋亡;Bax与Bcl-2形成异源二聚体时则实现了Bcl-2抑制细胞凋亡的功能。这与本实验研究中发现THC给药组与模型组小鼠相比能显著提高Bax的蛋白表达(均P<0.01)和抑制Bcl-2的蛋白表达含量(均P<0.01)的结果类似。更多的临床研究表明,多种不同类型的肿瘤均出现了Bax蛋白水平表达下降,Bcl2表达升高的现象,其两者比例决定了细胞凋亡的走向。若Bcl-2/Bax比例增高,则抑制细胞凋亡,反之,则促进细胞凋亡[5]。
在本实验H22腹水瘤模型小鼠的实验研究中发现THC能提高腹水瘤小鼠的生活质量和生存周期,降低小鼠的体重和腹水量。进一步的机制研究表明THC能够通过上调Bax蛋白水平,下调Bcl-2蛋白水平,提示THC可通过调节凋亡相关蛋白而抑制H22腹水瘤的生长,从而为四氢姜黄素的进一步研究提供理论基础。
