DNA甲基转移酶在胃癌中的表达及其意义
2019-03-28王震凯杨晓倩叶雅沁韦志琴范青青汪芳裕
王震凯 杨晓倩 叶雅沁 韦志琴 顾 燕 范青青 刘 丹* 汪芳裕
南京中医药大学附属南京中医院内镜中心1(210008) 福建卫生职业技术学院2 东部战区南京总医院消化内科3
背景:DNA甲基化在胃癌发生、发展中起重要作用,但DNA甲基化需要DNA甲基转移酶(DNMTs)的修饰。目的:探讨DNMTs在胃癌发生、发展中的作用及其临床意义。方法:采集80例胃癌组织及其癌旁正常组织,以免疫组化法检测DNMT1、DNMT3a、DNMT3b蛋白表达,并分析其与胃癌临床病理特征的关系。采用qRT-PCR和蛋白质印迹法分别检测4种胃癌细胞株和正常胃黏膜上皮细胞株中DNMT1、DNMT3a、DNMT3b mRNA和蛋白表达。结果:与癌旁组织相比,胃癌组织中DNMT1阳性表达率显著升高(68.8%对10.0%,P<0.01)。胃癌组织中DNMT1阳性表达率显著高于DNMT3a和DNMT3b(68.8%对38.8%、40.0%,P<0.05),而癌旁组织中DNMT1阳性表达率显著低于DNMT3a和DNMT3b(10.0%对60.0%、52.5%,P<0.05)。DNMT1阳性表达与胃癌浸润深度、淋巴结转移以及TNM分期明显相关(P<0.05),而DNMT3a和DNMT3b与胃癌临床病理特征均无关。与正常胃黏膜上皮GES-1细胞相比,胃癌细胞株中DNMT1 mRNA和蛋白表达明显增加,而DNMT3a和DNMT3b mRNA和蛋白表达明显降低。DNMT1表达与胃癌细胞分化程度有关(P<0.05)。结论:DNMT1可能在胃癌的发生、发展中起有重要调节作用。
胃癌是最常见的消化道肿瘤之一,30%~50%的患者确诊时已存在微转移灶或临床可检出的转移灶。因此,早期发现、早期诊断仍是治疗甚至治愈胃癌的关键。近年,表观遗传学与肿瘤发生的相关性研究已成为肿瘤病因学研究的重要内容,其中DNA甲基化修饰为肿瘤发病机制的研究开辟了新的领域和思路。目前越来越多的研究证实,抑癌基因启动子区CpG岛高甲基化参与了肿瘤的发生、发展过程[1-3]。DNA甲基化修饰须依赖DNA甲基转移酶(DNA methyltransferases, DNMTs)的催化作用,因此DNMTs是调控靶基因甲基化水平的关键因素。本研究通过比较胃癌及其癌旁组织、胃癌细胞株和正常胃黏膜上皮细胞株中DNMTs的表达差异,旨在探讨DNMTs在胃癌发生、发展中的作用及其临床意义。
材料与方法
一、材料来源
选取2012年1月—2015年1月南京总医院确诊的80例胃癌组织及其相应癌旁正常组织(距肿瘤组织2 cm处),所有组织均在外科手术或内镜黏膜下剥离术(ESD)过程中获取,并经病理学检查明确诊断。其中男63例,女17例;年龄31~82岁,平均56岁。本研究方案获得南京总医院伦理委员会审批通过,且取得患者或其家属知情同意。人胃癌细胞株MKN-45(低分化)、AGS(高分化)、MKN-28(中分化)、HGC-27(未分化)和正常胃黏膜上皮细胞株GES-1均购自中国科学院细胞库。
二、主要试剂
抗DNMT1鼠抗人抗体、抗DNMT3a鼠抗人抗体和抗DNMT3b鼠抗人抗体均购自美国Santa Cruz公司;EliVisionTMplus免疫组化试剂盒购自于福州迈新生物技术开发有限公司;增强型HRP-DAB底物显色试剂盒购自于上海酶联生物研究所;TRIzol试剂为美国Invitrogen公司产品;逆转录试剂盒、PCR试剂盒购自美国Fermentas公司;蛋白质印迹法所需试剂为碧云天研究所产品。
三、方法
1. 免疫组化法:应用免疫组化PV二步法检测胃癌组织中DNMT1、DNMT3a、DNMT3b蛋白表达。切片常规脱蜡,置于3% H2O2中浸泡5 min以阻断内源性过氧化物酶活性,PBS冲洗3次;随后滴加10%山羊血清以避免非特异性结合;分别加入DNMT1、DNMT3a、DNMT3b一抗(工作浓度均为1∶100)4 ℃冰箱过夜,PBS冲洗3次;加入山羊抗小鼠二抗,室温下孵育15 min,PBS冲洗3次;DAB显色,显微镜下观察,蒸馏水终止反应,苏木素复染,使用梯度乙醇脱水,二甲苯透明,中性树胶封片。
结果判定:DNMTs主要在细胞质中表达,少数可在细胞核中表达。染色评分为阳性细胞比例与染色强度之和。染色程度:不着色,0分;淡黄色,1分;黄色,2分;棕黄色或褐色,3分。阳性细胞比例,≤25%,1分;25%~50%,2分;50%~75%,3分;>75%,4分。总评分为0~3分为阴性表达,4~7分为阳性表达。
2. 实时qRT-PCR法:取各组细胞RNA 1 μg,严格按照逆转录试剂盒说明书逆转录合成cDNA。DNMT1正向引物:5’-GCT CTA GAT CCC TGA CAC CTA CCG-3’,反向:5’-GCT CTA GAC ATA AAG TTT AAT TTC CAC TC-3’;DNMT3a正向引物:5’-GGT CTA TGA AGT GAG GCA GAA GTG-3’,反向:5’-TTC AAA CTG CCG CAA GAA ATA C-3’;DNMT3b正向引物:5’-CCA GCT GAA GCC CAT GTT-3’,反向:5’-ATT TGT CTT GAA CGC TTG-3’;以β-actin作为内参,正向引物:5’-AAG GAC CTC TAC GCC AAC ACG-3’,反向:5’-TTT GCG GTG GAC GAT GGA G-3’。引物均由生工生物工程(上海)股份有限公司合成。PCR反应体系为20 μL,内含SYBR Premix Ex TaqTM Ⅱ (×2) 10.0 μL、上下游引物(10 μmol/L)各0.8 μL、cDNA模板2.0 μL、ROX Reference Dye(×50) 0.4 μL、灭菌蒸馏水6.0 μL。PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,65 ℃ 30 s、72 ℃ 30 s,共40个循环;68~74 ℃终延伸5~10 min。PCR产物行2.5%琼脂糖凝胶电泳,Gel ID凝胶图像分析系统摄片并分析。采用2-ΔΔCt法计算目的基因的mRNA相对表达量。
3. 蛋白质印迹法:利用RIPA蛋白裂解液提取总蛋白,采用BCA蛋白浓度测定试剂盒测定样本蛋白浓度;制备SDS-PAGE凝胶,每孔50 μg蛋白上样,200 V电压下电泳1 h;转移到硝酸纤维素膜,常规封闭,加入一抗(工作浓度均为 1∶1 000),37 ℃温育1 h;加入二抗(工作浓度1∶1 000),37 ℃温育1 h,利用ECL化学发光法检测,采用相关软件行灰度扫描分析。
四、统计学分析
结 果
一、DNMTs在胃癌组织中的表达
DNMT1在癌旁组织中以阴性表达为主,而在胃癌组织中以阳性表达为主(图1)。与癌旁组织相比,胃癌组织中DNMT1阳性表达率显著升高(68.8%对10.0%,P<0.01)。胃癌组织中DNMT1阳性表达率显著高于DNMT3a和DNMT3b(68.8%对38.8%、40.0%,P<0.05),而DNMT3a、DNMT3b阳性表达率相比无明显差异(P>0.05)。癌旁组织中DNMT1阳性表达率显著低于DNMT3a和DNMT3b(10.0%对60.0%、52.5%,P<0.05)(图2)。
DNMT1阳性表达与胃癌浸润深度、淋巴结转移以及TNM分期明显相关(P<0.05),而DNMT3a、DNMT3b阳性表达与胃癌临床病理特征均无关(P>0.05)(表1)。
二、DNMTs在胃癌细胞中的表达
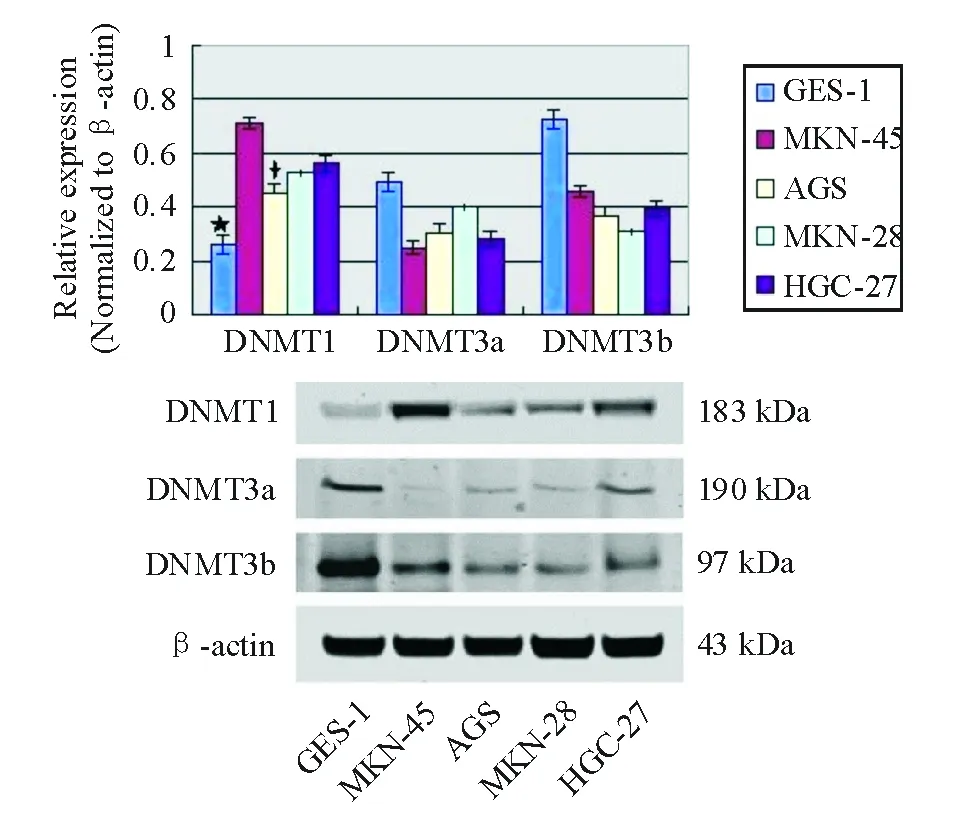
DNMT1 mRNA在胃癌MKN-45、AGS、MKN-28和HGC-27细胞中的表达分别为GES-1细胞的2.74、1.73、2.03、2.16倍。低分化的MKN-45和未分化的HGC-27胃癌细胞中DNMT1 mRNA表达显著高于高分化的AGS细胞(P=0.000)。而MKN-45、AGS、MKN-28和HGC-27细胞中DNMT3a、DNMT3b mRNA表达分别为GES-1细胞的0.51和0.63、0.62和0.5、0.81和0.42、0.58和0.55倍(图3A、表2)。与正常胃黏膜GES-1细胞相比,不同分化的胃癌细胞中DNMT1蛋白表达明显增加,而DNMT3a和DNMT3b 蛋白明显降低(图3B、表2)。进一步分析发现,低分化的MKN-45和未分化的HGC-27胃癌细胞中DNMT1蛋白表达显著高于高分化的AGS细胞(P=0.000)。
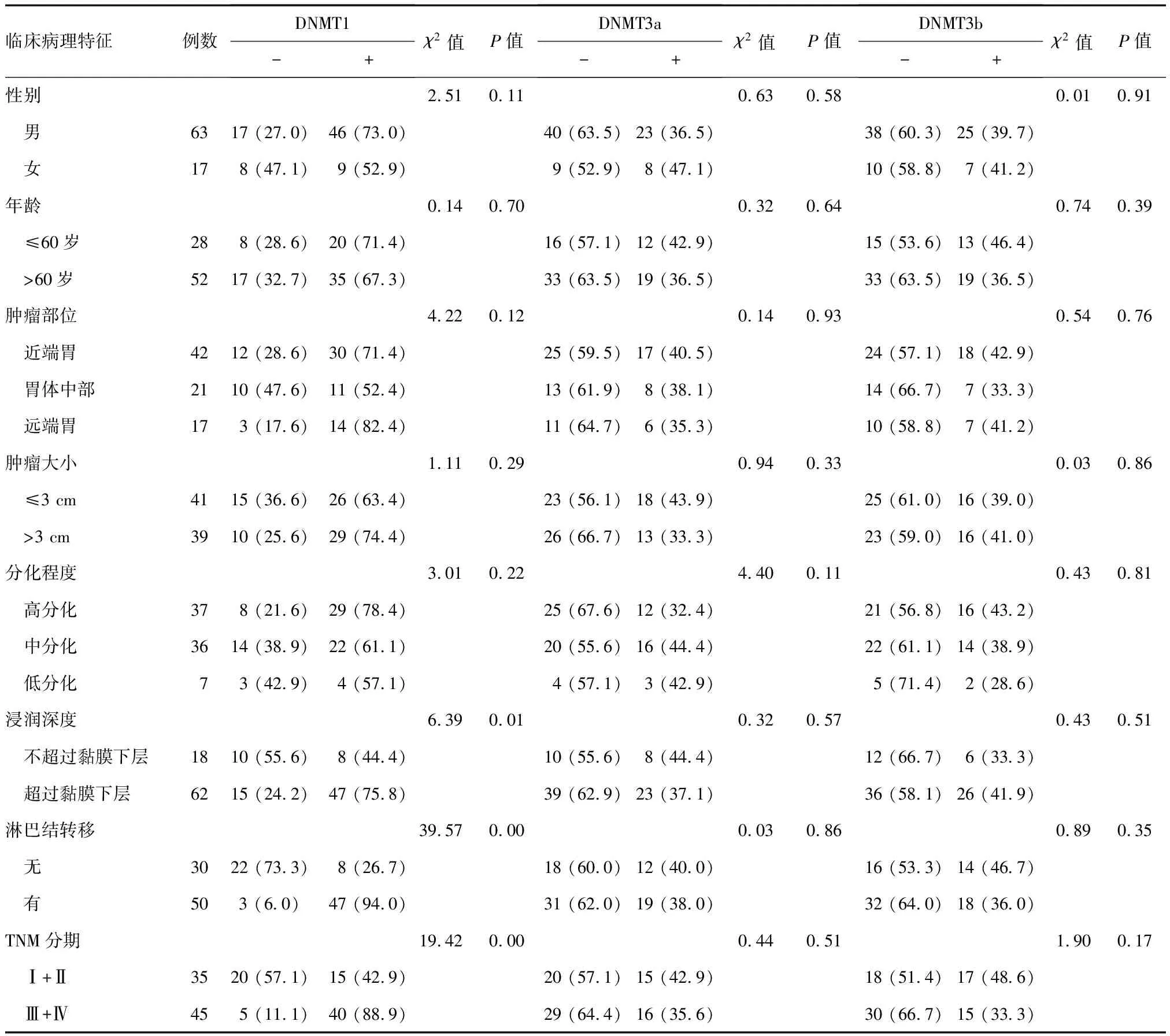
表1 DNMT1、DNMT3a和DNMT3b表达与胃癌患者临床病理特征的关系 n (%)
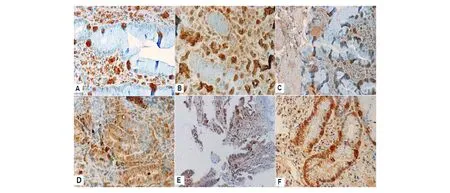
A:DNMT1阴性;B:DNMT3a阴性;C:DNMT3b阴性;D:DNMT1阳性;E:DNMT3a阳性;F:DNMT3b阳性
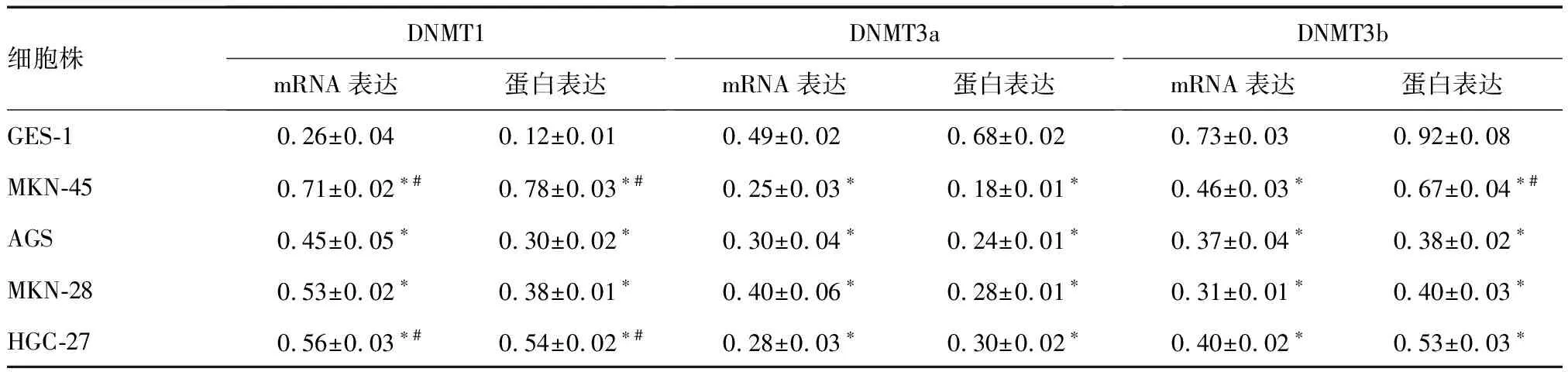
细胞株DNMT1mRNA表达蛋白表达DNMT3amRNA表达蛋白表达DNMT3bmRNA表达蛋白表达GES-10.26±0.040.12±0.010.49±0.020.68±0.020.73±0.030.92±0.08MKN-450.71±0.02#0.78±0.03#0.25±0.030.18±0.010.46±0.030.67±0.04#AGS0.45±0.050.30±0.020.30±0.040.24±0.010.37±0.040.38±0.02MKN-280.53±0.020.38±0.010.40±0.060.28±0.010.31±0.010.40±0.03HGC-270.56±0.03#0.54±0.02#0.28±0.030.30±0.020.40±0.020.53±0.03
*与GES-1细胞比较,P<0.05;#与AGS细胞比较,P<0.05
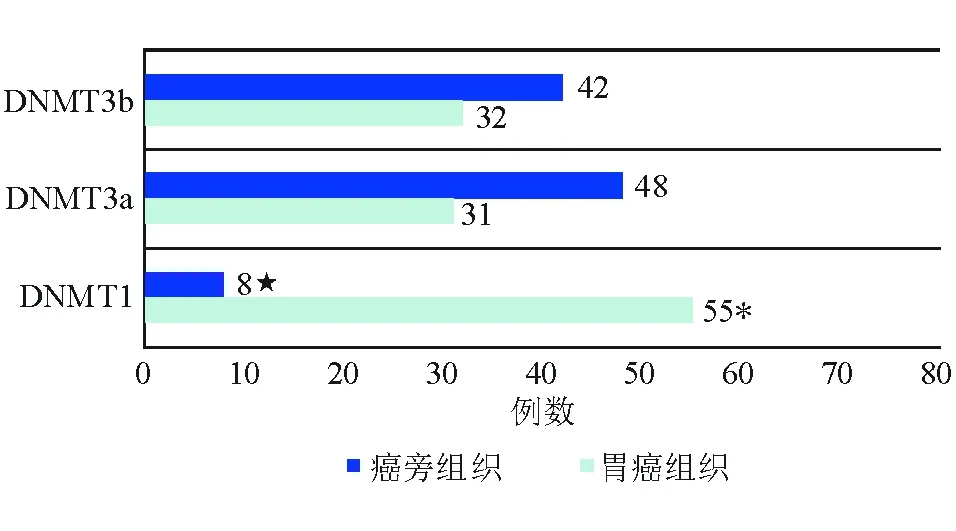
图2 DNMTs在胃癌及其癌旁组织中的阳性表达
1 Da=0.992 1 u
讨 论
根据不同的作用,DNMTs可分为两种类型:一种是重新甲基化酶,在哺乳动物中包括DNMT3a和DNMT3b,主要在胚胎发育中起作用;另一种是维持甲基化酶,在哺乳动物中主要为DNMT1,其为催化复制后的半甲基化,传递表观遗传学信息,维持重新甲基化完成后的甲基化状态稳定。
目前发现DNMT1、DNMT3a、DNMT3b异常表达均可导致抑癌基因发生甲基化从而影响肿瘤的发生、发展过程。Lin等[4]的研究发现,在肿瘤组织中存在抑癌基因启动子区高甲基化而导致抑癌基因沉默,而基因高甲基化与DNMTs蛋白异常表达密切相关;许多肿瘤中DNMTs蛋白表达均明显升高,如在有吸烟史的小细胞肺癌患者中,DNMTs家族多个成员(DNMT1、DNMT3a和DNMT3b)蛋白表达异常增高,与患者的不良预后密切相关。Kim等[5]对非小细胞肺癌的研究发现,肿瘤中同时存在DNMT1和DNMT3b mRNA表达增加以及相关抑癌基因的高甲基化状态。此外,在前列腺癌、结直肠癌、肝细胞癌、胃肠道间质瘤等肿瘤中也存在DNMT1或DNMT3b高表达,通过下调其表达可使抑癌基因重新活化从而抑制肿瘤的生物学特性[6-9]。本研究发现,DNMT1在癌旁组织中以阴性表达为主,而在胃癌组织中以阳性表达为主,组间差异有统计学意义(P<0.01)。且DNMT1阳性表达与胃癌浸润深度、淋巴结转移以及TNM分期明显相关,而DNMT3a和DNMT3b阳性表达与胃癌临床病理特征均无关。初步提示DNMT1异常表达与胃癌的发生、发展可能存在关联。与正常胃黏膜上皮GES-1细胞相比,不同分化程度的胃癌细胞株中DNMT1 mRNA和蛋白表达明显增加,而DNMT3a、DNMT3b mRNA和蛋白表达明显降低。且DNMT1表达与胃癌细胞分化程度有关(P<0.05)。
随着表观遗传学调控机制的深入研究,有研究以DNMTs为靶点,采用其抑制剂如地西他滨和5-氮杂胞苷进行动物实验和临床试验,以期能逆转肿瘤进程和抑制肿瘤干细胞[10-11]。但肿瘤表观遗传研究属新兴科研领域,未知性和不确定性强。此外,如何引起DNMTs异常表达而致基因高甲基化的机制尚不明确,值得进一步探讨。
综上所述,本研究结果表明DNMTs家族中的DNMT1可能在胃癌的发生、发展中起有重要调节作用,但具体机制仍有待进一步研究。
