两类合并RAI的脓毒性休克患儿糖皮质激素治疗
2019-03-25葛荣领厉洪江
葛荣领,厉洪江
2.河南省儿童医院,河南郑州 450053
相当多的脓毒性休克病例存在可逆性的下丘脑—垂体—肾上腺(hypothalamic-pituitary-adrenal,HPA)轴功能不全,即相对肾上腺皮质功能不全(relative adrenocortical insufficiency,RAI)[1-2],对于这类患者,特别是液体复苏及儿茶酚胺类血管活性药物应用后疗效不佳的合并RAI的脓毒性休克的患儿[3],推荐应用肾上腺糖皮质激素。目前临床常采用小剂量糖皮质激素替代疗法,但是疗效并不满意。本研究根据促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)刺激试验对RAI具有诊断意义的两种结果,观察激素替代治疗对这两类患儿的血流动力学、氧合功能及临床转归的不同影响。现报道如下。
1 资料与方法
1.1一般资料选择2013年 5月至2018年3月我院儿童重症监护病房(pediatric intensive care unit,PICU)诊断为脓毒性休克的患儿,均符合《儿童脓毒性休克(感染性休克)诊治专家共识(2015版)》诊断标准[3]。本研究符合医学伦理学标准,通过医院医学伦理委员会审批(审批号:2013-STXM-10),患者家属对所有诊断及治疗措施均获得知情权并签署知情同意书。
1.2纳入标准①对液体复苏无效、儿茶酚胺(肾上腺素或去甲肾上腺素)抵抗型休克;② ACTH刺激试验证实存在RAI的脓毒性休克的患儿。随机血清皮质醇<550 nmol·L-1,或静脉注射ACTH 1 μg后30 min、60 min血清皮质醇最大上升值(△max)<248 nmol·L-1。△max=30 min或60 min血清皮质醇的最大值—注射前血清皮质醇水平。
1.3排除标准①因慢性病接受肾上腺皮质激素治疗、垂体或肾上腺功能异常的脓毒性休克患儿;②应用免疫抑制剂或近3个月内有糖皮质激素应用史;③有先天性免疫缺陷病或重度营养不良、未纠正的低蛋白血症等疾病的患儿;④绝对性肾上腺功能障碍者,基础皮质醇<550 nmol·L-1,△max<248 nmol·L-1;⑤正常肾上腺反应者,基础皮质醇≥550 nmol·L-1,△max≥248 nmol·L-1。
1.4分组纳入研究对象65例,依ACTH刺激试验结果分为两组:A组基础皮质醇≥550 nmol·L-1,△max≤248 nmol·L-1;B组基础皮质醇<550 nmol·L-1,△max>248 nmol·L-1。 A组32例,包括男17例,女15例,年龄0.7~3(1.6±0.3)岁,其中10例为肺部感染,9例为血流感染,7例消化道感染,6例为其他部位感染;B组33例,包括男16例,女17例,年龄0.8~3(1.7±0.4)岁,其中12例为肺部感染,9例为血流感染,7例消化道感染,5例为其他部位感染。两组年龄、性别及入组时儿童死亡风险评分(pediatric risk of mortality score-Ⅲ, PRISM-Ⅲ),序贯器官衰竭估计评分(sequential organ failure assessment, SOFA),改良格拉斯哥昏迷评分(glasgow coma scale, GCS)等数据,差异无统计学意义(P>0.05),研究具有可比性。
1.5治疗两组入住PICU后均先行脓毒性休克的常规性治疗,一般包括抗感染治疗、液体复苏治疗、儿茶酚胺类药物保证器官组织灌注、机械通气支持以及胰岛素应用等对症治疗。疗效不佳者,经ACTH刺激试验证实RAI存在,则开始糖皮质激素替代治疗:每日氢化可的松3~5 mg·kg-1,分2~3次静脉滴注,治疗5~7 d,以后每2~3 d减半,直至停止应用。
1.6检测指标与方法
1.6.1两组激素及其他检测指标在开始激素治疗前(记为d0)及治疗后的第1、3、5日(d1、d3、d5) 进行检测。①血流动力学检测:行有创桡动脉穿刺置管,连接GE公司DASH3000型心电监护仪,监测心率及平均动脉压。通过床旁B超引导行右侧颈内静脉穿刺术,置入Swan-Ganz导管,监测中心静脉压(central venous pressure, CVP),肺毛细血管楔压(pulmonary capillary wedge pressure, PCWP),结合热稀释法计算心排指数(cardiac index, CI)、外周血管阻力指数(systemic vascular resistance index,SVRI)。②氧合功能指标的检测:行动脉血气分析检测动脉血氧分压(partial arterial oxygen pressure,PaO2)及乳酸(lactic acid, Lac)含量并结合静脉血气分析、血流动力学指标计算肺泡动脉血氧分压差[P(A-a)O2],肺泡氧摄取率(alveolar oxygen uptake,O2extr),方法:P(A-a)O2=[FIO2×(大气压-47)-PaCO2/0.8]-PaO2;氧耗量(oxygen consumption,VO2)=心排指数×[动脉血氧含量(arterial oxygen content,CaO2)-静脉血氧含量 (venous oxygen content,CjvO2)];氧输送(oxygen delivery,DO2)=心排指数×动脉血氧含量(CaO2);CaO2= Hb×1.38×SaO2+0.003×PaO2;O2extr=VO2/DO2;CjvO2= Hb×1.38×SjvO2+0.003×PjvO2。
1.6.2临床转归指标的记录两组在d0及d5记录PRISM-Ⅲ评分、SOFA评分、GCS评分;记录患者ICU住院时间及28 d病死率、28 d非机械通气时间、28 d非休克时间、28 d并发症的发生率(记录新发感染、消化道出血、高血压、高血糖等病例例数;导管相关性血流感染、导管相关性尿道感染、呼吸机相关性肺炎不计在内);比较两组患儿28 d生存率。

2 结果
2.1两组血流动力学指标的变化A组治疗前后:HR、CVP、CI、PCWP无变化(均P>0.05),MAP、SVRI升高(均P<0.05)。B组治疗前后:HR降低,MAP、CVP、SVRI升高(均P<0.05);CI、PCWP无变化(均P>0.05)。与A组相同时间点比较:B组MAP、CVP、SVRI均增高,HR降低(均P<0.05);CI、PCWP无变化(均P>0.05),见表1。
2.2两组氧合功能指标的变化每组治疗前后相同时间点的比较,PaO2、P(A-a)O2、O2extr及Lac含量均无明显差异(均P>0.05),见表2。

表1 两组血流动力学指标的变化

表2 两组氧合功能指标的变化
2.3两组临床转归指标的对比
2.3.1两组相同时间点临床评分比较PRISM-Ⅲ评分、SOFA评分、GCS评分水平相当;这三项评分的改善率两组间比较水平也相当,差异均无统计学意义(均P>0.05),见表3。
2.3.2两组临床转归指标比较28 d病死率B组较A组明显降低(P<0.05); 28 d非休克时间及ICU住院时间,B组患儿较A组明显升高(均P<0.05);28 d非机械通气时间及28 d并发症发生率,两组比较差异无统计学意义(均P>0.05),见表3。

表3 两组临床转归指标比较
2.3.3两组28d生存率比较Kaplan-Meier检验显示,B组较A组明显延长(P<0.05),见图1。
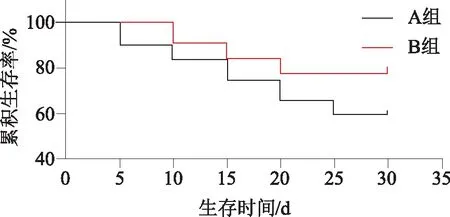
图1 两组28 d生存率比较
3 讨论
脓毒性休克病死率可达25%~70%[5-6]。目前,脓毒性休克的综合治疗主要包括控制感染、液体复苏、血管活性药物应用、机械通气以及预防和治疗并发症等[7],但是部分脓毒性休克患儿,对充分的液体复苏及儿茶酚胺类药物反应不佳。究其原因,是因为相当多的脓毒性休克病例存在可逆性的HPA轴功能不全,即RAI。现已证实低剂量(1 μg)ACTH刺激试验检测儿童RAI有较高的敏感性和安全性[4]。故本研究采用1 μg ACTH刺激试验的方法纳入研究对象。RAI患儿在ACTH刺激试验里呈现两种不同的结果,一是基础皮质醇≥550 nmol·L-1,△max≤248 nmol·L-1,本研究将这类患儿设为基础皮质醇高ACTH刺激抵抗组(A组);二是基础皮质醇<550 nmol·L-1,△max>248 nmol·L-1,本研究将这类患儿设为基础皮质醇低ACTH刺激敏感组(B组)。有研究发现后者皮质醇水平可波动在154.6~11 040.0 nmol·L-1之间(正常人群皮质醇水平约为138.0~662.4 nmol·L-1),范围明显增大[8-9]。但这种升高对机体控制炎症级联反应的需求仍显不足,或糖皮质激素受体亲和力下降,靶器官对激素的利用不足[10],表现为ACTH刺激的反应性降低。有研究证实重症患儿RAI发病率为31%[11],脓毒症休克小儿RAI的发病率为68%[12]。目前临床推荐小剂量皮质激素替代疗法,但疗效不一,故此本研究根据ACTH刺激试验呈现的不同结果将样本分层。
对血流动力学的影响:脓毒性休克多为高排低阻型休克,激素替代治疗后两组患儿的平均动脉压及外周血管阻力都能升高,但是,基础皮质醇低ACTH刺激敏感组比基础皮质醇高ACTH刺激抵抗组提升得更显著,而且前者也同时明显地降低了心率、升高了中心静脉压,后者未见到心率及中心静脉压的改善。心排指数及肺毛细血管楔压,每组治疗前后的比较及两组在相同时间点的比较,变化均不明显,说明激素替代治疗对心输出量及肺循环状态的改变无影响。这与Didier等的研究结果一致[13]。
对氧合功能的影响:脓毒性休克患儿常常合并不同程度的肺功能受损,严重者甚至有发生ARDS的可能,氧合功能障碍表现为PaO2降低及血乳酸含量、P(A-a)O2、O2extr增高。本研究中,两组患儿以上指标在激素治疗前后均无明显改善,两组患儿在相同时间点上的比较也无显著差异,表明激素应用对脓毒性休克患儿氧合功能的改善并无作用。这与国内李刚等的研究结果不一致[14]。
对临床转归及预后的影响:小剂量氢化可的松使患者在血液动力学方面更容易获益并提高了存活率[15-17],但是有的研究结果得出不同的结论,小剂量激素的治疗不能降低脓毒性休克患者的病死率[18-19]。本研究显示,和基础皮质醇高ACTH刺激抵抗组比较,基础皮质醇低ACTH刺激敏感组脓毒性休克患儿的部分预后更好,特别是28 d病死率降低,28 d生存率延长,休克纠正时间缩短,而ICU住院时间延长正是与其病死率降低及生存时间延长有关。在PRISM-Ⅲ、SOFA、GCS等系统综合评估上优势并不明显,而且临床并发症的发生率也无明显差异。提示本研究对脓毒性休克的认知仍存在缺陷,在临床上仍需要更多的努力,探求更加完备的治疗策略。
有关脓毒性休克的糖皮质激素替代治疗,许多问题仍处于探讨中,如RAI发病机理及ACTH刺激试验的局限性及改良等。本研究属小样本研究,其结论尚需要更多大样本、多中心的研究支持。
