肌萎缩侧索硬化患者综合性营养支持的实施与分析
2019-03-22王庆美孔素梅吴海寰
高 源,孙 青,赫 军,王庆美,孔素梅,仵 芳,吴海寰
[作者单位]250031山东济南,解放军第九六○医院营养科(高源,孙青,赫军,吴海寰),干部四科(王庆美,孔素梅,仵芳)
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是以上下两级运动神经元进行性丢失为特征的一种神经系统变性病,为最常见的成年发病的运动神经元疾病[1]。该病系脊髓前角病变致运动神经元损伤所致,往往预后不良,迄今为止尚无有效的方法治愈或阻止其病情发展,一般以支持对症疗法为主,平均预期寿命为2~3年[2]。营养支持可提高患者生活质量及延长生存期[3]。以下就1例肌萎缩侧索硬化患者的营养支持报告如下。
1 病例资料
患者,男,56岁,身高183 cm,体重75 kg。因右上肢上举无力,右下肢无力,伴活动耐力下降,四肢、肩部及胸部均出现“肉跳”,行肌电图检查示:所检肌肉(除右胸锁乳突肌外)均呈神经源性损害;肌酸激酶481 U/L。2011年初步诊断为 “运动神经元病、肌萎缩侧索硬化”。临床给予补充维生素、营养神经、改善循环、免疫球蛋白冲击治疗,患者肌肉跳动较前减少,但肢体无力未改善,且以右下肢为著。近期患者逐渐出现站立困难、抬头费力、发音不清、饮水呛咳、吞咽困难。2014年10月患者出现憋喘、咳嗽、双下肢不能抬离床面,行气管插管及呼吸机辅助通气、抗感染、吸痰等治疗,经营养评估后,给予充足能量和营养素补充、设计合理的营养支持方案。
2 营养治疗
2.1 肠内营养(enteral nutrition,EN)支持初始阶段 2014-11-20营养科介入,根据WHO疾病状态下能量消耗的计算方法,考虑患者肌张力增高、肌束震颤频繁,能量消耗较大,采取高能量高蛋白质的营养支持方案,评估该患者目标能量为2204 kcal/d,蛋白质 135 g/d(按 1.5~2.0 g/kg·d)。 鉴于患者初期胃肠耐受较差,EN初始能量摄入定为1209 kcal/d,蛋白质91 g/d,采用整蛋白均衡全营养肠内营养制剂240 g/d,乳清蛋白粉组件64 g/d,谷氨酰胺组件10 g/d,并给以维生素和微量元素复合片剂1片/d,使用营养泵间歇性泵入,泵速90 ml/h。经过6 d(2014-11-26)观察,患者能够稳定接受目前摄入量,但是此阶段的EN支持,能量和蛋白质尚未达到目标量。
2.2 肠内营养和补充性肠外营养(supplemental parenteral nutrition,SPN)支持阶段 患者因胃肠耐受不佳,EN在短期内无法达到目标量,故选择联合SPN。EN采用整蛋白均衡全营养肠内营养制剂288 g/d,乳清蛋白粉组件80 g/d,谷氨酰胺组件10 g/d,并给以维生素和微量元素复合片剂1片/d,提供能量1500 kcal/d,蛋白质123 g/d,使用营养泵间歇性泵入,泵速150 ml/h;SPN采用中长链脂肪乳剂250 ml、18种氨基酸注射液250 ml、50%葡萄糖注射液100 ml、10%氯化钾注射液10 ml、丙氨酰谷氨酰胺注射10 g,提供能量704 kcal/d,蛋白质12 g/d,在EN和SPN的联合使用下,达到该患者目标摄入量。此阶段持续 15 d(2014-12-11),患者反应平稳,大便正常,腹部平坦无胀气,无反流,无恶心呕吐,肠鸣音正常。
2.3 完全肠内营养(total enteral nutrition,TEN)支持阶段 随着患者病情逐渐稳定,胃肠功能转佳,遂考虑增加EN,减少PN直至TEN。TEN采用整蛋白均衡全营养肠内营养制剂420 g/d+乳清蛋白粉组件80 g/d+谷氨酰胺组件10 g/d+维生素和微量元素复合片剂1片/d,提供能量2076 kcal/d,蛋白质140 g/d,使用营养泵间歇性泵入,泵速180 ml/h,该患者可通过TEN达到目标摄入量。此阶段持续7 d(2014-12-18),经观察患者可耐受TEN支持。
2.4 肠内营养制剂配合普通食物长期维持阶段采用整蛋白均衡全营养肠内营养制剂配合营养素组件的EN+自制食物匀浆。EN选择整蛋白均衡全营养肠内营养制剂(365 g/d)+乳清蛋白粉组件(64 g/d)+谷氨酰胺组件(10 g/d)+维生素和微量元素复合片剂 1片/d,提供能量 1793 kcal/d,蛋白质 117 g/d,使用营养泵间歇性泵入,泵速150 ml/h;自制食物匀浆由谷物、蔬菜、肉和海产品、坚果、食用油及盐等制成,提供能量350 kcal/d,蛋白质31 g/d,使用推注方式。综合分析此阶段总能量2143 kcal/d,蛋白质148 g/d(供能比 27%),脂肪 57 g/d(供能比 24%),碳水化合物257 g/d(供能比48%)。此阶段持续治疗10 d(2014-12-28)后,经观察患者对此营养支持方式耐受良好,由此确定该营养支持方式为长期使用方式。
2.5 营养相关临床症状处理阶段
2.5.1 血脂增高的营养治疗 达到目标摄入量营养支持7个月(2015年7月)后出现血脂增高,经营养评估后,采用减少总能量,调整饮食结构,采用低GI饮食,减少整蛋白均衡全营养肠内营养制剂的使用量,增加普通食物的摄入量,增加果蔬摄入量,增加全谷物食物(如小米、糙米、麦仁等),同时添加水溶性膳食纤维组件(菊粉型),其用量为15 g/d,全天总膳食纤维量达34 g,脂肪供能比由24%降至20%。此阶段总能量1842 kcal/d,蛋白质124 g/d(供能比27%),脂肪41 g/d(供能比20%),碳水化合物244 g/d(供能比53%)。历经4个月(2015年11月)的时间,三酰甘油由3.36 mmol/L降到1.75 mmol/L,恢复理想范围。此方案一直使用至今。
2.5.2 血红蛋白及血细胞比容下降的营养治疗达到目标摄入量营养支持34个月 (2017年10月)后出现血红蛋白及血细胞比容下降,经膳食调查后发现,全天铁摄入量20 mg(已超出每日膳食推荐摄入量)、维生素 C 200 mg/d、叶酸 400 μg/d及维生素B122.5 μg/d,此时与红细胞生成相关营养素已达到每日膳食推荐摄入量,膳食铁摄入量已超过每日膳食推荐摄入量,考虑有可能是该类患者吸收转化功能较弱,临床仍出现血红蛋白和血细胞比容的降低,因此给予超过每日膳食推荐摄入量的剂量,补充红细胞生成相关营养素,加强补充甘氨酸亚铁制剂以及相关维生素组件,全天铁摄入量41 mg(甘氨酸亚铁制剂+膳食铁+维生素和微量元素复合片剂,合计达到可耐受最高摄入量)、维生素C 261 mg/d(超过每日膳食推荐摄入量)、叶酸500 μg/d(超过每日膳食推荐摄入量)及维生素B122.6 μg/d(超过每日膳食推荐摄入量)。2个月(2017年12月)后,血红蛋白量由126 g/L升至132 g/L,血细胞比容由38.9%升至41.2%,恢复正常范围。
2.5.3 胃肠道功能障碍的营养治疗 在实施营养支持的过程中,因各种原因引起的胃肠功能障碍,采取综合性营养支持措施调节胃肠功能。首先,尽可能维持目标营养摄入状态,在维持全面营养的基础上调节肠道微生态。出现腹泻时,使用低渗型肠内营养制剂(258 g/d)同等能量替代整蛋白均衡全营养肠内营养制剂(238 g/d);继续使用谷氨酰胺组件10 g/d;添加益生菌和益生元合剂15 g/d(含180亿活菌、水溶性膳食纤维4 g);停用水溶性膳食纤维组件(菊粉型);减少全谷物食物的摄入量;选择易消化的发酵食物。3 d后腹泻停止,大便成形,胃肠功能恢复。出现便秘时,使用纤维型肠内营养制剂(251 g/d)同等能量替代整蛋白均衡全营养肠内营养制剂(238 g/d);继续使用谷氨酰胺组件10 g/d及添加益生菌和益生元合剂15 g/d(含180亿活菌、水溶性膳食纤维4 g);增加全谷物食物(如小米、糙米、麦仁等);同时恢复添加水溶性膳食纤维组件(菊粉型),其用量为15 g/d,全天总膳食纤维量达38 g。
2.5.4 饮食心理干预 基于该类患者固有的心理障碍,除临床给予的抗抑郁药物以外,也应注意在营养支持过程中,使用饮食心理干预的方法照顾患者,包括对食物的色香味的选择、营养支持方式改变的心理疏导、密切观察进食反应、鼓励进食、增强患者战胜疾病的信心等。因患者未通过洼田饮水试验[4],最终放弃经口进食尝试。
经过综合性营养支持及临床各科室的相应治疗,患者病情稳定,营养状态良好,实验室各检查指标均保持在正常范围,体重、皮褶厚度、上臂围和臂肌围呈上升趋势。见表1。
3 讨论
ALS是运动神经元病 (motor neuron disease,MND)的一种,它可导致机体代谢率增高,能量消耗增加,而患者往往有胃肠功能障碍,进而导致脂肪及肌肉分解供能,发展到后期,肌萎缩无力、营养不良,从而加速疾病过程,死亡风险加倍。据统计,ALS存在营养不良时死亡风险增加8倍[5]。文献中指出,患者因各种原因而不能经口进食时,需应用全营养支持,首选肠内营养支持。此观点在临床应用已显示了它的效果,并改变了很多疾病的预后,使许多患者因而得益[6,7]。能量和营养素需要量方案应根据患者自身情况和疾病状态进行合理评估。该患者疾病进展期时,肌束震颤、肌张力增高,能量需要量较大,为维持患者肌肉的功能,笔者采用高热量高蛋白的营养支持原则,在膳食中补充充足的蛋白质对肌肉质量、肌肉力量均有大的改善[8]。选择EN+SPN,快速补充热量,随着肠内营养耐受度逐渐提高,逐渐减少SPN,直至最后完全停用,以肠内营养制剂配合普通食物的方式长期维持。
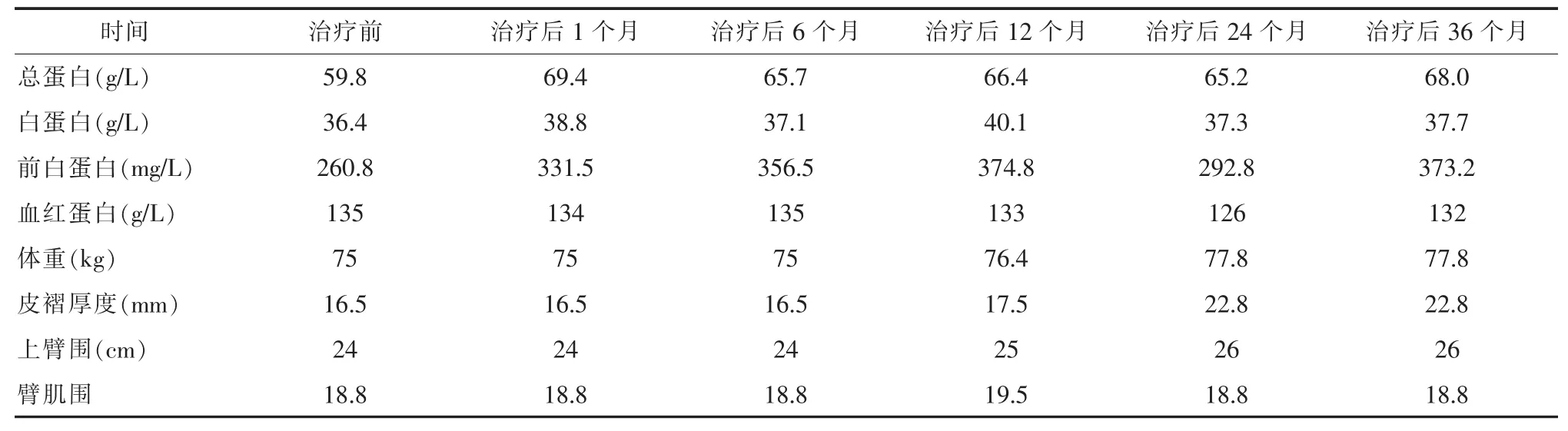
表1 治疗前后辅助检验检查指标对比
在长达数年的营养支持期间,针对血脂增高、血红蛋白下降、肠道功能障碍等问题,及时调整营养方案、同时在饮食心理问题方面予以关注,对患者在该疾病状态下超过平均存活期起到至关重要的作用。
针对患者出现血脂增高的情况,采取了减少总能量,调整饮食结构,采用低GI饮食,减少整蛋白均衡全营养肠内营养制剂的使用量,增加普通食物的摄入量,增加果蔬摄入量,增加全谷物食物(如小米、糙米、麦仁等),同时添加水溶性膳食纤维组件(菊粉型)[9],通过以上措施促进血脂及脂蛋白的代谢,降低脂类的吸收水平,达到降脂目的。
该患者在能量充足和各营养素达到每日膳食推荐摄入量的情况下,在营养支持接近3年时仍出现血红蛋白和血细胞比容下降的情况,针对这一情况,笔者采取超出每日膳食推荐摄入量甚至达到可耐受最高摄入量的剂量补充红细胞生成相关营养素,取得了显著效果。铁元素与红细胞的形成有关,并通过受体进入幼红细胞,与原卟啉结合生成血红素,后者再与珠蛋白结合生成血红蛋白。当铁缺乏时,血红蛋白的合成不足,影响幼红细胞的分裂、增殖、成熟,出现贫血;维生素B12参与人体内的甲基转换、叶酸代谢,一旦缺乏,可阻碍红细胞中DNA的合成,并影响红细胞成熟,引起红细胞性缺血;叶酸是细胞、DNA合成期间的重要辅酶之一,同时也参与血红素的合成,一旦缺乏,可影响DNA损伤的修复机制,并抑制细胞的生长。当人体内缺乏时,可阻碍红细胞的成熟过程,使红细胞中血红蛋白生成减少,引发恶性贫血;维生素C是一种强还原剂,在肠道内可以将三价铁还原为二价铁,而且可以与铁螯合形成可溶性小分子络合物,促进铁的吸收[10]。就该患者而言,可能存在代谢转化功能减弱,除常规量补充相关营养素外,还需高剂量补充红细胞生成相关营养素,2个月后,其红细胞形成指标恢复正常。
综合性营养措施对改善胃肠功能障碍效果十分显著,针对该患者采取如下措施,首先调整了肠内营养制剂的类型,选择低渗型肠内营养制剂,因为降低制剂的渗透压可维持肠道内环境稳定[11];谷氨酰胺是肠道黏膜细胞代谢必需的营养物质,同时也为机体提供必需的氮源,促使肌细胞内蛋白质合成[12];水溶性膳食纤维可吸收肠道水分并可被肠道益生菌所利用[9];益生菌是一类对宿主有益的活性微生物,可养护肠道菌群,坚固肠道生物屏障,隔断致病菌定植和入侵[13]。该患者通过肠内营养制剂类型改变,补充肠道细胞营养物质,提供益生菌和益生元合剂,同时保证机体充足营养等综合性营养措施,使患者胃肠功能迅速恢复,其营养治疗效果明显。
ALS患者呈现的肌肉进行性无力和萎缩,会使患者逐渐丧失生活自理和社交能力,且容易产生敏感、恐惧、抑郁等不良情绪。据文献报道,患者的生活质量不仅取决于运动功能损害的程度,也取决于患者的情绪[14]。另据研究,抑郁是影响ALS生存时间的一个独立因素[15]。在该患者实际治疗过程中,也发现抗抑郁的药物治疗与心理治疗相结合,可以对改善患者的不良情绪起到较好的效果,这与文献报道一致;吞咽功能是人类的基本需求,有效且安全的吞咽可以给人带来自然的愉悦感[16]。但患者多次评估均未通过洼田饮水试验,加之患者本身强烈拒绝尝试经口进食,最终放弃尝试。长期坚持运动锻炼和康复治疗,可以维持肌肉力量[17],该患者长期坚持运动锻炼及康复治疗,对保持肌肉力量有意义。
综上,合理的综合性营养治疗对改善ALS患者的临床结局、提高患者生活质量和延长生存期至关重要,而个体化的营养治疗可有效地促进不同MND患者营养支持的成功实施。
