竹节参总皂苷对自然衰老大鼠脂肪组织炎症的改善作用
2019-03-22刘正泰刘朝奇何毓敏张长城袁成福
刘正泰, 刘朝奇, 何毓敏, 张长城, 袁 丁, 袁成福
(三峡大学医学院,湖北宜昌 443002)
大量研究显示[1],随着机体老龄化,脂肪组织从皮下转移到腹部、肌肉、肝脏、骨髓等其他异位位点,其中前脂肪细胞的分化增殖能力也会随着年龄增长而下降,进而释放出过多的游离脂肪酸,使机体处于脂毒性状态[2]。功能障碍会使前脂肪细胞分泌促炎及趋化因子,招募更多巨噬细胞,其分泌的细胞因子进一步刺激前脂肪细胞释放游离脂肪酸,加剧机体脂毒性,进而诱导并加剧脂肪组织炎症[3-4],然后通过损害正常脂质分布、脂肪组织功能等导致脂毒性增加,细胞应激通路激活,进而引发胰岛素抵抗等多种脂肪组织系统性功能障碍。因此,深入探讨衰老致脂肪组织慢性炎症及其可能机制对老龄化引起的脂肪组织功能障碍及代谢功能障碍具有重要的意义。
竹节参是五加科人参属植物竹节参Panax japnicus C.A.Mey的干燥根茎,其活性成分为竹节参总皂苷,主要包括竹节参皂苷Ⅳ、Ⅳa、Ⅴ等[5],具有降血脂、抗炎等多种药理活性。课题组前期研究发现,竹节参总皂苷具有显著的抗炎活性[6-10],但它对衰老致脂肪组织慢性炎症的影响尚不明确,故本实验探讨该成分对自然衰老大鼠脂肪组织炎症的改善作用。
1 材料
1.1 动物 SPF级SD雄性大鼠购自三峡大学实验动物中心,温度 (22±2)℃,相对湿度 (60±5)%,光照明暗交替,自由饮食,实验动物生产许可证号 SCXK(鄂)2011-0061。
1.2 试药 竹节参采自湖北省恩施竹节参种植基地,经湖北省天然产物研究与开发重点实验室专家鉴定为五加科人参属植物竹节参Panax japonicas C.A.Mey的干燥根茎,竹节参总皂苷的分离纯化参照课题组前期报道[11]。总RNA提取试剂盒 (美国Thermo公司,批号139506);RNA逆转录试剂盒 (日本TaKaRa公司,批号AK4401);PCR引物由生工生物工程 (上海)股份有限公司提供,见表1;βactin抗体 (货号 4970 L)、 NF-κΒ 抗体 (货号 8242 S)、pNF-κB抗体 (货号3033 S) (美国Cell Signaling公司);IL-1β抗体 (货号 ab6671)、 TNF-α抗体 (货号 ab9722)(美国Abcam公司);TLR4抗体 (货号 SC-293072,美国Santa Cruz公司);相应二抗 (批号125510、125435,武汉科瑞有限公司);ECL显影剂 (批号P0018-1,碧云天生物技术研究所)。其余试剂均为分析纯。

表1 PCR引物序列
1.3 仪器 TP1020脱水仪、EG1105H包埋机、Ultracut-R超薄切片机、DMR多功能显微镜 (德国Leica公司);PowerPacTMBasic电泳仪、T100TMThermal Cycler PCR热循环仪(美国Bio-Rad公司);Gene Genius凝胶系统 (英国Syngne公司)。
2 方法
2.1 动物分组及给药 将48只2月龄SPF级SD大鼠分成自然衰老组及竹节参总皂苷低、中、高剂量组 (10、30、60 mg/kg),每组12只,待喂养至18月龄后,再取12只2月龄SPF级SD大鼠同时喂养4个月,作为正常对照组。竹节参总皂苷组大鼠从18月龄开始给药,至22月龄止,每星期停药1 d。给药结束后,实验前12 h大鼠禁食不禁水,10%水合氯醛麻醉处死,小心取新鲜附睾脂肪组织,过液氮,迅速保存于-80℃低温冰箱中。
2.2 附睾脂肪HE染色 大鼠处死后,切取全部附睾脂肪并称定质量,生理盐水冲洗,切取厚度适中、呈片状者,固定、脱水、石蜡包埋后切片,厚度为6 μm。切片经脱蜡复水后,苏木精染3 min,流水冲30 min,伊红染30 s,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察并取图。
2.3 IL-1β、 TNF-α、 MCP-1、 IL-6 mRNA 表达检测 采用RT-PCR法。取附睾脂肪200~300 mg于1.5 mL EP管中,加 150 μL TRIzol研磨至一定程度后补加850 μL TRIzol, 轻轻混匀,冰上静置5 min,4℃ 12 000 r/min离心10 min;取上清,加三氯甲烷及DEPC水,各占上清体积的1/5,剧烈摇晃15 s,冰上放置 5 min,4℃、12 000 r/min离心15 min,吸取上清无色溶液,加入等量异丙醇,上下混匀,于-20℃放置15~30 min, 4℃、 12 000 r/min离心10 min,倒掉上清,加入1 mL 75%乙醇,移液枪轻轻吹取沉淀,4℃、7 500 r/min离心5~10 min,吸走上清,室温下晾干,即得RNA,按试剂盒说明书进行逆转录,得cDNA。PCR反应体系总体积为10 μL [双蒸水3.5 μL,PCR Master mix(2x) 5 μL, IL-1β、 TNF-α、 MCP-1、 IL-6、 上下游引物各0.5 μL, cDNA模板0.5 μL], 以 GAPDH 为内参, 扩增条件为95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 1 min GOTO2,35次;72℃ 5 min,4℃下低温保存。PCR产物经电泳后凝胶成像仪拍照取图,检测mRNA表达,Image-Pro-Plus 6.0软件进行分析。
2.4 IL-1β、 TNF-α、 TLR4、 NF-κB、 pNF-κB 蛋白表达检测 采用Western blot法。将组织于冰上研磨1~2 min,涡旋后3 000 r/min离心1 min,去除上清液,重复3次至上清近无色,去上清,加适量RIPA裂解液、PMSF及磷酸蛋白酶抑制剂A、B(100∶1∶1∶1),组织于冰上研磨1~2 min, 4℃、 12 000 r/min离心15 min, 取上清加入1/5上清体积的蛋白质Loading buffer,100℃下煮沸10 min,蛋白样品于-80℃下保存,电泳分离后转至PVDF膜,5%牛奶封闭1 h,一抗4℃孵育过夜,TBST洗涤3次,二抗室温下孵育 1 h,TBST洗涤 3次,ECL显色,Image-Pro-Plus 6.0软件进行分析。
2.5 统计学分析 通过SPSS 18.0软件进行处理,数据用s)表示,各组样本间均数比较采用单因素方差分析,RT-PCR、Western blot数据均采用Image-Pro-Plus 6.0软件进行分析,P<0.05表示差异有统计学意义。
3 结果
3.1 竹节参总皂苷对脂肪组织HE染色的影响 图1显示,正常对照组脂肪细胞排列紧密,大体呈圆形,大小均一;与正常对照组比较,自然衰老组脂肪细胞结构紊乱、大小不均、排列散乱,巨噬细胞细胞浸润显著增加 (P<0.05);与自然衰老组比较,竹节参总皂苷组可显著减少衰老致炎性细胞浸润 (P<0.05),细胞形态有所改善。

图1 各组脂肪组织HE染色 (×200)
3.2 竹节参总皂苷对 IL-1β、TNF-α、MCP-1、IL-6 mRNA表达的影响 图2显示,与正常对照组比较,自然衰老组IL-1β、 TNF-α、 MCP-1、 IL-6 mRNA 表达显著增加 (P<0.05);与自然衰老组比较,竹节参总皂苷中、高剂量组四者mRNA表达显著降低 (P<0.05)。
3.3 竹节参总皂苷对IL-1β、TNF-α蛋白表达的影响 图3显示,与正常对照组比较,自然衰老组IL-1β、TNF-α蛋白表达显著上调 (P<0.01);与自然衰老组比较,竹节参总皂苷组两者蛋白表达显著下调 (P<0.05)。
3.4 竹节参总皂苷对TLR4蛋白表达的影响 图4显示,与正常对照组比较,自然衰老组TLR4蛋白表达显著上升(P<0.01);与自然衰老组比较,竹节参总皂苷组其蛋白表达显著下调 (P<0.05)。
3.5 竹节参总皂苷对pNF-κB蛋白表达的影响 图5显示,与正常对照组比较,自然衰老组pNF-κB蛋白表达显著上升 (P<0.01);与自然衰老组比较,竹节参总皂苷组其蛋白表达显著降低 (P<0.05)。
4 讨论
衰老一般是生物体随着时间的推移,机体各组织持续处在慢性、低度的炎症状态,进而引发机体功能障碍[12]。脂肪组织是人体内重要的内分泌器官,在年龄相关的代谢功能障碍和长寿中起着关键作用[13],衰老会促使脂肪细胞肥大和死亡,这类脂肪细胞会招募血液中的单核细胞浸润至脂肪组织并分化成巨噬细胞;脂肪组织内促炎型巨噬细胞通过分泌MCP-1等炎症因子进一步招募巨噬细胞浸润至脂肪组织,通过围绕并吞噬死亡或垂死的脂肪细胞形成非常典型的牙套状结构,这种典型的冠状结构被用于量化脂肪组织炎症水平;脂肪组织内部固有的巨噬细胞会从抑炎型 (M2)向促炎型 (M1)转变,从而加剧脂肪组织慢性炎症。Lumeng等[14]发现,在衰老机体中脂肪组织巨噬细胞会从M2型向M1型转变,促炎型巨噬细胞在衰老大鼠的脂肪组织中聚集,并分泌IL-6、MCP-1等细胞因子,加剧炎症反应;本实验经HE染色发现,与正常对照组比较,自然衰老组大鼠脂肪组织细胞排列紊乱,大量出现巨噬细胞浸润致牙套状结构;竹节参总皂苷可明显改善其病变情况,脂肪组织排列趋近整齐,因巨噬细胞浸润所形成的牙套状结构明显减少,表明该成分可减少衰老大鼠中的巨噬细胞浸润,改善细胞形态。

图2 竹节参总皂苷对 IL-1β、TNF-α、MCP-1、IL-6 mRNA表达的影响
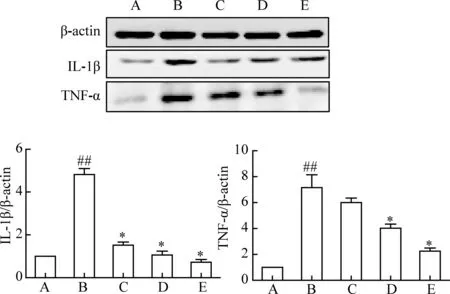
图3 竹节参总皂苷对IL-1β、TNF-α蛋白表达的影响

图4 竹节参总皂苷对TLR4蛋白表达的影响

图5 竹节参总皂苷对pNF-κB蛋白表达的影响
在衰老过程中,机体内大量脂肪组织重新分布,从皮下向腹部内脏、肝脏、骨骼肌等其他异位位点转移,脂肪在内脏等非皮下部位沉积时,会引起脂肪组织功能失调,增加了机体代谢性炎症发生的风险[15]。在脂肪细胞分化及表型维持过程中,PPARr家族、C/EBPs家族、抗生脂因子抑制剂具有重要作用。研究表明[16]与年轻个体比较,衰老大鼠C/EBP-α等关键的生脂转录因子生成显著减少,CUGBP、TNF-α表达增多,其中后者可增加前体脂肪细胞中前者活性和CHOP表达,而且CHOP还可抑制脂肪形成,上述变化导致衰老个体中前脂肪细胞增殖、分化能力降低。功能障碍的前脂肪细胞使机体处于游离脂肪酸过多的脂毒性状态,进而引发并加剧脂肪组织慢性炎症。
课题组前期发现,竹节参具有良好的抗炎活性,具有降血脂、改善心血管疾病、抗病毒增强免疫力的作用,并在体内外多个水平予以证实[6-10]。本实验显示,与正常对照组比较,衰老大鼠脂肪组织IL-6、MCP-1、TNF-α、IL-1β mRNA表达,以及 TNF-α、IL-1β蛋白表达显著升高,其中MCP-1可进一步促使血液中单核细胞浸润至脂肪组织,分化为促炎性巨噬细胞;TNF-α能作用于TNF-α受体,再次活化 NF-κB通路;IL-6可激活 JNK、ERK1/2,诱导IRS-1 Ser磷酸化,降低IRS-1表达,引发胰岛素抵抗,从而进一步加剧衰老个体脂肪组织的慢性炎症,而竹节参总皂苷干预后上述炎性因子表达均显著下降,并呈剂量依赖性,表明该成分可改善衰老致脂肪组织慢性炎症。
虽然关于衰老致脂肪组织慢性炎症的具体分子机制尚不明确,但大量研究表明衰老致游离脂肪酸过多可能激活TLR4/NF-κB炎症通路,从而引发或加剧脂肪组织炎症。Suganami等[17]经体外实验发现,饱和脂肪酸对3T3-L1细胞进行预处理后,脂肪细胞大量表达炎性因子,如MCP-1、TNF-α、IL-6;有研究显示[18],饱和游离脂肪酸处理TLR4缺失小鼠-异常的脂肪组织产生的游离脂肪酸等内源性配体结合,激活 NF-κB炎症通路,促使 IL-6、MCP-1、TNF-α、IL-1β等炎症因子表达升高。本实验显示,衰老大鼠脂肪组织TLR4、pNF-κB蛋白表达显著上调,表明衰老大鼠脂肪组织中TLR4/NF-κB炎症通路被激活,而竹节参总皂苷干预后两者蛋白表达显著下调,表明该成分可抑制TLR4表达,降低NF-κB磷酸化,从而改善衰老大鼠脂肪组织炎症。
综上所述,竹节参总皂苷对衰老大鼠脂肪组织损伤有改善作用,其机制可能与减少脂肪组织巨噬细胞浸润及游离脂肪酸致TLR4蛋白表达、抑制NF-κB通路激活有关。
