定量MRI评价肝泡型包虫病肝储备功能的初步探讨
2019-03-21张茜茹依巴努阿不都热合曼王健蒋奕刘文亚
张茜茹, 依巴努·阿不都热合曼, 王健, 蒋奕, 刘文亚
肝脏泡型包虫(hepatic alveolar echinococcosis,HAE)在肝实质内呈浸润性生长,破坏正常的肝脏组织,根治性病灶切除是肝脏泡型包虫最理想的治疗方式[1],然而HAE起病隐匿,早期无明显的临床症状,很多患者就诊时已经发展到疾病终末期,HAE病灶往往侵犯肝静脉根部、肝后下腔静脉及第一肝门部大的脉管系统,此时常规的外科手术难以根治性切除病灶,自体肝移植手术[2]为这些患者带来治愈疾病的希望,然而自体肝移植手术的复杂程度及对机体的创伤远高于常规肝脏切除手术,术前需要准确的评估肝脏储备功能,从而严格筛选合适的手术病例。在临床工作中,Child-Pugh分级评分是术前评价肝脏功能常用的方法,然而该评分系统仍有一定缺陷[3]。目前通过影像学方法评价肝脏的储备功能的方式主要是术前对于残肝体积的计算,残肝体积的大小与肝细胞数量的多少相关,可以在一定程度上反应肝脏的贮备功能,然而目前对残肝肝细胞功能状态的影像学评估研究较少。本研究拟通过研究HAE患者的磁共振T1-mapping、T2-mapping成像特征,比较不同Child-Pugh分级评分的HAE患者残肝的T1值、T2值是否存在差异,探讨T1-mapping、T2-mapping成像技术在评价HAE肝储备功能中的价值。
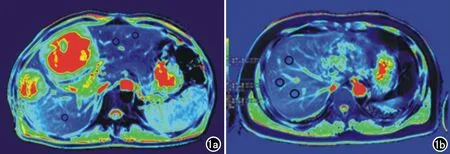
图1 病例组及正常对照组兴趣区设置示意图。a) 肝方叶及肝右前叶可见肝泡型包虫病灶,选取远离病灶1cm以上正常肝实质进行测量; b) 正常对照组肝脏,测量点选取在肝右叶。
材料及方法
1.临床资料
本研究为前瞻性研究,得到新疆医科大学第一附属医院伦理委员会批准,检查前患者均签署知情同意书。连续搜集2016年1月-2016年10月本院行磁共振T1-maping及T2-maping扫描的36例HAE患者(病例组)和20例肝脏功能正常的健康志愿者(对照组),平均年龄(48±7)岁。病例组纳入标准:临床初诊为HAE的患者。排除标准:①影像检查排除HAE;②HAE巨大,正常残肝组织过小无法测值者;③合并其他影响肝功能疾病者,如肝硬化、脂肪肝等;④运动伪影严重,无法测量者。根据Child-Pugh分级评分(评分标准参考人卫第8版内科学表4-1-1)将病例组分为肝功能A级组(n=14)、B级组(n=12)和C级组(n=10),见表1。
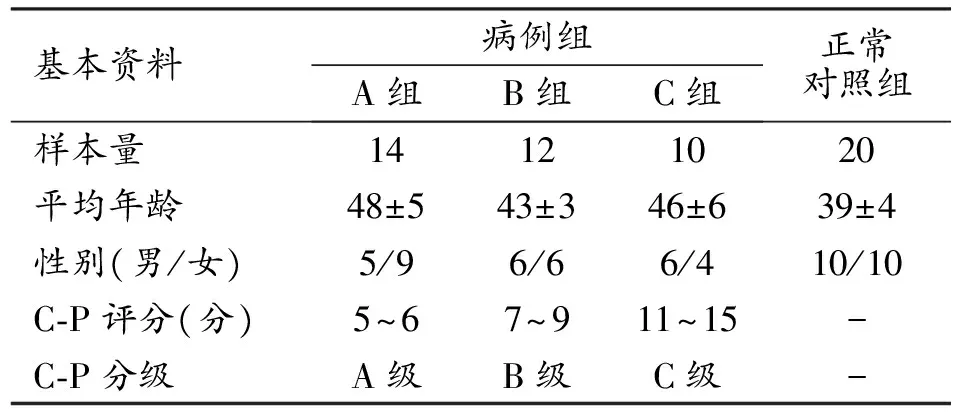
表1 研究人群的基本情况
2.检查方法
MR检查前,病例组空腹采血进行各项生化指标检查。MR检查和血生化检查的时间间隔不超过2天。
采用Siemens Avanto DOT 1.5T 磁共振成像扫描仪,体部线圈,患者取仰卧位扫描。扫描范围由膈顶至肝下缘,扫描包括常规序列(T1WI、T2WI、压脂序列)及横轴面T1-mapping、T2-mapping序列。T1-mapping扫描参数:TR 15 ms,TE 1.79 ms,视野380 mm×380 mm,FOV相位100%,相位分辨力100%,层厚5 mm,层间距2 mm,矩阵256×256;T2-mapping扫描参数:TR 1000 ms,TE 13.7 ms,视野380 mm×380 mm,FOV相位68.8%,相位分辨力100%,层厚8 mm,层间隔1.6 mm,矩阵256×256。本研究中T1-mapping屏气扫描,T2-mapping序列采用呼吸触发扫描。
3.图像分析
扫描图像传输至磁共振扫描仪自带的后处理工作站,由1名影像医师评价图像质量并进行图像数据测量。兴趣区设置原则:①病例组测量时观察伪彩图颜色的改变并参照常规序列观察病灶实性部分及病灶边界,选取距离病灶1 cm以上正常肝实质进行测量(图1a);②由于肝左叶肝顶部易受心脏搏动影响,所以正常对照组测量点选取在肝右叶(图1b),病例组在肝左叶选取ROI时尽量选择在Ⅲ段进行测量;③肝组织与周围的脏器易产生磁敏感伪影,测量时应尽量选择不靠近肝缘同时避开大血管、胆管进行。每个病例测量三个不同位置1.5 cm2左右圆形ROI的T1、T2值,计算平均值作为该病例的T1、T2值。
4.统计学分析

更加清晰其内大片状液化坏死区; d) T1-mapping序列肝右叶病灶囊性成分呈现红色或黄色区域,实性成分呈现绿色或淡蓝色区域,残肝组织呈均匀的蓝色区域; e) T2-mapping序列肝右叶病灶囊性成分呈现红色或黄色区域,实性成分呈呈现深蓝色区域,残肝组织呈均匀的蓝色区域。
图2 a) 正常肝实质在T1-mapping序列上均表现为信号均匀的蓝色区域,其中相间的肝内血管表现为淡蓝色,腹腔胃肠道内的自由水,表现为红色或者黄色; b) 正常肝实质在T2-mapping序列上均表现为信号均匀的蓝色区域,其中相间的肝内血管表现为淡蓝色,腹腔胃肠道内的自由水,表现为红色或者黄色。图3 男,37岁,肝泡型包虫病。a) 横轴面T1WI示示肝右叶可见不规则实性病灶,边界不清; b) 横轴面T2WI示病灶内大片状液化坏死区; c) 横轴面T2压脂序列示病灶

表2 各组T1、T2值的变化 (ms)

表3 各组T1、T2值两两比较
使用SPSS 17.0统计软件包,对照组与病例A、B、C三组的组间比较采用单因素方差分析,组间两两比较用LSD法,以P<0.05为差异有统计学意义。
结 果
1.正常肝脏T1-mapping、T2-mapping影像表现
正常肝实质在T1-mapping、T2-mapping序列上信号均匀,在T1-mapping、T2-mapping伪彩图上表现为均匀的蓝色区域,其中相间的肝内血管表现为淡绿色。腹腔胃肠道内的自由水,T1、T2值较高,表现为红色或者黄色(图2)。
2.肝泡球蚴病T1-mapping、T2-mapping影像表现
36例肝泡球蚴患者中,10例病灶分布在肝左叶,14例病灶分布在肝左内叶及肝右前叶,12例病灶分布在肝右叶,36例患者中10例行手术治疗,其中6例术后复发,其余26例行药物治疗。肝内泡型包虫病灶在常规序列表现为肝内不均质肿块,边界不清,其内可见大片状液化坏死区(图3a~c)。在T1-mapping、T2-mapping序列上残肝实质表现同正常肝脏,为信号均匀的蓝色区域,而病灶轮廓显示更加清晰,其内液化坏死区T1、T2值较高,呈现红色或黄色区域,病灶内实性成分T1-mapping序列T1值高于正常肝组织低于液化坏死区,呈现绿色或淡蓝色区域,T2-mapping序列T2值低于正常肝组织也低于液化坏死区,呈深蓝色区域,但病变的钙化区域及小囊泡表现不明显(图3d、e)。

图4 a)镜下示HAE病灶(HE,×40); b) 镜下示病灶周围边缘带肝组织间见胶原纤维增生,大量炎细胞(包括淋巴细胞、浆细胞、嗜酸性粒细胞、中性粒细胞)浸润(HE,×40); c) 镜下示远离病灶肝细胞轻度水肿伴点灶状坏,肝窦扩张,炎细胞浸润,kuffer细胞增生,多处汇管区明显扩大,中度界面性炎形成,胆管增生(HE,×100)。
3.T1-mapping、T2-mapping成像定量分析
正常对照组、病例组的T1、T2值见表2。4组间T1、T2值的比较见表3。四组间T1值比较组间差异没有统计学意义(F=1.696,P>0.05),四组间T2值比较组间差异有统计学意义(F=70.323,P<0.05)。T2值四组两两比较,正常对照组与病例A组间差异无统计学意义(P>0.05),正常对照组与病例B组及C组间差异有统计学意义(P<0.05),病例组间两两比较差异均有统计学意义(P<0.05)。
4.Child-Pugh分级与HAE患者残肝病理的关系
由于C-P分级B、C级的HAE患者不适宜行手术治疗,最后本研究只取得了肝功能A级患者残肝的病理结果。肝功能A级的HAE患者行肝叶切除及自体肝移植术后病理结果显示远离病灶的周围肝实质主要改变为炎性反应、细胞水肿、坏死,肝纤维化不明显(图4)。
讨 论
对于终末期HAE患者,术前准确评价肝储备功能对于治疗方式的选择至关重要,它不仅关系到患者是否可以耐受手术,并且外科医生可以根据患者的肝储备功能的情况,制定恰当的手术切除范围[4]。国内外研究结果显示肝体积大小可以反映肝脏实质细胞容量的变化,肝脏体积与肝脏储备功能之间具有很高的相关性, 可以用于评估肝脏切除手术风险和指导治疗方式的选择[5],己被视为与Child-Pugh分级评分同等重要的评价肝脏储备功能的指标[6]。目前影像学检查及其3D后处理技术能够准确的测量残肝体积[7],是肝脏外科术前评估的一项重要内容,然而肝脏体积大小并不能反应肝实质细胞功能的好坏,基于影像学检查评估肝脏的贮备功能的探索是当前热点研究之一。
不同组织的T1和T2弛豫时间不同,而常规的T1加权与T2加权图像分别混有T2及T1弛豫信息,无法进行定量测定,T1-mapping及T2-mapping技术能够准确的测量肝脏组织的T1和T2弛豫时间,进行定量分析。从理论上讲,当肝脏细胞受到损害,发生水肿、变性、坏死及纤维化时,其弛豫时间会出现相应的变化,通过测量弛豫时间进行定量分析,是能够间接反映着肝脏组织功能状态的。Kamimura等[8]及Ding等[9]应用T1-mapping技术定量评价肝功能的研究中认为,T1-mapping成像可作为一种基于MRI的肝功能检查技术。张小彪等[10]认为组织弛豫速度的差异使T2值可以反映组织内磁敏感性的改变。因此,T2-mapping成像可以定量观察肝脏组织结构的动态变化。
泡球蚴病灶由无数小囊泡构成,小囊泡的角皮层发育不完全,囊液不断外渗在周围组织内浸润,激发人体宿主细胞免疫反应,形成以小囊泡为中心的肉芽组织结构[11],进而肝实质细胞不断被破坏,随着泡球蚴病灶的增大,周围的组织也因受压迫而发生萎缩、变性甚至坏死,最终引起患者肝功能下降甚至衰竭[12]。本研究通过对Child-Pugh分级肝功能A级的HAE患者术后残肝组织病理学观察发现,残肝的病理学改变主要是肝细胞的水肿、变性和坏死,残肝组织发生纤维化少见或者不存在。肝细胞的水肿、变性使细胞体积增大,细胞内含水量增加,理论上这种病理变化会导致肝组织T1、T2弛豫时间延长[13]。本研究结果也显示病例组患者T2弛豫时间确实随着Child-Pugh分级增加而呈上升趋势,是因为T2-mapping技术对水成分敏感,在组织水肿方面有较高的敏感度及特异度。但各组间的T1弛豫时间差异无统计学意义,这与Besa等[14]报道的利用T1-mapping技术增强前定量评价肝功能的研究结果相似。目前的研究显示T1-mapping技术在定量评估脏器纤维化方面具有潜在价值,尤其是在评价心肌纤维化方面有突出贡献[15],而HAE患者多数无慢性肝病、肝纤维化病史。汪苍等[16]利用这两种技术评价大鼠大鼠肝纤维化分期的研究中也显示,T1值与肝纤维化病理学分期呈正相关,T2值与肝纤维化病理学分期无明显相关性。本研究还发现肝功能A级的HAE患者残肝的T2值与健康志愿者T2值间差异无统计学意义,这也映证了Child-Pugh分级评分A级肝功能的患者接受自体肝移植手术是相对安全的。
本研究结果表明,磁共振T2-mapping成像可以用于定量分析HAE患者残肝储备功能,随着HAE患者肝功能受损程度的加重,T2值逐渐增高,因此T2-mapping技术有可能成为评价HAE肝脏储备功能的一项影像学评估方法,为临床医生制定HAE患者的治疗方案提供一定的帮助。
本研究的不足之处是病例样本量偏小,需要进一步积累临床病例。T1-mapping成像评价肝储备功能目前多使用肝细胞特异性对比剂进行肝胆期扫描,测量T1弛豫时间的差值来反应肝细胞对对比剂的摄取,但本研究未能涉及肝细胞特异性对比剂进行T1-mapping成像。
