MR扩散加权成像对Ⅰ型与Ⅱ型子宫内膜癌的鉴别诊断价值
2019-03-21顾亮亮李海明刘佳冯峰
顾亮亮, 李海明, 刘佳, 冯峰
子宫内膜癌是目前最常见的妇科恶性肿瘤之一,其发生率逐步上升[1-2]。1983年Bokhman首次将子宫内膜癌分为Ⅰ型和Ⅱ型[3],其中Ⅰ型为雌激素依赖性,占80%~90%,病理类型为子宫内膜样腺癌,预后良好;Ⅱ型为非雌激素依赖型,占10%~20%,常见的病理类型包括低分化子宫内膜样癌(3级)、乳头状浆液性癌和透明细胞癌等,预后差[4]。以往的研究证明磁共振扩散加权成像(DWI)在子宫内膜癌的术前诊断、分期与分级中起着至关重要的作用[5-8],但关于Ⅰ型和Ⅱ型子宫内膜癌鉴别诊断的研究还未见相关报道。因此,本研究的目的是探讨DWI对Ⅰ型和Ⅱ型子宫内膜癌的鉴别诊断价值。
材料与方法
1.病例资料
回顾性分析2016年1月-12月经手术病理证实的101例子宫内膜癌患者的MRI资料,8例患者因病灶太小(<1.0 cm)而无法准确测量ADC值被排除。最终93例患者被纳入研究,年龄34~76岁,平均(56.0±8.8)岁。93例患者中,Ⅰ型子宫内膜癌71例,Ⅱ型子宫内膜癌22例。临床症状表现为绝经前的经量增多、经期延长、经期不规则阴道出血或绝经后阴道出血。所有患者均在检查后两周内进行手术。
2.设备及检查方法
采用Siemens Avanto/Espree 1.5T MR超导扫描仪,相控阵体线圈。患者仰卧,自由呼吸,先行常规MRI平扫。扫描参数:矢状面T2WI抑脂序列,TR 4000 ms,TE 83 ms;横轴面T1WI,TR 761 ms,TE 10 ms;横轴面T2WI抑脂序列,TR 8000 ms,TE 83 ms;冠状面T2WI,TR 4000 ms,TE 98 ms;视野(300~380) mm×(320~400) mm ;横轴面T1WI抑脂序列,TR 4.89 ms,TE 2.38 ms;矩阵256×256 或320×320;层厚4.0~8.0 mm,层距1.2~1.5 mm;激励次数4。增强扫描为横轴面、矢状面T1WI 抑脂序列,对比剂采用钆喷替酸葡甲胺,剂量0.2 mmol/kg,注射流率2~3 mL/s,扫描参数同平扫。DWI采用单次激发平面回波成像序列行横轴面扫描:TR 3200 ms,TE 83 ms,b值取0和1000 s/mm2,层厚5 mm,层距1.2 mm,矩阵320×256,视野238 mm× 280 mm,激励次数4,扫描时间1 min 24 s。
3.ADC值的测量
由两名放射科医师分别进行数据测量及分析。对于肿瘤兴趣区(region of interest,ROI)的选择,参照常规T2WI及动态增强图像,在肿瘤最大层面的ADC图像上进行ADC值的测量,沿着肿瘤边缘勾画不规则形ROI,ROI放置时尽量避开囊变、出血、坏死及可见的血管区域,测量3次取平均值。
4.统计学方法
采用SPSS 23.0统计软件包进行分析,所有计量资料均进行one Kolmogorov-Smirnov正态性检验,符合正态分布的采用均数±标准差表示,否则采用中位数[四分位数区间P25,P75]表示。采用Mann-Whitney U检验比较Ⅰ型和Ⅱ型子宫内膜癌的年龄及ADC值间的差异。采用Fisher确切概率法比较两组间肌层浸润程度的差异。采用组内相关系数(intraclass correlation coeeficient,ICC)评价两医师间的测量可重复性。利用ROC曲线分析ADC值在两组中的鉴别诊断效能。以P<0.05为差异有统计学意义。
结 果
1.临床病理特征
患者的临床病理学分型见表1。Ⅰ型、Ⅱ型子宫内膜癌患者的平均年龄分别为(54.0±8.7)岁、(61.0±6.8)岁,两组间年龄差异具有统计学意义(Z=-3.489,P<0.001)。71例I型子宫内膜癌中,绝大多数为高分化的G1级(58/71,82%,图1)。22例Ⅱ型子宫内膜癌中,低分化的G3级子宫内膜样癌14例(14/22,64%,图2)。Ⅰ型和Ⅱ型内膜癌均以浅肌层浸润为主(58/71,82% vs 13/22,59%),且肌层浸润的深度在两组间差异具有统计学意义(P=0.01)。
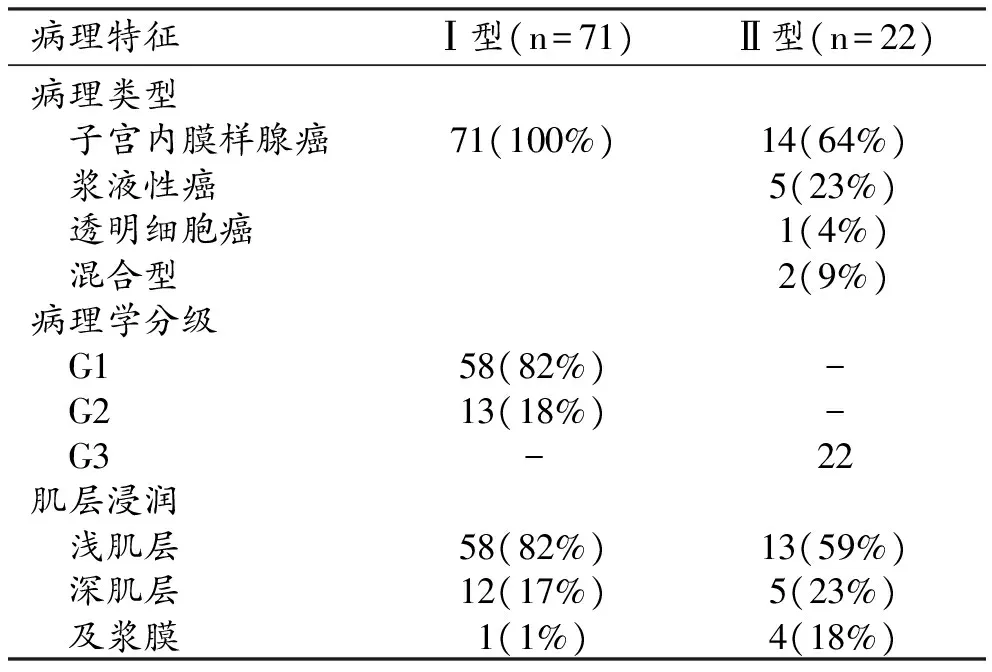
表1 患者的临床病理分型
2.ADC值鉴别诊断效能及组间测量一致性
Ⅰ型子宫内膜癌ADC值为0.653×10-3~1.508×10-3mm2/s,中位数为0.876 [0.813,0.972]×10-3mm2/s,II型子宫内膜癌的ADC值为0.573×10-3~1.044×10-3mm2/s,中位数为0.73[0.626,0.868]×10-3mm2/s,Ⅱ型子宫内膜癌显著低于Ⅰ型,差异有统计学意义(Z=-3.982,P<0.001,图1~3)。对两组间的ADC值进行ROC曲线分析(图4),曲线下面积为0.782,95%可信区间为(0.658,0.906),当ADC值≤0.743×10-3mm2/s时,敏感度为64%,特异度为90%,符合率为84%。医师1和医师2分别测量ADC值的ICC为0.949,95%可信区间为(0.925,0.966)。
讨 论
1.概述
子宫内膜癌的预后与肌层浸润深度、组织学类型及是否有淋巴结转移等因素密切相关。Ⅱ型内膜癌是一类具有异质性的中高危肿瘤,与淋巴血管浸润具有相关性,为了进一步提高患者的生存率,临床上推荐行盆腔和主动脉旁的淋巴结清扫术[9-11]。因此,术前准确预测Ⅱ型子宫内膜癌有助于妇科医师制定合理的手术方案。本研究的结果显示Ⅱ型内膜癌具有更低的ADC值,且笔者采用的单层面不规则形ROI具有非常好的测量可重复性[12]。故DWI能够反映Ⅰ型和Ⅱ型内膜癌间的生物学差异,有助于它们的鉴别诊断。
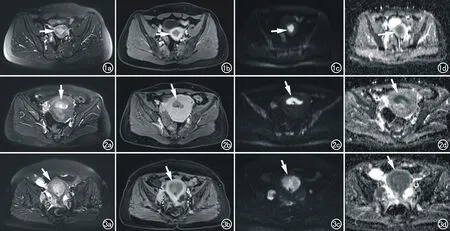
图1 53岁,Ⅰ型子宫内膜癌,子宫内膜样腺癌Ⅰ级,侵及浅肌层。a) T2WI示子宫腔内结节状稍高信号影(箭),信号尚均匀,边界清晰; b) T1WI增强示病灶呈轻度不均匀强化(箭); c) DWI示病灶呈明显高信号(箭); d) ADC图,绿色区为肿瘤ROI(箭),病灶呈明显低信号,ADC值约0.936×10-3mm2/s。 图2 Ⅱ型子宫内膜癌,52岁,子宫内膜样腺癌Ⅲ级,侵及浅肌层。a) T2WI示子宫腔内团块状不均匀稍高信号影(箭),形态不规则; b) T1WI增强示病灶呈轻度不均匀强化(箭); c) DWI示病灶呈显著高信号(箭); d) ADC图,绿色区为肿瘤ROI(箭),ADC值约0.627×10-3mm2/s。 图3 Ⅱ型子宫内膜癌,60岁,子宫内膜浆液性癌,侵及子宫全层。a) T2WI示子宫腔内团块状混杂稍高信号影,病灶局部与子宫肌层分界不清(箭); b) T1WI增强示病灶呈轻-中度不均匀强化(箭); c) DWI示病灶呈不均匀高信号(箭); d) ADC图,绿色区为肿瘤ROI,病灶呈不均匀低信号,ADC值约0.885×10-3mm2/s。
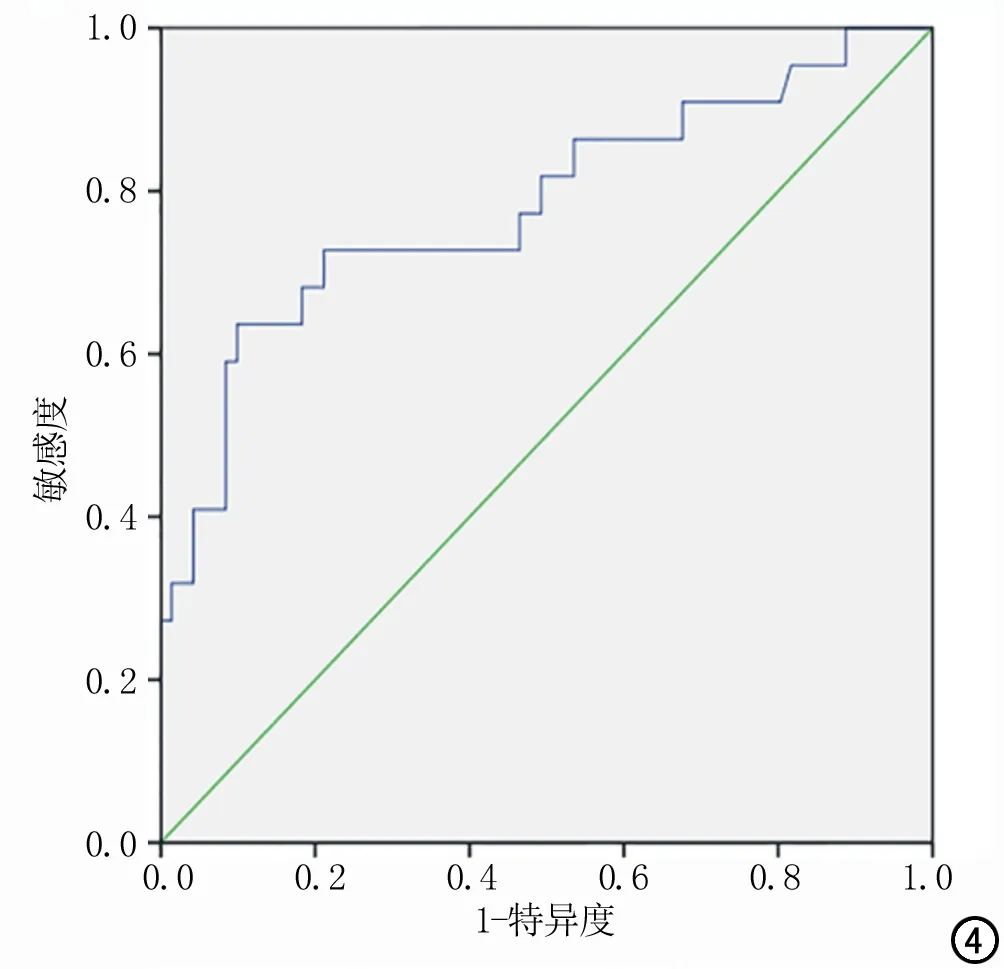
图4 ADC值鉴别Ⅰ型和Ⅱ型子宫内膜癌的ROC曲线,曲线下面积为0.782。
2.DWI对Ⅰ型和Ⅱ型内膜癌的鉴别诊断价值
DWI虽已广泛应用于子宫内膜癌的临床研究中,但本研究首次关注了子宫内膜癌分型(Ⅰ型和Ⅱ型)的DWI研究,原因可能为对此种“二元论分型”的认识不足或不够重视。DWI主要反映细胞外水分子扩散受限的程度,一般来说,恶性肿瘤或者高级别肿瘤由于细胞增殖速度快、核大且结构更致密、细胞外间隙减小而导致扩散受限及ADC值下降[5]。本研究中Ⅱ型内膜癌的ADC值显著低于Ⅰ型,其病理学基础是内膜样腺癌常表现为腺体高度异常增生,并形成筛孔状结构,但当级别越高时,腺体结构减少甚至消失,形成实性癌块;而浆液性癌呈致密乳头状或簇状生长,透明细胞癌则多呈实性片状、腺管样或乳头状排列[4]。刘海东等[13]研究显示ADC值有助于子宫内膜的分级,但他们将G2和G3归为一组与G1进行比较;国外学者Bharwani等[8]和Kishimoto等[14]研究认为ADC值与内膜癌分级无明显相关性;上述这些结论一定程度上反映了子宫内膜癌的生物学行为可能更符合“二元论分型”的分型方法而不是简单的分级。此外,Fukunaga等[15]研究显示三个半定量动态对比增强MRI参数(较大的相对信号增强程度、较快的对比剂流入率及较高的最大增强程度与梨状肌信号强度比率)有助于Ⅱ型内膜癌的诊断,说明Ⅱ型的血管新生速度更快,这一结果也支持本研究的结论。
本研究选择肿瘤最大层面沿着病灶边缘采用不规则形ROI进行ADC值测量,并具有非常好的测量可重复性,ICC值达0.949。Inoue等[16]采用不规则形、矩形、圆形及5个小圆形四种不同ROI来评价子宫内膜癌患者的ADC值测量一致性,结果显示ROI的形态和画法并不会对ICC产生影响,且均具有非常好的可重复性,ICC值为0.93~0.96;而Ma等[17]研究则显示不同的ROI会对胰腺癌患者ADC值测量的一致性产生显著影响。
3.ROC曲线结果分析
ROC曲线分析显示ADC值鉴别Ⅰ型和Ⅱ型子宫内膜癌具有较高的特异度(90%)和符合率(84%),但敏感度较低为64%,说明ADC值在两组间具有一定重叠。推测原因可能为单独依赖ADC值还不足以敏感的反映两组间的差异,ADC值的测量混合了灌注成分的影响,体素内不相干运动(IVIM)成像能够区分扩散和灌注成分,也许能为两者的鉴别提供更多的信息;此外II型内膜癌的样本量较低也可能影响鉴别的敏感度。
4.本研究存在的局限性
①本研究是回顾性分析,患者的入组会存在选择偏倚。②患者数量相对较少;特别是浆液性癌和透明细胞癌的病例,需要较大样本量的前瞻性研究来验证本研究的结果。③本研究中并未纳入子宫内膜良性病变患者,例如子宫内膜增生和子宫内膜息肉,以及其它类型恶性肿瘤如子宫癌肉瘤、子宫内膜间质肉瘤和子宫腺肉瘤等,而进一步全面评估ADC值区分子宫内膜病变的能力可能更具临床价值。④ROI选择肿瘤最大层面沿着病灶边缘勾画,并不能反映肿瘤的整体,而基于全肿瘤体积的ADC值测量能够更精确的反映肿瘤的异质性[18]。
总之,ADC值可用于鉴别Ⅰ型和Ⅱ型子宫内膜癌,较低的ADC值往往提示为Ⅱ型子宫内膜癌。
