柴胡皂苷a抑制PTZ诱导的小鼠海马星形胶质细胞活化*
2019-03-21张继龙笱玉兰罗利俊
单 萍,张继龙,笱玉兰,罗利俊
(武汉市第一医院神经内科, 湖北 武汉 430022)
癫痫是一种全球范围内最为常见的神经系统综合征,主要表现为神经过度兴奋以及神经元突发性产生生物电信号导致的癫痫发作,其特点是反复发作,扰乱正常的大脑功能,并有可能损伤大脑,使原有的神经系统缺陷持续恶化。其中,颞叶癫痫是成人癫痫患者中最为常见的类型,其主要特点是海马区硬化。由于药物治疗的临床疗效不佳,颞叶癫痫现已成为具有药物抵抗性的难治性癫痫,占难治性癫痫总人数的50%以上[1]。传统观念认为,癫痫的发生是由神经元异常产生的,但越来越多的研究数据显示,星形胶质细胞的功能紊乱和代谢稳态失调参与神经元的过度兴奋、神经毒性和癫痫的发作[2-3]。使用代谢抑制剂抑制星形胶质细胞新陈代谢时,可导致癫痫的发作[4]。这表明,星形胶质细胞在维持正常大脑活性中具有关键的作用。研究发现,星形胶质细胞增生和神经炎症与癫痫发生、复发和自发性发作有关[5-6]。柴胡皂苷a(Saikosaponin a, SSa)是临床常用中药柴胡的主要药理成分柴胡皂苷的一种单体成分,具有多种药理功能,如抗癫痫、抗抑郁和抗惊厥等[7-8]。本研究在前人研究的基础上,使用戊四氮(pentylenetetrazole, PTZ)和SSa处理原代培养的小鼠星形胶质细胞,进一步探究SSa对PTZ诱导的小鼠海马星形胶质细胞活化的影响。
材 料 和 方 法
1 实验材料
DMEM/F12培养基购自Gibco(11320082);PTZ购自Sigma(P6500);柴胡皂苷a购自国药集团化学试剂有限公司(xw080063);小鼠抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)单克隆抗体和小鼠荧光II抗购自Abcam(ab10062和ab150116);细胞周期检测试剂盒、Annexin V-FITC/PI凋亡检测试剂盒和Hoechst 33258染色液购自碧云天生物技术公司(C1052、C1062和C1011);小鼠GFAP和间隙连接蛋白43(connexin 43,Cx43)的ELISA检测试剂盒购自Biocompare(orb409337和MBS2019835)。
2 方法
2.1小鼠海马星形胶质细胞的分离及培养 小鼠海马星形胶质细胞的体外原代培养参考Mccarihy法并加以改进[9]。取1~3 d新生C57BL/6小鼠,乙醇消毒后开颅处理,小心剔除血管和脑膜,分离海马组织,剪碎组织,并进行细胞消化和离心,差速贴壁40 min后,采用含15%胎牛血清的DMEM/F12完全培养基接种细胞,细胞密度控制为1×109/L。将接种细胞置于37 ℃、5% CO2孵箱中培养7~9 d,待细胞融合度达到70%~80%时,将培养瓶置于37.0 ℃恒温旋转摇床(240 r/min)上摇18 h后,后续传代培养即可获得纯化的星形胶质细胞。
2.2细胞鉴定 采用免疫荧光检测星形胶质细胞标志物GFAP对分离培养的小鼠海马星形胶质细胞进行鉴定。将培养的小鼠海马星形胶质细胞接种至预先放置有盖玻片的培养皿中,待细胞融合度达到80%左右时,取出细胞培养皿,清洗细胞后依次采用4%多聚甲醛、0.5%Triton X-100和5%BSA处理细胞,随后加入GFAP I抗稀释液,室温孵育1 h后,清洗后加入荧光II抗稀释液,避光室温孵育1 h。取出干净的载玻片,滴1滴抗荧光淬灭封片液(含DAPI)(15~20 μL),用镊子小心取出盖玻片,将纸巾搭在边缘吸去多余液体,细胞面朝下,小心贴在载玻片上。荧光显微镜镜检观察。
2.3细胞分组及处理 将鉴定成功的小鼠海马星形胶质细胞接种于6孔培养板中,每孔5×105个细胞,培养48 h后,采用无血清DMEM/F12培养基更换细胞培养基,将细胞随机分为4组:对照(control)组、PTZ组、0.625 mg/L SSa组和1.25 mg/L SSa组。PTZ组细胞采用10 mmol/L PTZ进行药物诱导刺激2 h;0.625 mg/L SSa组和1.25 mg/L SSa组细胞在采用10 mmol/L PTZ进行药物刺激之前,依次采用0.625 mg/L SSa和1.25 mg/L SSa预处理细胞6 h。
2.4MTT法检测细胞活力 选取生长状态良好的海马星形胶质细胞,制备单细胞悬液,调整细胞浓度后,接种2.5×104个细胞于96孔板内,每组设置3个复孔,轻轻混匀后置于培养箱中培养过夜。各组按照相应的处理方式进行处理,待药物作用时间结束后,每孔加入20 μL 0.5% MTT溶液,混匀后继续孵育4 h,小心去掉上清后加入150 μL DMSO,低速震荡混匀后,采用酶标仪检测490 nm处吸光度(A)值。
2.5流式细胞术检测细胞周期 待各组细胞药物处理时间结束后,采用胰酶消化制备和收集单细胞悬液, 300×g4 ℃离心5 min,弃去上清后采用预冷的PBS清洗细胞1次后加入300 μL PBS重悬细胞,逐滴加入700 μL预冷的70%乙醇,轻轻吹打混匀后置于4 ℃固定24 h。1 000×g离心5 min,沉淀细胞后弃去上清。每个样本加入500 μL染色缓冲液重悬细胞并转入1.5 mL 离心管中,然后加入10 μL RNase A溶液,25 μL 碘化丙啶染色液,轻轻混匀后置于37 ℃避光温浴30 min。随后置于冰上,即时采用流式细胞仪检测荧光信号。
2.6Hoechst 33258染色 将各组细胞培养液去掉,PBS清洗2次后加入800 μL 4%多聚甲醛固定细胞,室温固定10 min,清洗后,均匀地滴加300~500 μL Hoechst 33258染色液,室温孵育3~5 min。染色结束后采用PBS清洗3遍后,取出干净的载玻片,滴1滴抗荧光淬灭封片液(15~20 μL),用镊子小心取出盖玻片,将纸巾搭在边缘吸去多余液体,细胞面朝下,小心贴在载玻片上。荧光显微镜镜检观察。
2.7流式细胞术检测细胞凋亡 待各组细胞药物处理时间结束后,收集单细胞悬液,1 000×g,室温离心5 min,弃上清,采用PBS清洗2次后采用100 μL Binding Buffer重悬细胞,依次加入5 μL Annexin V-FITC和5 μL PI染色液,轻轻混匀后,室温避光孵育30 min。孵育时间结束后加入300 μL Binding buffer终止反应,随即进行流式细胞仪检测。
2.8ELISA检测各组细胞中GFAP和Cx43表达 待各组细胞药物处理时间结束后,收集细胞沉淀,采用小鼠的GFAP和Cx43的ELISA检测试剂盒检测各组细胞中GFAP和Cx43蛋白表达水平。具体操作参照ELISA检测试剂盒说明书。
3 统计学分析
实验数据采用均数±标准差(mean±SD)表示。各组间统计学差异性检验采用单因素方差分析,组间多重比较采用Bonferroni校正的t检验。以P<0.05表示差异有统计学意义。
结 果
1 小鼠海马星形胶质细胞的培养和鉴定
镜检显示,原代分离培养的小鼠海马星形胶质细胞贴壁生长,生长状态良好,细胞突起明显可见,向外伸出,长短不一,见图1A。采用细胞免疫荧光法鉴定,结果显示细胞呈GFAP阳性表达,证明分离的细胞为星形胶质细胞,见图1B。
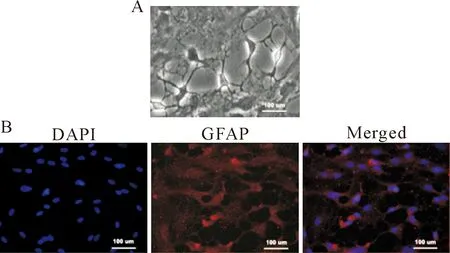
Figure 1.Mouse hippocampal astrocytes and their GFAP immunofluorescence staining. A: the morphological changes of mouse hippocampal astrocytes culturedinvitro(×200); B: mouse hippocampal astrocyte GFAP immunofluorescence positive expression (×200).
图1小鼠海马星形胶质细胞及其GFAP免疫荧光染色
2 PTZ诱导小鼠海马星形胶质细胞活化及SSa的干预作用
采用MTT法检测PTZ诱导下星形胶质细胞的活力,结果显示,PTZ组细胞活力显著高于对照组(P<0.05);与PTZ组比较,PTZ+0.625 mg/L SSa组和PTZ+1.25 mg/L SSa组细胞活力明显降低(P<0.05);且PTZ+1.25 mg/L SSa组细胞活力较PTZ+0.625 mg/L SSa组更低(P<0.05)。这表明PTZ能够显著活化体外培养的小鼠海马星形胶质细胞,而SSa对PTZ的这一作用具有显著的抑制作用,见图2。
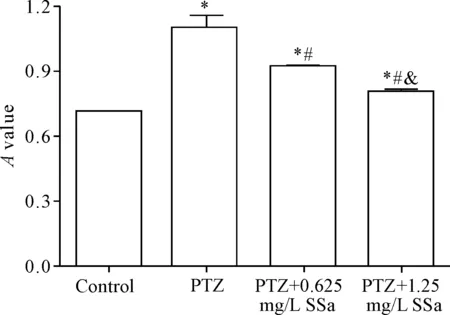
Figure 2.The viability of the astrocytes in each group was mea-sured by MTT assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPTZ group;&P<0.05vsPTZ+0.625 mg/L SSa group.
图2MTT法检测各组星形胶质细胞的活力
3 SSa对PTZ激活的小鼠海马星形胶质细胞周期的影响
进一步检测SSa对PTZ活化的小鼠海马星形胶质细胞增殖周期的影响,结果显示,PTZ组G0/G1期细胞百分比较对照组显著降低(P<0.05),但G2/M期细胞百分比较对照组显著升高(P<0.05);与PTZ组相比,PTZ+0.625 mg/L SSa组和PTZ+1.25 mg/L SSa组G0/G1期细胞百分比均明显升高,G2/M期细胞百分比均显著降低(P<0.05);且PTZ+0.625 mg/L SSa组与PTZ+1.25 mg/L SSa组各时期细胞百分比也具有统计学差异(P<0.05),见图3。这一结果表明,PTZ能够促进海马星形胶质细胞增殖,SSa能抑制PTZ诱导的细胞增殖。
4 SSa对小鼠海马星形胶质细胞凋亡的影响
PTZ组Hoechst 33258染色强阳性细胞数量较少,与对照组类似;但与PTZ组比较,PTZ+0.625 mg/L SSa和PTZ+1.25 mg/L SSa组Hoechst 33258染色强阳性细胞数量明显增加,见图4A。进一步流式细胞术检测细胞凋亡率,结果显示,PTZ组和对照组细胞凋亡率均较少,组间比较无显著差异;与PTZ组比较,PTZ+0.625 mg/L SSa和PTZ+1.25 mg/L SSa组细胞的凋亡百分比均显著增加(P<0.05),见图4B。这表明,SSa可促使小鼠海马星形胶质细胞发生凋亡。
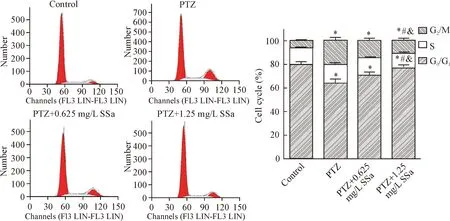
Figure 3.The detection of cell cycle of astrocytes by flow cytometry. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPTZ group;&P<0.05vsPTZ+0.625 mg/L SSa group.
图3流式细胞术检测星形胶质细胞的细胞周期
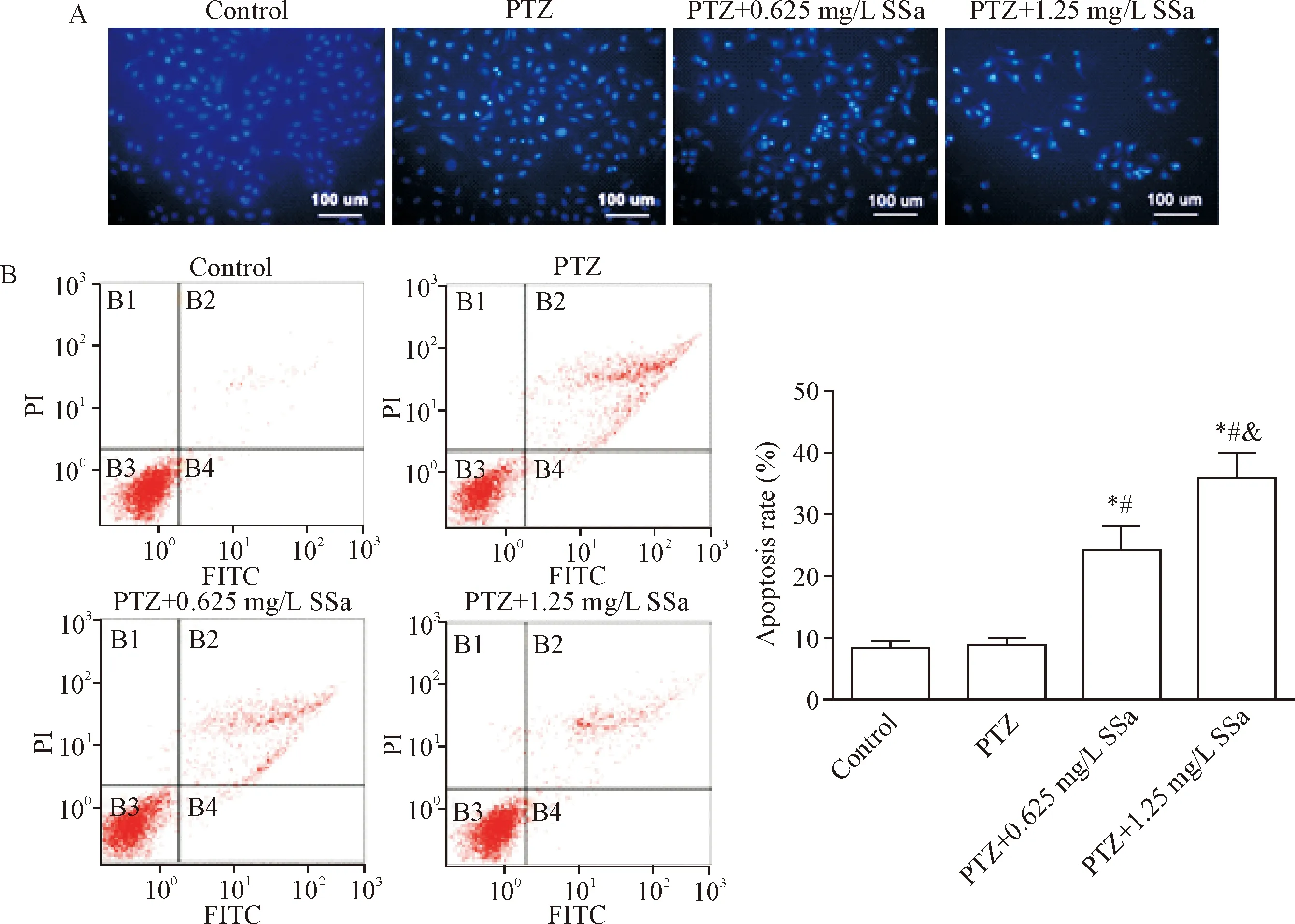
Figure 4.Apoptosis level detection and quantitative statistics in the astrocytes. A: apoptosis of the astrocytes was detected by Hoechst 33258 staining (×200); B: flow cytometry for the detection and statistical analysis of apoptosis of the astrocytes. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPTZ group;&P<0.05vsPTZ+0.625 mg/L SSa group.
图4星形胶质细胞的凋亡水平检测及定量统计
5 SSa对PTZ激活的小鼠海马星形胶质细胞GFAP和Cx43蛋白表达的影响
检测不同处理条件下星形胶质细胞中GFAP和Cx43蛋白表达水平时发现,与对照组相比,PTZ可显著增加细胞中GFAP蛋白表达水平,同时上调Cx43蛋白的表达(P<0.05);与PTZ组相比,PTZ+0.625 mg/L SSa组和PTZ+1.25 mg/L SSa组细胞中GFAP和Cx43蛋白表达水平显著降低(P<0.05),见图5。这些结果表明,SSa能够抑制PTZ诱导的星形胶质细胞中GFAP和Cx43的表达。

Figure 5.Protein expression levels of GFAP and Cx43 in the astrocytes of each group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsPTZ group;&P<0.05vsPTZ+0.625 mg/L SSa group.
图5各组星形胶质细胞中GFAP和Cx43的蛋白表达水平
讨 论
据统计,全球癫痫患者数量高达五千万,我国癫痫患者占比全球癫痫患者的18%,其中55%~67%的癫痫患者为活动性癫痫患者[10]。目前,癫痫的治疗手段仍是以抗癫痫药物治疗为主,尽管药物治疗已取得了明显的进步和疗效,由于癫痫患者对药物的耐药性或其他原因,仍有30%患者的治疗效果不佳,成为难治性癫痫[11]。
研究显示,柴胡总皂苷可抑制PTZ慢性点燃大鼠的痫性放电,进而抑制癫痫大鼠的发作,降低癫痫发作的级别和发作次数,即对PTZ慢性点燃癫痫进程具有一定的抑制作用[12]。柴胡总皂苷是中草药柴胡的主要成分,依据其化学结构的不同可分为多种单体,其中SSa和柴胡皂苷d(SSd)是柴胡皂苷的有效成分,具有抗炎、抗肿瘤、抗病毒和抗癫痫等多种作用[13-14]。越来越多的研究发现,SSa能够显著降低PTZ点燃大鼠癫痫发作的严重程度和持续时间,同时显著提高了癫痫发作的潜伏期,且能够通过下调mTOR信号通路抑制海马神经元的凋亡[15]。SSa能够抑制慢性点燃癫痫大鼠海马和颞叶皮层PGP的表达并抑制脑电图的痫性放电,也能够降低PTZ诱导海马星形胶质细胞TNF-α的表达并抑制TNFR1的高表达[9, 11]。
星形胶质细胞在维持内环境稳定、神经兴奋传递和血脑屏障等多方面发挥着重要作用[16-17]。GFAP是一种中间丝蛋白,广泛存在于发育和成熟的星形胶质细胞中,构成星形胶质细胞的细胞骨架。因此,GFAP通常用作星形胶质细胞的特异性标志蛋白,其表达量的多少也用于反映胶质细胞的功能状态[18]。本实验中原代分离培养海马星形胶质细胞,免疫荧光检测GFAP表达水平鉴定细胞时发现,细胞GFAP免疫荧光呈阳性,结合细胞形态学观察,可以确定海马星形胶质细胞的成功分离,可用于后续实验。
目前,星形胶质细胞增生、神经元损伤是癫痫患者大脑的病理特征,并被认为是癫痫发作的诱发因素[19-20]。一般情况下,星形胶质细胞可有效清除兴奋性神经递质谷氨酸,将其转化为谷氨酰胺后释放到细胞外;但在病理情况下,星形胶质细胞增生可下调神经细胞的兴奋阈值,还可促使炎性因子和神经营养因子等释放,参与海马硬化,促进癫痫的发生[21]。杨展能等[22]的研究也发现PTZ诱导的癫痫模型中星形胶质细胞发生活化。本研究数据显示,PTZ能够活化海马星形胶质细胞,促进细胞增殖,增加GFAP的表达;但SSa处理能够有效抑制PTZ诱导的海马星形胶质细胞的活化,抑制细胞的增殖,诱导细胞发生凋亡。此外,缝隙连接(gap junction, GJ)是由一系列的缝(间)隙连接蛋白(connexin, Cx)组成,主要行使细胞间直接信息交流的功能,其中Cx43是星形胶质细胞中最为常见的缝隙连接蛋白。有研究显示,在癫痫和帕金森病等疾病情况下,海马组织中Cx43蛋白表达水平及功能发生异常[23]。例如,在致癫大鼠模型的相关研究中发现,致痫组大鼠海马区与皮层区Cx43免疫阳性表达在癫痫发作1 h后开始增强,24 h达到高峰,且致痫24 h时海马区Cx43免疫阳性表达明显高于同一时限的皮层区[24]。采用免疫组化及Westem blot对难治性颞叶癫痫患者的临床样本进行研究时发现,癫痫患者较无癫痫病史者的海马组织中Cx43蛋白表达异常增强,提示海马星形胶质细胞中Cx43的表达异常在癫痫等疾病的发生发展中发挥着重要的作用[25]。而在帕金森大鼠模型中同样发现,模型组大鼠Cx43 mRNA表达较正常组和假手术组均显著升高[26]。本文研究数据显示,SSa可显著降低PTZ诱导的海马星形胶质细胞中Cx43的高表达。
