铅对铁铝复合氧化物吸附铜的影响
2019-03-20吴迪郭彦秀赵欣陈子明张莹董玉良任丽英
吴迪,郭彦秀,赵欣,陈子明,张莹,董玉良,任丽英
(临沂大学资源环境学院山东省水土保持与环境保育重点实验室,山东临沂276000)
天然矿物材料具有较大的比表面积,表面又含有丰富的官能团,对环境中重金属的迁移性和生物有效性具有重要的控制作用[1-3]。近年来,单一或复合氧化物在环境治理中得到广泛的应用。研究发现,Cr(Ⅵ)在铁氧化物改性粘土表面的吸附遵循Langmuir方程和准二级动力学[4]。铁铝复合氧化物对废水中氟离子污染的去除率达到92.5%[5]。氧化镁和生物炭复合材料对水溶液中重金属表现出较强的吸附性能[6]。添加铁锰或铁铝复合氧化物可显著地降低汞在土壤中的有效性[7]。Fe-Mn硅基介孔吸附剂可同时对溶液中的芘和铜有较高的去除效果[8]。然而,在环境中经常同时存在多种重金属,并且共存的重金属离子对氧化物的吸附性能的干预仍需要系统研究。
本文以环境中常见的铁铝复合氧化物为吸附材料,以环境中典型的Cu污染为研究对象。采用批吸附试验方法,研究铁铝复合氧化物在Pb2+存在与否时,对Cu2+离子吸附行为的影响,为环境中复合污染的调控提供理论依据。
1 材料和方法
1.1 合氧化物的制备
铁铝复合氧化物的制备[9-10]:将摩尔比为1∶1的三氯化铁(FeCl3·6H2O)和三氯化铝(AlCl3·6H2O)配制成总浓度为1 mol·L-1的混合溶液,置于容器中。在不断搅拌下,向混合溶液中滴加3 mol·L-1的NaOH溶液,当悬液pH值到达约7.4时,停止滴定并继续搅拌30 min,以使悬液充分混合。然后将混合物置于60℃温度条件下培养箱中老化24 h,通过真空抽滤分离沉淀物和上清液,并用去离子水反复洗涤沉淀物。将得到的固体在60℃温度条件下干燥并磨碎,得到铁铝复合氧化物。
1.2 Cu2+等温吸附
分别称取50 mg铁铝复合氧化物,并置于一系列50 mL塑料离心管中。向离心管中加入CuSO4溶液,使体系最终 Cu2+的浓度为 0~4.0 mmol·L-1,以1mmol·L-1KNO3溶液作为背景电解质,用0.1mol·L-1HNO3或0.1 mol·L-1NaOH溶液调节体系pH值为5.0。25℃温度条件下恒温振荡24 h,离心后,将上清液用0.45 μm滤膜过滤,并通过原子吸收测定上清液中Cu2+的浓度,然后用差减法计算铁铝复合氧化物对Cu2+的吸附量。
1.3 pH值对Cu2+吸附的影响
使离心管中最终Cu2+的浓度为0.8 mmol·L-1,pH值为3.0~9.0,其他步骤与1.2部分Cu2+等温吸附操作相同。
1.4 Cu2+吸附动力学
使离心管中最终Cu2+的浓度为0.2 mmol·L-1,反应时间为0~24 h,其他步骤与1.2部分Cu2+等温吸附操作相同。
1.5 Pb2+对 Cu2+吸附的影响
将反应体系中Cu2+用等摩尔比的Cu2+和Pb2+混合溶液替代,重复1.2,1.3和1.4部分的试验过程,考察Pb2+共存对铁铝复合氧化物表面Cu2+吸附的影响。
2 结果与分析
2.1 Cu2+的等温吸附
25℃温度条件下铁铝复合氧化物对Cu2+的吸附量随着Cu2+平衡浓度的增加而增加(图1)。当Cu2+的平衡浓度低于 25 mg·L-1时,Cu2+的吸附量呈现快速增加的趋势,之后Cu2+吸附量的增加速度开始变慢,最终接近平衡。当有Pb2+存在的条件下,Cu2+的吸附较快达到平衡。当溶液中Cu2+和Pb2+浓度较低时,Pb2+对氧化物表面Cu2+的吸附影响较小。随着离子浓度的增加,Cu2+和Pb2+之间出现竞争吸附作用。Pb2+的存在,显著降低了氧化物表面上Cu2+的吸附量。Cu2+和Pb2+在氧化表面均存在专性吸附[11],Cu2+吸附位点的竞争是其在氧化物表面吸附量降低的主要原因之一[12]。
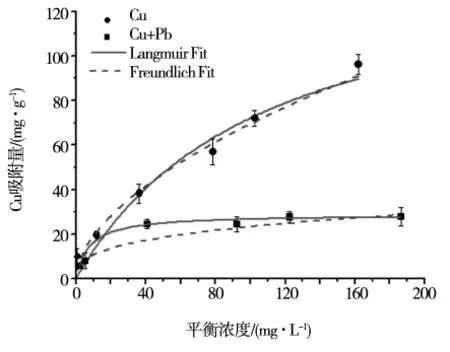
图1 25℃温度条件下,pH值5时铁铝复合氧化物对Cu2+的等温吸附曲线
分别用 Freundlic和 Langmuir方程对 Cu2+在铁铝复合氧化物表面的吸附等温线进行拟合,方程线性表达式分别如下:
Freundlic线性方程式为

Langmuir线性方程式为

其中,Qe为 Cu2+的平衡吸附量,mg·g-1;Ce为 Cu2+的平衡浓度,mg·L-1;Qmax为 Cu2+的最大吸附量,mg·g-1;K为吸附常数;n为吸附强度的量度。
结果显示,Freundlic和Langmuir方程拟合的相关系数R2均在0.9以上,具有较高的拟合度(表1)。当溶液中不存在Pb2时,铁铝复合氧化物对 Cu2+的 Qmax为 149.08 mg·g-1。当溶液中 Cu2+和Pb2+共存时,Cu2+的 Qmax降低到 28.81 mg·g-1。
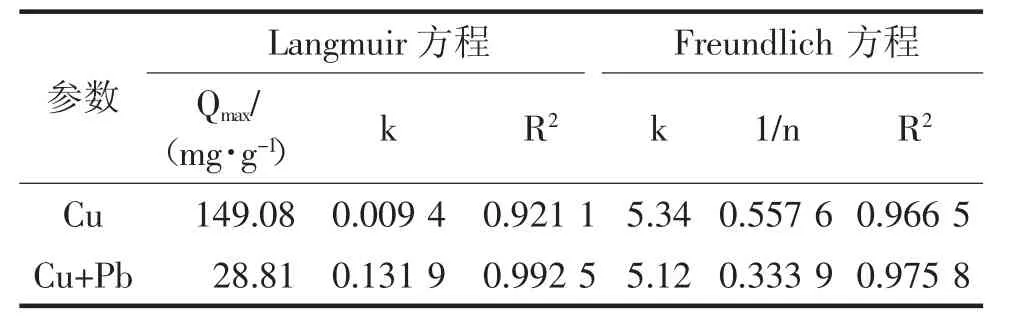
表1 25℃温度条件下铁铝复合氧化物对Cu2+的等温吸附拟合参数
2.2 pH值对Cu2+吸附的影响
当溶液的pH值<7.0时,Cu2+在铁铝复合氧化物表面的吸附量随着pH值的升高而增加(图2),氧化物表面负电荷数量随着pH值的增加而增加,是引起Cu2+吸附能力增强的主要原因之一[13]。当溶液pH值=7.0时,铁铝复合氧化物表面Cu2+的吸附量达到最大。当溶液pH值>7.0时,Cu2+的吸附量基本保持恒定,这主要是由于金属离子在碱性条件下形成沉淀,致使溶液中Cu2+的浓度大大降低,表现出被铁铝复合氧化物所吸附的表观现象。相同pH值下,溶液中Cu2+和Pb2+共存时,铁铝复合氧化物对Cu2+的吸附量降低。pH值3,4,5,6 时,Pb2+的存在分别使 Cu2+的吸附量降低了0.13,3.64,4.81 和 4.49 mg·g-1。
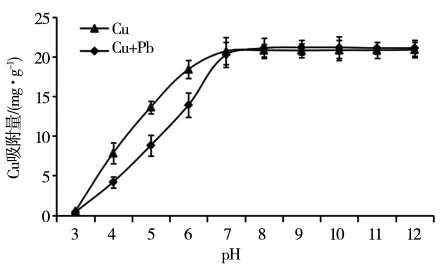
图2 不同pH值下铁铝复合氧化物对Cu2+的吸附影响
2.3 Cu2+吸附动力学
Cu2+在铁铝复合氧化物表面的吸附量随着时间的延长而增加(图3)。整个反应过程可以分两个阶段:快速反应和慢速反应。在0~120 min的范围内,Cu2+的吸附速率较快,吸附量快速增加,之后Cu2+的吸附量基本恒定。且Pb2+的存在使Cu2+的吸附量降低。分别用假一级动力学、权函数和Elovich方程拟合Cu2+的吸附动力学,方程表达式分别如下。
Elovich表反应动力学表达形式为:

权函数方程表达式为:

假一级动力学方程表达式为:

其中:Ct代表反应时间为 t时 Cu2+的吸附量,mg·g-1;a 代表初始吸附速率;k 表示 Cu2+的平均吸附速率。

图3 铁铝复合氧化物对Cu2+的吸附动力学
方程拟合结果表明,Elovich方程的相关系数最高(表2)。有无 Pb2+存在时,Cu2+吸附动力学拟合的相关系数均高于0.94。这也表明Cu2+在铁铝复合氧化物表面的吸附速率随吸附量(或覆盖度)的增加呈指数减少[14]。
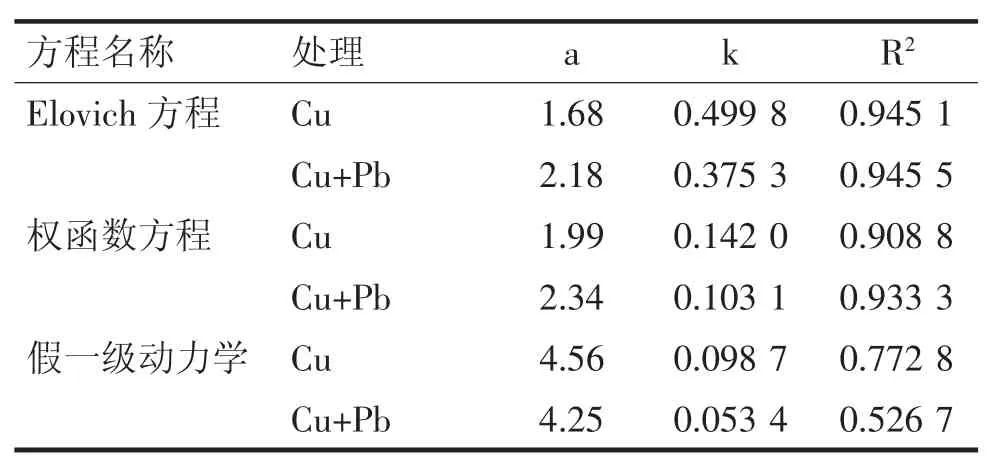
表2 铁铝复合氧化物对Cu2+吸附动力学拟合参数
3 结论与讨论
利用吸附试验,研究了溶液中有无Pb2+共存条件下,铁铝复合氧化物对Cu2+的吸附量,主要研究结果如下。
(1)当有Pb2+存在的条件下,Cu2+的吸附较快达到平衡。Cu2+和Pb2+之间存在竞争吸附的关系。而且溶液中共存Pb2+的离子浓度越高,对Cu2+的吸附的抑制作用越强烈。
(2)当pH值<7.0时,Cu2+的吸附量随着pH值的升高而增加。当溶液pH值≥7.0时,由于离子的沉淀作用,Cu2+表现出被大量吸附的表观现象。同一pH值条件下,溶液中有Pb2+共存时,Cu2+的吸附量低于无Pb2+存在时的吸附量。
(3)铁铝复合氧化物对 Cu2+的吸附动力学呈现出快速反应和慢速反应两个阶段。反应过程遵循Elovich方程,且Pb2+的存在使Cu2+的吸附量降低。
上述试验结果表明,溶液中Pb2+的共存大大降低了Cu2+在氧化物表面的吸附量,说明溶液中的Pb2+与Cu2+之间在吸附时存在竞争吸附位点的关系。研究结果有助于深入理解环境中共存金属污染物吸附行为,为其综合治理提供理论借鉴。
