精氨酰-甘氨酰-天冬氨酸多肽层层自组装修饰钛片对小鼠成骨样细胞MC3T3-E1的影响
2019-03-19刘菲张云涛马向瑞张雅杰王云浩滨州医学院口腔医学院滨州56600
刘菲 张云涛 马向瑞 张雅杰 王云浩 .滨州医学院口腔医学院 滨州 56600;
2.滨州医学院附属医院口腔修复科 滨州 256600;
3.滨州医学院附属医院口腔颌面外科 滨州 256600
钛及钛合金被广泛应用于口腔种植治疗中,通过表面改性提高钛及钛合金种植体与骨的结合,是目前研究的热点。生物化修饰种植体可使种植体表面具有生物活性,使之形成与天然骨相似的结构与组成,从而调控细胞行为,可促进种植体与骨结合,增强骨结合强度,从而缩短种植体早期负载的时间。
精氨酰-甘氨酰-天冬氨酸(arginyl-glycylaspartate,RGD)多肽是细胞膜整合素的特异性配体,与相应细胞膜上的整合素亚基识别并与之结合,从而形成特异性的黏附,同时可激活相关基因,促进细胞黏附、增殖、分化及相关基因的表达[1]。
本实验采用层层自组装技术,用RGD多肽修饰纯钛表面,可使带有相反电荷的不同电解质在材料表面相互交替吸附、沉积,从而在钛片表面形成具有特定厚度的多层自组装多肽复合薄膜[2],在复合薄膜表面进行成骨细胞培养,检测细胞的黏附、增殖以及骨钙素和骨保护素的表达。
1 材料和方法
1.1 材料
1.1.1 实验钛片 1)TA4钛片(成都海利华生物科技有限公司),直径15 mm,厚1 mm,粗糙度为(0.20±0.02)μm。丙酮、75%乙醇、纯水中超声清洗各15 min,60 ℃干燥。2)NaOH处理钛片,将清洁后干燥试件浸没在5 mol·L-1NaOH溶液中60℃水浴24h,在80℃去离子水中保温24h,60 ℃干燥备用。
1.1.2 RGD多肽涂层的制备 将NaOH处理后的钛片浸入2.5 mg·mL-1聚乙烯亚胺(polyethyleneimine,PEI;Sigma公司,美国)水溶液中30 min,去离子水冲洗20 min;干燥后浸入含0.2 mg·mL-1RGD多肽的0.4 mg·mL-1NaHCO3溶液8h,去离子水冲洗20 min,60 ℃干燥;再将样本浸入2.5%戊二醛30 min,去离子水冲洗30 min,60 ℃干燥。重复上述过程10个循环,形成多层RGD多肽覆盖层[3]。
1.1.3 主要材料 小鼠成骨样细胞MC3T3-E1(中国科学院典型培养物保藏委员会细胞库),α-Eagle基础培养基(α-minium Eagle's medium,α-MEM;Hyclone公司,美国),胎牛血清(浙江天杭生物科技公司),青霉素/链霉素溶液(Hyclone公司,美国),2.5 g·L-1胰蛋白酶(Hyclone公司,美国), 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT;Sigma公司,美国],二甲基亚砜(dimethyl sulphoxide,DMSO;Amresco公司,美国),Trizol试剂(北京Takara公司),反转录试剂盒(PrimeScript RT Reagent Kit with gDNA Eraser;TaKaRa公司,日本)、SYBR GreenMasterMix(TaKaRa公司,日本)。
1.1.4 主要仪器 CO2细胞培养箱(Thermo Fisher Scientific公司,美国),超净工作台,扫描电子显微镜(scanning electron microscope,SEM;EVO LS15;Zeiss公司,德国),全自动多功能酶标仪(Thermo lab systems multiskan mk3,美国),荧光实时定量多聚酶链式反应仪(real-time quantitative polymerase chain reaction,RT-qPCR;Rotor-Gene3000;Corbett公司,澳大利亚)。
1.2 方法
1.2.1 实验分组 以无钛片为对照组,分别以未做表面处理的纯钛(pure titanium,PT)、NaOH处理后钛片(NaOH-treated titanium,NT)和RGD多肽涂层钛片(RGD-modified titanium,RT)为实验组,共分4组。
1.2.2 材料表面微观形貌观察 用SEM在20 kV、放大5 000倍条件下观察各组钛片表面微观形貌。
1.2.3 细胞体外培养 小鼠成骨样细胞MC3T3-E1在5% CO2、37 ℃培养箱内培养,每2 d换液1次,培养液为α-MEM(含10%胎牛血清,1%青霉素/链霉素)。待细胞长满培养瓶底后,按1:3传代,传代3次后用于实验。
1.2.4 细胞黏附检测 将3组钛片置于24孔细胞培养板孔内,无钛片放置的孔为对照组,每组8个样本。每孔用1 mL的75%乙醇浸泡30 min,磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗3遍,吸出液体。将细胞以2×104mL-1接种于各组孔内(每孔1 mL),分别在1、4、12、24 h时间点,采用MTT法在490 nm波长处测定各孔吸光度值。
1.2.5 SEM观察细胞的黏附形态 将小鼠成骨样细胞MC3T3-E1以2×104mL-1接种于各组孔内(每孔1 mL),培养12 h,使用SEM在10 kV、放大1 000倍条件下观察细胞的黏附形态。
1.2.6 细胞增殖检测 将小鼠成骨样细胞MC3T3-E1以2×104mL-1接种于各组孔内(每孔1 mL),每组8个样本。培养1、3、5、7 d后,采用MTT法在490 nm波长处测定各孔吸光度值。
1.2.7 RT-qPCR检测骨钙素、骨保护素mRNA表达水平 将小鼠成骨样细胞MC3T3-E1以5×104mL-1接种于各组孔内(每孔1 mL),每组6个样本。待细胞生长覆盖80%表面积,将培养液更换为成骨诱导液,分别在成骨诱导的7、14 d,用Trizol提取总RNA,反转录合成互补DNA(complementary DNA,cDNA)。编码作为内参物的磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)与目标物骨钙素、骨保护素的基因的引物由上海生工生物工程公司合成。GAPDH上游:5'-GGTGAAGGTCGGTGTGAACG-3',下游:5'-CTCGCTCCTGGAAGATGGTG-3';骨钙素基因上游:5'-GGTAGTGAACAGACTCCGGC-3',下游:5'-GGCGGTCTTCAAGCCATACT-3';骨保护素基因上游:5'-CCACTCGAACCTCACCACAG-3',下游:5'-TCGCTCGATTTGCAGGTCTT-3'。反应程序为95 ℃预变性30 s,1 次循环;PCR扩增, 95 ℃ 5 s,60 ℃ 30s,45次循环。将对照组基因表达量定义为1,计算每组的相对表达量。
1.3 统计学分析
实验数据均以平均值±标准差的形式表示,采用SPSS 17.0对各组数据行单因素方差分析,组内两两比较用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SEM观察
使用SEM观察各组钛片的表面情况(图1)。打磨后的PT组钛片,表面光滑,有均匀一致较清晰的划痕结构;NT组钛片表面的划痕结构变得不明显,出现更为细小的结构,类似小微孔结构;RT组钛片表面结构无明显打磨后的痕迹,细小结构更明显,类似小凸起,似网状铺在表面。

图1 钛片的表面形态 SEM × 5 000Fig 1 Surface topography of the titanium plates SEM × 5 000
2.2 细胞在不同钛片表面的黏附情况
统计结果(表1)显示,RT组钛片小鼠成骨样细胞MC3T3-E1的黏附情况明显好于其余3组。NT组细胞的黏附率情况则较差。
2.3 SEM观察细胞在不同钛片表面的黏附形态
使用SEM观察小鼠成骨样细胞MC3T3-E1的黏附情况(图2),可见细胞贴壁生长。
PT组钛片表面细胞呈扁平状,多为多边形,有少量伪足;NT组钛片表面细胞伸展良好,呈扁平状,形态各不相同,伪足较多;RT组钛片表面细胞呈不规则多边形,伸展良好,大量丝状伪足牢固附着或深入在材料表面。

表1 不同钛片表面对小鼠成骨样细胞MC3T3-E1在不同时间点黏附的影响Tab 1 The effect of different titanium plates on the adhesion of MC3T3-E1
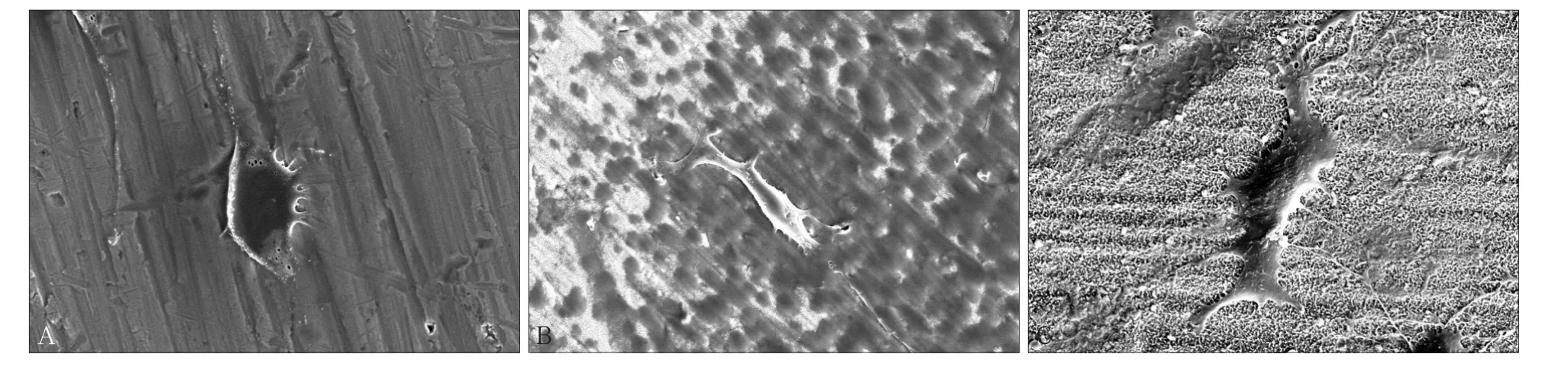
图2 钛片表面小鼠成骨样细胞MC3T3的黏附形态 SEM × 1 000Fig 2 Adhesion morphology of MC3T3 on surface of titanium plates SEM × 1 000
2.4 细胞在不同钛片表面的增殖情况
小鼠成骨样细胞MC3T3-E1培养1和3 d,RT组细胞增殖率最高。在5和7 d时,RT组细胞的增殖情况与对照组、PT组无明显差异;NT组细胞的增殖情况则最差,差异有统计学意义。
2.5 不同钛片表面对小鼠成骨样细胞MC3T3-E1骨钙素、骨保护素mRNA表达的影响
采用RT-qPCR检测培养7 d时的小鼠成骨样细胞MC3T3-E1,RT组细胞骨钙素mRNA的表达水平与PT组和NT组细胞的表达水平之间的差异无统计学意义(P>0.05);培养14 d时,与PT组相比,RT组和NT组细胞骨钙素mRNA的水平明显升高(P<0.05)。骨保护素mRNA在培养7和14 d时的表达有相同的趋势,RT组和NT组均明显高于PT组(P<0.05),其中RT组骨保护素mRNA的表达量也较NT组明显上调(P<0.05)。

表2 不同钛片表面对小鼠成骨样细胞MC3T3-E1增殖的影响Tab 2 The effect of different titanium plates on the proliferation of MC3T3-E1
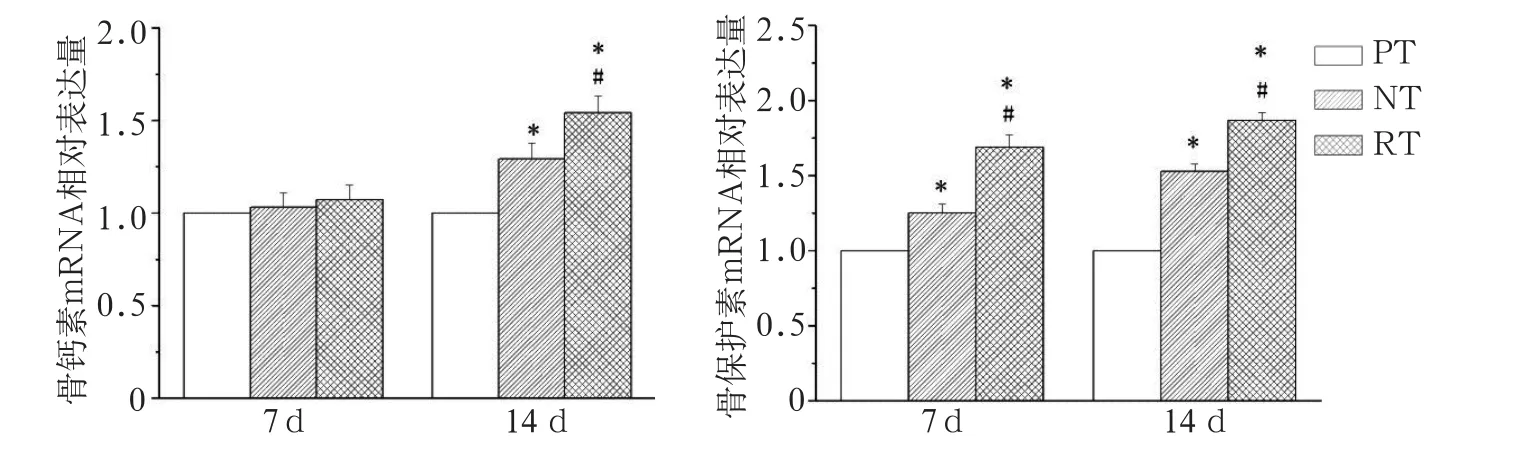
图3 不同钛片表面对小鼠成骨样细胞MC3T3-E1骨钙素、骨保护素mRNA表达的影响Fig 3 mRNA expression of osteocalcin and osteoprotegerin in MC3T3-E1 on different titanium plates at different times
3 讨论
RGD多肽是存在于细胞黏附蛋白中的短肽序列,细胞膜上的整合素亚基是介导细胞黏附的重要跨膜受体[3]。RGD多肽作为细胞黏附蛋白与相应细胞的结合位点,与被黏附细胞的细胞膜整合素亚基识别并结合,增强其与细胞间的黏附与增殖[4]。Hoyos-Nogués等[5]利用RGD多肽修饰材料,使材料表面具有生物活性及骨诱导作用,促进细胞在材料表面的附着和铺展,从而促进细胞的黏附、增殖。在本研究中,RGD多肽修饰钛片的表面与经NaOH处理后的钛表面相比,表面润湿性提高,表面能降低,利于细胞的识别[6]。SEM观察显示,在RGD多肽涂层钛片表面,培养12 h的小鼠成骨样细胞MC3T3-E1有大量丝状伪足,铺展充分,紧密附着在材料表面,这可能是因钛片表面RGD多肽与细胞膜整合素亚基识别并与之结合,促进细胞在钛片表面更好铺展。RGD多肽能促进小鼠成骨样细胞MC3T3-E1的早期增殖,细胞在培养1和3 d时,增殖情况明显高于其他3组。Chen等[7]将RGD多肽化学固定于钛片表面,培养小鼠成骨样细胞MC3T3-E1,发现3和5 d时细胞的增殖率均较未涂层钛有所增加,其结果与本实验结果一致。NT组钛片表面的细胞增殖情况明显低于对照组及PT组,这与之前的研究[8-9]不同,可能是由于钛片处理的方式不同导致表面的粗糙度不同。
骨钙素是成骨细胞分化后期的最具特征性的标志物,是判断其分化成骨能力的重要指标[10]。后期骨钙素mRNA水平上调,说明RGD多肽促进了小鼠成骨样细胞MC3T3-E1的分化成骨。骨保护素又被称为骨保护蛋白,可以与核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)结合,从而竞争性地阻断了破骨细胞与RANKL结合,抑制了破骨细胞的分化,降低了破骨细胞的活性,诱导破骨细胞的凋亡,对于防止骨质吸收起到了调节作用[11]。骨保护素在成骨细胞中高表达,说明对骨吸收有抑制作用。在本实验中,RT组钛片可以使细胞分化后期的骨钙素mRNA水平上调,促进了细胞的成骨分化,同时还能通过上调骨保护素,从而抑制破骨细胞分化,减少骨的吸收。Chua等[12]通过自组装技术在钛表面添加RGD多肽并进行细胞实验,结果证明促进了成骨细胞黏附性、增殖及细胞碱性磷酸酶活性。Raphel等[13]的研究也证实,钛表面用RGD多肽修饰后有利于成骨细胞后期的分化。
种植体周围骨质形成的速度、骨结合强度和骨结合时间是种植体成功的关键。钛在空气中易形成氧化物薄膜,表面无法提供足够的功能基团来固定生物分子,需对其进行处理。目前对种植体表面进行多肽修饰的方法有物理吸附、化学固定及层层自组装技术等。物理吸附通过非共价键吸附于材料表面,操作简便,但其形成的RGD多肽覆盖层厚薄不一,且与种植体表面结合稳定性较差。化学固定用酸或过氧化氢溶液作修饰试剂,获得修饰材料的功能基团,可其破坏种植体表面的原有形貌,影响种植体骨结合。层层自组装技术中钛片经过NaOH处理会活化其表面,使之获得大量带有负电荷的羟基,有利于自组装,可保证RGD多肽的数量和结合强度[14]。采用SEM观测材料表面形貌,经过NaOH处理的钛片的表面划痕结构消失,出现微孔结构,而层层自组装RGD多肽修饰的钛片的表面出现了微小凸起结构,这种结构可能与正负电荷交替吸附形成的RGD多肽涂层有关。
与物理吸附和化学固定方式相比,采用层层自组装方式用RGD多肽修饰钛片有其独特的优势,可以不破坏材料表面的形态,可有效控制多肽厚度,且操作简单。多肽层层自组装的原理被认为是多肽分子间非共价键的作用力,对自组装原理的研究对于准确预测和控制自组装聚集体的结构有着极为重要的作用。RGD多肽修饰钛片能促进小鼠成骨样细胞MC3T3-E1的黏附和增殖,并且能够上调骨钙素和骨保护素mRNA的表达,从而能增强细胞的成骨能力,加快种植体骨结合,有利于早期种植体的稳定性,提高种植体植入的成功率,其临床应用价值巨大。然而,多肽分子自组装的设计不同,其形成的化学结构也不尽相同。在本实验中,多肽涂层的结构并不完全明确,哪种结构更加有利于细胞的黏附、生长及促进成骨,以及在动物实验中是否能达到早期愈合的效果,仍需进一步研究,也是笔者后续研究的主要目标。
