美罗培南对非结核分枝杆菌的体外抑菌效果评价
2019-03-18于霞罗晶晶赵立平徐洋梁倩马异峰董玲玲黄海荣
于霞 罗晶晶 赵立平 徐洋 梁倩 马异峰 董玲玲 黄海荣
作者单位:101149 首都医科大学附属北京胸科医院 北京市结核病胸部肿瘤研究所 国家结核病临床实验室 耐药结核病研究北京市重点实验室(于霞、罗晶晶、赵立平、梁倩、马异峰、董玲玲、黄海荣);大连市友谊医院肿瘤内科(徐洋)
非结核分枝杆菌(non-tuberculous mycobacteria,NTM)广泛存在于水、食品、土壤和灰尘中[1]。尽管被认为是机会致病菌,但NTM病在全球范围内的发病率和患病率在过去几十年中呈上升趋势[2-4]。主要的致病性NTM对大多数抗生素天然耐药的特点使其治疗面临着极大的挑战[5]。虽然一些专业机构已经推荐了针对最流行NTM菌种引起的感染的治疗方案[6],但这些方案通常缺乏足够的证据支持,并且治疗结果也不太理想[7]。更让人担忧的是,在一线抗NTM治疗方案失败后基本没有可选择的替代方案。因此,迫切需要筛选新的抗NTM药物,或是发现现有药物的抗NTM活性。
美罗培南(meropenem,MEM)是一种应用广泛的广谱碳青霉烯类抗菌药物,对于革兰阴性和阳性细菌均有较好的抑菌活性,广泛应用肺、腹腔、泌尿系统和软组织等感染的治疗。与传统的β-内酰胺类抗生素类抗不同,MEM与β-内酰胺酶BalC的亲和力较低,导致其在细菌内不容易被水解,进而发挥持续的抗菌效果。以往的研究表明,MEM对结核分枝杆菌有较好的体内外抑菌活性[8-10]。本研究的目的主要是评价MEM对NTM标准株和常见的临床分离株的体外抑菌活性,从而为临床应用MEM治疗NTM病提供依据。
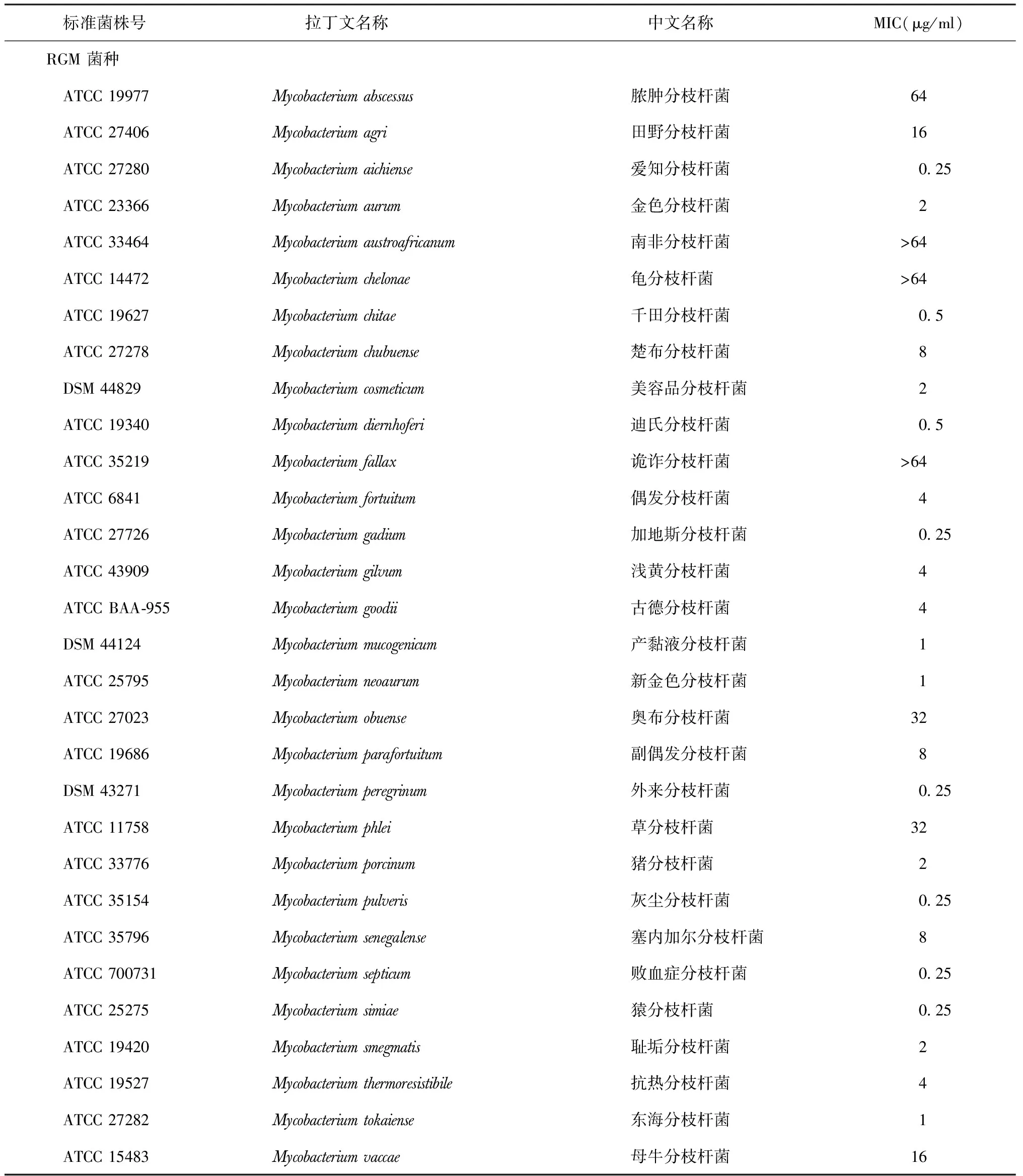
表1 MEM对30株RGM标准菌株和16株SGM标准菌株的MIC情况
材料与方法
1.标准菌株和临床分离株:对首都医科大学附属北京胸科医院菌株库中保存的所有分枝杆菌标准菌株进行体外MEM药敏试验,包括30种快速生长的分枝杆菌(RGM)和16种缓慢生长的分枝杆菌(SGM),菌种的中文译名依据《分枝杆菌菌种中文译名原则专家共识》[11]。这些标准菌株购自美国典型菌种保藏中心(ATCC)或德国微生物菌种保藏中心(DSM)。纳入的标准菌株的种类组成见表1。收集首都医科大学附属北京胸科医院2015年1月至2016年12月分离的NTM临床分离株,包括脓肿分枝杆菌40株,胞内分枝杆菌36株,偶发分枝杆菌33株,鸟分枝杆菌22株,堪萨斯分枝杆菌45株,戈登分枝杆菌10株,其他菌种的NTM分离株21株,共计207株。其他21株NTM临床分离株的种类和组成见表2。所有NTM临床分离株通过对硝基苯甲酸生长试验,以及16S rRNA、hsp65、rpoB 和 16-23S rRNA序列测定和分析比对,鉴定至菌种水平[12]。
2.最低抑菌浓度测定(minimal inhibitory concentration,MIC):MEM购自Sigma公司(美国),溶于二甲基亚砜(DMSO),存储液浓度为2 mg/ml,保存于-80 ℃。参照临床和实验室标准化研究所(Clinical and Laboratory Standards Institute,CLSI)的指南进行肉汤稀释法药敏试验[6]。SGM的药敏试验采用含OADC(油酸-白蛋白-葡萄糖-过氧化氢酶)的Mueller Hinton(MH)肉汤培养基,RGM的药敏试验采用不含OADC的MH肉汤培养基。取接种于罗氏培养基上的生长至对数期的细菌进行MIC测定。将MH肉汤培养基进行2倍稀释,MEM浓度范围是0.5~64 μg/ml。将细菌稀释后接种到96孔微孔板中,每孔的细菌载量约为105菌落形成单位(CFU)。之后,SGM和RGM分别在37 ℃培养7 d和 3 d后,每孔加入含20 μl Alamar Blue和50 μl吐温80(5%)的混合液,在37 ℃下孵育24 h后进行显色评价。液体由蓝色变成粉色或紫色表明有细菌生长。MIC被定义为防止颜色从蓝色变为粉红色的最低药物浓度。有研究报道NTM对MEM耐药的临界值为8~16 μg/ml[6],本研究将MIC≤8 μg/ml的菌株定义为MEM敏感菌株。
注表中括号内数值为“菌株数(株)”
结 果
1. MEM 对NTM标准菌株的MIC情况:30株 RGM标准菌株和16株SGM标准菌株的MEM的MIC情况见表1。MEM对RGM表现出较强的抑菌活性。在30株RGM中,MEM对22株的MIC≤8 μg/ml,其中MEM对15株RGM的MIC≤2 μg/ml。在16株SGM菌株中,MEM的抗菌活性相对较差,有7株菌株的MIC≤8 μg/ml,其中6株菌株的MIC≤2 μg/ml,分别为戈登分枝杆菌(MIC=0.25 μg/ml), 胃分枝杆菌和苏尔加分枝杆菌(MIC=0.5 μg/ml),不产色分枝杆菌(MIC=1 μg/ml),田鼠分枝杆菌(MIC=2 μg/ml),结核分枝杆菌(MIC=2 μg/ml)。
2. MEM对临床常分离到的NTM菌种的MIC分布情况: MEM对6种临床常分离到的NTM的MIC分布情况如图1所示。MEM对偶发分枝杆菌有较好的体外抑菌活性,而对脓肿分枝杆菌抑菌活性较差。在33株偶发分枝杆菌中,MEM耐药率为33.3%(11/33),其中5株菌株的MIC>64 μg/ml。在40株脓肿分枝杆菌中,MEM耐药率为82.5%(33/40),仅有6株菌株的MIC≤2 μg/ml。22株鸟分枝杆菌中, MEM的耐药率为72.7%(16/22),仅有3株菌株的MIC≤2 μg/ml。在36株胞内分枝杆菌中, MEM耐药率为63.9%(23/36),仅有8株菌株的MIC≤2 μg/ml。45株堪萨斯分枝杆菌临床分离株中仅有2株菌株的MIC≤8 μg/ml,其余菌株均对MEM耐药。10株戈登分枝杆菌临床分离株中,MEM的耐药率为20.0%(2/10),有7株菌株的MIC≤2 μg/ml。
3.MEM对临床分离株数较少的NTM菌种的体外抑菌活性: MEM对不常见的NTM临床分离株的体外抑菌活性见表2。MEM对纳入非常见NTM的体外抑菌活性较弱,仅对1株阿罗普分枝杆菌,1株龟分枝杆菌和1株玛尔摩分枝杆菌敏感,MIC值分别为0.5 μg/ml、0.25 μg/ml和8 μg/ml。
讨 论
随着NTM诊断技术的不断发展以及临床医生对NTM病的重视,NTM病的流行率也在逐年攀升[3-4, 13-14]。因此,研发新的抗NTM药物或者发现现有抗生素的抗NTM活性,对于NTM病的治疗非常重要。β-内酰胺酶类抗生素是最早应用于临床治疗的抗生素,包括青霉素类,头孢菌素类以及碳青霉烯类。研究已经证实在所有β-内酰胺酶类抗生素中,碳青霉烯类对耐多药结核分枝杆菌体外抑菌效果最好[15]。关于MEM对NTM体外抑菌活性的研究较少,目前推荐的各种NTM感染治疗方案中尚不包括MEM。本研究评价了MEM对NTM标准株和临床分离株的体外抑菌活性,这些研究将为MEM在NTM病中的治疗提供依据。
本研究中不同的NTM菌种表现出对MEM不同的药物敏感性。在30株RGM菌株中,26.7%(8/30)菌株对MEM耐药。而偶发分枝杆菌和脓肿分枝杆菌的临床分离株对MEM的耐药率分别为33.3%(11/33)和82.5%(33/40)。与RGM相比,MEM对SGM的抗菌活性相对较差。16株SGM标准株中有9株56.3%(9/16)对MEM耐药。在SGM 临床株中戈登分枝杆菌、胞内分枝杆菌、鸟分枝杆菌和堪萨斯分枝杆菌对MEM的耐药率分别依次为20.0%(2/10)、63.9%(23/36)、72.7%(16/22)和95.6%(43/45)。目前,关于MEM对NTM菌株的体外抑菌活性的研究较少,且部分结果不一致。Li等[5]研究证实了MEM对偶发分枝杆菌和戈登分枝杆菌具有较好的抑菌效果,但对鸟胞内分枝杆菌的体外抑菌效果较差,与本研究结果一致。同时,该研究认为脓肿分枝杆菌对MEM的耐药率为43.3%(23/53),而本研究的耐药率为82.5%(33/40)。Brown-Elliott等[16]研究证实了MEM对脓肿复合群的耐药率为87.9%(58/66),与本研究的结果比较一致。因此,仍需要更多的研究来明确MEM对NTM的体外抑菌活性。
MEM属于时间依赖型抗菌药物,其发挥抗菌活性需要一定的浓度并维持较长的时间,T>MIC 反应了细菌与抗菌药物接触时间对药物效果的影响,能较好地预测其临床疗效。因此,根据MEM的药代动力学特点,只有MIC<16 μg/ml的细菌,通过优化MEM的给药方案可以达到满意的治疗效果[17]。CLSI推荐的MEM的耐药临界值为8~16 μg/ml,此时,MEM血药浓度恰好可以抑制敏感细菌的生长。另外,一系列的研究结果证明了在结核分枝杆菌中,MEM联合β-内酰胺酶抑制剂,可以进一步将MEM对细菌的MIC降低[10, 15],其中以联合舒巴坦应用效果最好。因此,对于一些MEM体外抑菌活性较好的NTM菌种,在制定方案时可以考虑联合应用β-内酰胺酶抑制剂以期达到更好的治疗效果。
综上所述,MEM对于大多数RGM菌种和部分SGM菌种具有较好的体外抑菌活性。在临床上常见的NTM致病菌株中,MEM对偶发分枝杆菌和戈登分枝杆菌具有较好的体外抑菌活性。本研究为临床合理应用MEM治疗NTM病提供了依据。
