基于2016—2017年数据的药品飞行检查分析
2019-03-15李年苏
李年苏 梁 毅
2017年10月8日,中共中央办公厅和国务院办公厅联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》。这是继2015年8月《国务院关于改革药品医疗器械审评审批制度的意见》之后,又一个深化药品医疗器械审评审批制度改革的纲领性文件,对我国医药产业创新发展具有里程碑意义[1]。为积极落实两办意见,国家食品药品监督管理总局(China Food and Drug Administration,CFDA)于2017年10月23日再次发布《〈中华人民共和国药品管理法〉修正案(草案征求意见稿)》,将第十条中的“药品生产企业必须按照国务院药品监督管理部门依据本法制定的《药品生产质量管理规范》(Good Manufacturing Practice, GMP)组织生产,药品监督管理部门按照规定对药品生产企业是否符合的GMP要求进行认证;对认证合格的,发给认证证书”更改为“药品生产应当符合国务院药品监督管理部门依据本法制定的GMP。建立健全质量管理体系,保证生产过程持续合规”[2]。新的意见稿中并没有要求药品生产企业进行GMP认证。根据《国务院关于取消一批行政许可事项的决定》(国发〔2017〕46号),对于GMP认证,国务院将依照法定程序提请全国人民代表大会常务委员会修订相关法律规定后取消[3]。届时,“两证,也就是药品生产许可证与GMP证书合一”将真正实施。GMP认证的取消,并不意味着 CFDA对药品质量、药品生产质量管理体系运行标准的降低,相反,结合药品生产许可证的发放,不仅要求药品生产企业“静态”达到GMP标准,更重要的是,要求药品生产企业达到“动态”GMP标准,这就大大提高了药品生产企业GMP实施的难度。为了督促药品生产企业达到“动态”GMP标准,CFDA将采用更加科学规范的检查手段,比如,飞行检查等方法[4-5]。实际上,无论“GMP检查”“GMP审计”还是“GMP认证”都是一个含义,就是评判药品生产企业GMP实施的情况,并给予适当的结论。因此,本文通过对2016年和2017年(按CFDA发布日期)CFDA对药品生产企业进行检查及所发现的问题进行分析[6],以期为药品生产企业提供参考,帮助企业提高GMP实施水平。
1 飞行检查公布时间和检查用时分析
2016年和2017年CFDA网站发布的药品飞行检查内容中,涉及药品生产企业的检查通报共53条,其中2016年发布24条(占45.3%),2017年发布29条(占54.7%)。其中以第一季度发布的数据最多,高达36%;第四季度的数据最少,占13.2%。见图1。根据对各药品生产企业飞行检查所用时间(天数)进行分析,发现检查用时最少为2天,最多为5天,其中以飞行检查用时3天居多。见图2。

图1 2016—2017年CFDA药品生产企业飞行检查通报发布时间
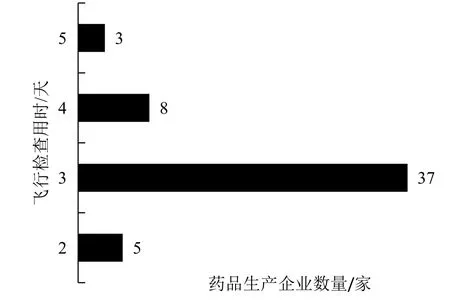
图2 2016—2017年CFDA药品生产企业飞行检查用时
2 飞行检查涉及的药品和企业种类分析
从2016—2017年两年公布的数据来看,检查主要涉及了15个品种的剂型或相关产品62次,其中个别企业被检查的种类不止一类。囊括了片剂、注射剂(含冻干粉)、胶囊剂、丸剂、糖浆剂、颗粒剂、滴眼剂、酊剂、冻干粉针(外用)、胶剂、合剂以及散剂在内的12种剂型,同时还包括了原料药、中药饮片和中药提取物。其中,以片剂和注射剂(含冻干粉)数量居多,两种剂型在15个品种中占比高达37.1%。见图3。

图3 2016—2017年CFDA药品生产企业飞行检查所涉及的药品种类数量
为了便于分析,将15个品种的剂型或相关产品按照《药品注册管理办法》[7]附件大致分为三类:中药、天然药物,化学药品和生物制品。53家被飞行检查的企业中,22家以中药、天然药物为主;30家以化学药品为主,占比高至56.6%;1家以生物制品为主,仅占1.9%。同时,从地理省区域(不含港澳台)划分来看,53家企业有7家位于华北地区(京津冀晋蒙);7家位于东北地区(辽吉黑);10家位于华东地区(沪苏浙皖闽赣鲁);12家位于华中地区(豫鄂湘);7家位于华南地区(粤桂琼);4家位于西北地区(陕甘青宁新);6家位于西南地区(渝川贵云藏)。见表1。被飞行检查的企业大多位于东南沿海及中部地区,共涉及29家,占所有被检查企业总数的54.7%。
3 飞行检查的事由和处理措施分析
飞行检查发布的信息中目前有10种检查事由,包括药品抽检、投诉举报、中药提取物专项检查、2017年国家药品检查计划、价格成本倒挂、信访举报、跟踪检查、延伸检查、案件线索和评价性抽验。在所有检查事由中,举报类(包括信访举报和投诉举报)出现19次,占所有检查事由的35.8%。紧随其后的为跟踪检查和药品抽检,分别为15次和10次,占比28.3%和18.9%。见图4。

表1 2016—2017年CFDA飞行检查所涉及的药品生产企业分布

图4 2016—2017年CFDA药品生产企业飞行检查事由发生频次
依据飞行检查发现的问题,CFDA的处理措施主要为四类:收回相关药品生产企业的GMP认证证书,对企业进行立案查处或调查,将相关产品予以召回,责令企业进行风险管理或控制。药品质量存在重大隐患的责令即刻召回相关批次药品,情节较轻的进行风险管理或控制后再做出是否召回等的决定。53家被检查企业中,基本所有企业都被收回GMP认证证书(50家被收回,另外3家则因为证书过期、未取得证书非法进行生产销售和证书已被注销而无法收回)。立案查处或调查47家,其中召回31家,进行风险管理或控制16家。
4 飞行检查发现问题分析
对53家药品生产企业检查发现的问题简单归结为 186条(其中部分一级缺陷条款标题下又细分为二级缺陷条款,则仅按照一级缺陷条款数目进行统计),各企业检查问题最少1条,最多8条,平均每家3.5条,大部分企业被提出3~5条缺陷问题。见图5。依据GMP[8]要求,人为将186条问题归为5大类(质量、生产、物料、人员、厂房设施和设备)[9],13小类。其中质量、生产和物料方面为主要问题,共占89%。见图6。针对于各类问题,将做详细分析。
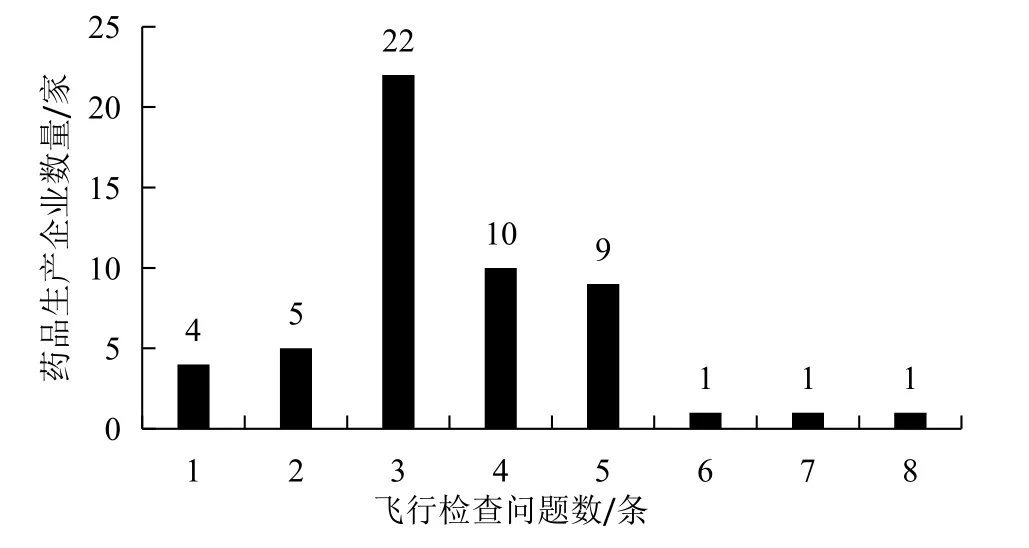
图5 2016—2017年CFDA药品生产企业飞行检查问题条款数

图6 2016—2017年CFDA药品生产企业飞行检查问题条款分类及发生次数和百分比
4.1 质量管理方面
在飞行检查发现的问题中,质量方面提出67条缺陷,占比36%,为5大问题之首。质量管理是GMP体系的重中之重,企业必须建立质量保证系统,同时建立完整的文件体系,以保证系统有效运行[8]。
4.1.1 质量保证质量保证主要包括的检查缺陷具体见图7。
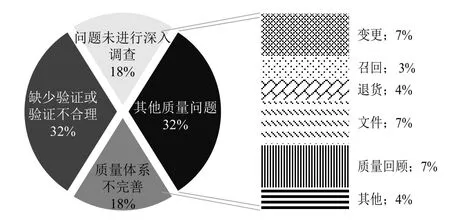
图7 质量保证方面各种类问题占比
质量体系不完善常常表现在质量管理体系不能有效运行(如人员不足、组织架构不合理等);企业的各个环节不能有效执行GMP要求;关键操作或环节未纳入质量管理体系等各个方面。
验证是大部分药品生产企业最为薄弱的环节。验证不仅需要质量、生产、设备、仓储等部门的全力合作,更对人员素质和资质有着全方位的要求;验证方案的科学合理、验证过程的严谨真实直接决定验证结果的好坏[10]。飞行检查发现大量缺少验证的情况,如冻干粉针剂生产线长期未进行培养基模拟灌装试验;未对原料药混合的均匀性进行确认;非激素类产品与激素类产品共线生产未进行评估,缺少防止交叉污染的措施等。总的来说,未进行工艺验证、计算机化系统验证和清洁验证或验证不合理属于企业的共性[9]。
有关偏差和变更控制等也是企业存在的共性问题,偏差处理不科学、不规范。关键工艺变更未及时向药品监督管理部门备案,变更控制不规范。质量回顾不全面或未对产品进行质量回顾,找到问题后未予以重视和解决等。
4.1.2 质量控制质量控制方面涉及的问题缺陷多数为数据完整性及可靠性受到质疑(图8),这也是众多药品生产企业化验室或分析室中存在的通病;同样,数据完整性也是近些年研究的热点问题[11-13]。数据汇总后发现,修改电脑或系统时间、擅自删除或修改色谱分析电子图谱及审计追踪数据、计算机及工作站未合理设置登录权限、未对人员权限进行分级、关键性电子数据未进行备份以及选择使用数据都是数据完整性方面存在的较大缺陷[14]。
检验记录造假以及质量控制中存在的管理缺陷,诸如质控实验室检验设备使用记录不规范、不完整;未按质量标准对相关项目进行检测;菌种的复苏、扩增、储存均无可追溯记录;稳定性试验不完整;未按照规定进行留样等也特别值得药品生产企业重视。

图8 质量控制方面各种类问题发生数
4.2 生产方面
生产方面飞行检查所发现的问题占比仅次于质量方面,为27%。其主要可归为3类,即批生产记录造假、实际工艺与注册或批准工艺不符和生产管理不规范(图6)。
4.2.1 记录造假与检验记录造假一样,生产记录的造假也居高不下,而且二者往往“相辅相成”。药品生产过程中必定涉及众多中间体或中间产品、原料药或制剂的检验,因此,企业一旦生产记录造假,往往伴随着检验记录的造假。生产记录造假主要体现在记录与操作者签名字迹明显不符;批记录后补;生产过程与记录不相符等。
4.2.2 工艺不符生产过程时常发生以下与工艺不符的情况:未按现行生产工艺规程进行投料和生产;品种现行生产工艺与注册工艺不一致;擅自改变生产工艺及处方、投料量;进行不同程度的违法添加,以达到提高收率降低成本、产品符合法定标准而又能规避检查的目的。
4.2.3 生产管理不规范生产管理不规范涉及生产的方方面面,情节十分严重的如:在未通过GMP认证的车间或生产线上组织生产相关品种、GMP证书到期后继续违法生产药品、更改并套用生产批号。另外,未按规程操作、清场不彻底、不能有效防止污染和交叉污染则容易被药品生产企业所忽视[15]。
生产车间使用的设备均不能提供设备使用日志;灭菌柜的人员权限和系统时间设定不合理等。厂房设施和设备不符合要求即未配备与生产相符合的设施。例如:有温湿度控制的仓库未配备空调等温控湿控设备;车间或设备之间未能有效防止污染与交叉污染;厂房设施和设备管理和维护不符合要求。
4.3 物料方面
物料方面的问题在所有统计问题中占比为26%,所出现的问题分类见表2。
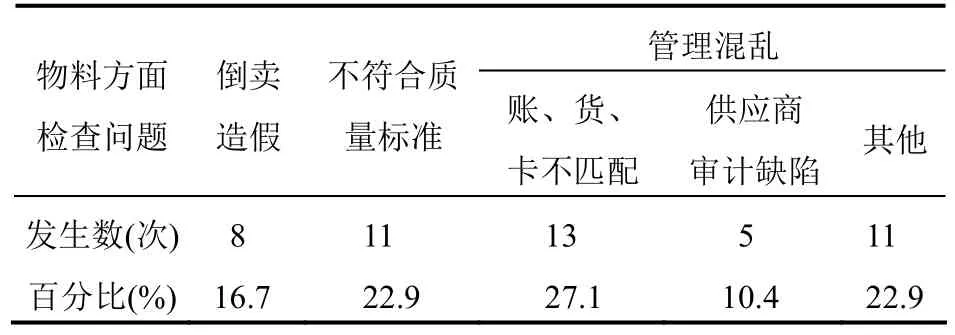
表2 物料方面各问题发生数及比例
4.3.1 倒卖造假倒卖主要是指外购药品或药材贴牌进行销售,并非该生产企业自己生产。造假主要是指编造相关企业账目、票据;伪造、更换生产企业标签以及擅自调换抽样样品。
4.3.2 不符合质量标准不符合质量标准即原辅料、中间体或中间产品、最终成品不符合企业内部标准或者经批准的法定标准。如:购进使用不符合《中华人民共和国药典》标准原辅料生产药品并上市销售;主要原料质量保证措施缺失,存在较高质量风险;回收溶剂使用不规范,未制订回收溶剂质量标准,未进行相关风险评估等。
4.3.3 物料管理混乱物料管理中,账与货、货与卡不能一一对应是存在的最主要问题,仅此一项占物料方面缺陷的27.1%。剩余或购进物料与货位卡不匹配;物料购进发票及相关票据与实际物料不符等均较为常见。供应商审计同样存在大量缺陷:主要原料供应商审计不全;审计流于形式;原料供应商实际生产与申报资料不一致。药品生产企业,尤其是产品涉及众多物料的企业更应该探寻科学高效的物料管理方法。
4.4 人员方面
4.4.1 造假回避由人员主观导致的蓄意造假和回避检查,虽然在人员方面问题比例不是最高(图6),但情节却最为严重。GMP在总则中就明确规定:企业应当严格执行GMP,坚持诚实守信,禁止任何虚假、欺骗行为[8]。根据飞行检查发现以下问题:拒绝、逃避检查,销毁编造的相关企业票据和私刻的相关企业业务专用章等实物证据;为应对监督检查,企业设立三套账目。
4.4.2 职责不明人员方面检查缺陷占比最高的是职责不明(图6)。职责不明表现在质量受权人、质量管理关键岗位、生产负责人等相关人员不能充分履行岗位职责,人员责任落实不到位;质量负责人和质量授权人不稳定,不能有效履行质量管理和质量否决、产品放行的责任;质量控制(QC)主管既负责原辅料检验报告书的签发,同时又负责原辅料的审核放行。
4.4.3 培训不到位企业员工培训不到位,未对培训效果进行全面评估,管理人员的管理经验不够,操作员工实际操作能力不强;新入职人员在培训和履职方面需要进一步完善。
5 结语
对于 CFDA发布的飞行检查信息,本文仅对2016年和2017年内发布的数据进行初步统计分析,重点对飞行检查发现问题予以举例说明,展现出当前一些药品生产企业具有的共性缺陷。可以发现,造假包括质量检验、生产、物料等在内的情况较为严重,值得药品生产企业反思[16]。且企业仍应当在质量管理工作上投入更多的精力。可以预见,飞行检查的力度将只增不减,企业应进一步加大对原辅料采购、生产操作、产品检验及数据完整性等重要环节的考核,积极进行自检自查,确保药品质量。
