沿“胆囊管”逆行追踪法在预防腹腔镜胆囊切除术肝外胆管损伤中的应用价值
2019-03-15陈晓鹏程斌鲍胜华张卫东黄晨王东丁守勇俞远林彭俊璐张文君于北北
陈晓鹏,程斌,鲍胜华,张卫东,黄晨,王东,丁守勇,俞远林,彭俊璐,张文君,于北北
(皖南医学院弋矶山医院 肝胆外科,安徽 芜湖 241001)
腹腔镜胆囊切除术(laparoscopic cholecystectomy,LC)发生胆管损伤(bile duct injury,BDI)是一种常见而严重的并发症,若不能及时发现并进行有效处理,可导致严重后果。文献及临床预防BDI的措施众多,但LC时BDI发生率仍居高不下,国外报道约为0.4%~0.6%[1-2],国内有报道为0.31%,多在0.2%~0.8%[3],大约较开腹胆囊切除术(open cholecystectomy,OC)增加了2倍,实际可能更高。究其原因,除难以避免的认知错误外[4],还在于现有预防措施可能仍不够完善或不十分可靠。笔者近年在诊治不同类型BDI(横断或切除)的基础上,分析发生各种BDI的原因,并结合LC操作体会,归纳总结一种新的BDI预防概念,即沿“胆囊管”逆行追踪法(简称逆行追踪法),经模拟解剖和临床应用,效果显著,现报告如下。
1 资料与方法
1.1 临床资料
皖南医学院弋矶山医院肝胆一科2018年3月—2018年10月单纯施行LC的胆囊炎患者324例,其中男115例,女209例;年龄11~89岁,平均50.5岁。其中慢性胆囊炎267例(包括慢性萎缩性胆囊炎 7例),急性胆囊炎或胆囊炎急性发作57例(包括急性化脓或坏疽性胆囊炎12例)。324例中,胆囊结石292例(含残余胆囊结石1例),各类胆囊息肉27例,胆囊结石并胆囊息肉3例,既无结石又无息肉2例(含残余胆囊炎1例)。合并高血压病 51例,2型糖尿病21例,急性胰腺炎10例,局限性腹膜炎3例,其他合并症,如肝硬化、冠心病、脑梗塞等共40例次。所有患者均施行LC术,术中均采用逆行追踪法。
1.2 逆行追踪法概念
沿“胆囊管”逆行追踪法基本要点有:⑴ 术者解剖胆囊三角,分离出“胆囊管”后,在没有确认汇入胆囊前,均不宜断夹,而应紧贴该“胆囊管”采取钝性和锐性结合的方法,继续向胆囊和肝门方向逆行追踪分离。⑵ 在此逆行游离过程中,如发现该“胆囊管”发自胆囊,而非发自肝内胆管,且该“胆囊管”与胆囊壶腹之间并无其他胆管,则可靠近胆总管安全断夹之,并切除胆囊。⑶ 如发现该“胆囊管”或其属支发自肝脏或肝内胆管,说明其并非真正的胆囊管或胆囊管的安全部位,而可能是正常或变异胆管,因此不可断夹,否则会致严重BDI。此时,应改变解剖部位或路径,直至安全切除胆囊,必要时中转开放手术。
1.3 逆行追踪法解剖学基础
根据胆囊管汇入角度、胆囊管汇入肝外胆管位置、副肝管汇入胆囊管方式不同,选取8 种临床常见的胆管结构(变异)图[5](图1),利用逆行追踪法在8 种临床常见的胆管结构(变异)图进行模拟解剖。结果显示,不论胆囊三角和胆管结构是否存在变异,如紧贴胆囊管或其安全部位向胆囊体底部逆行游离(实线箭头表示),可发现其发自胆囊、而非发自肝内胆管,胆囊管与胆囊壶腹之间亦无其他胆管或变异胆管(图1A-B),则可安全断夹之,并安全切除胆囊。如沿分离出的假“胆囊管”(实为正常或变异胆管)向肝、向上逆行游离(虚线箭头表示),则会发现其发自肝脏,其可能是正常 (图1A-C)或为变异胆管(图1D-G),也可能为胆囊管的危险部位(图1H)。此时,如继续沿分离出的假“胆囊管”或变异胆管径直向胆囊切除,在其起始和/或近肝处予以断夹,则会导致BDI或严重胆管缺损。故应中止该方向进一步操作(×号表示),并改变解剖路径,以避免BDI。
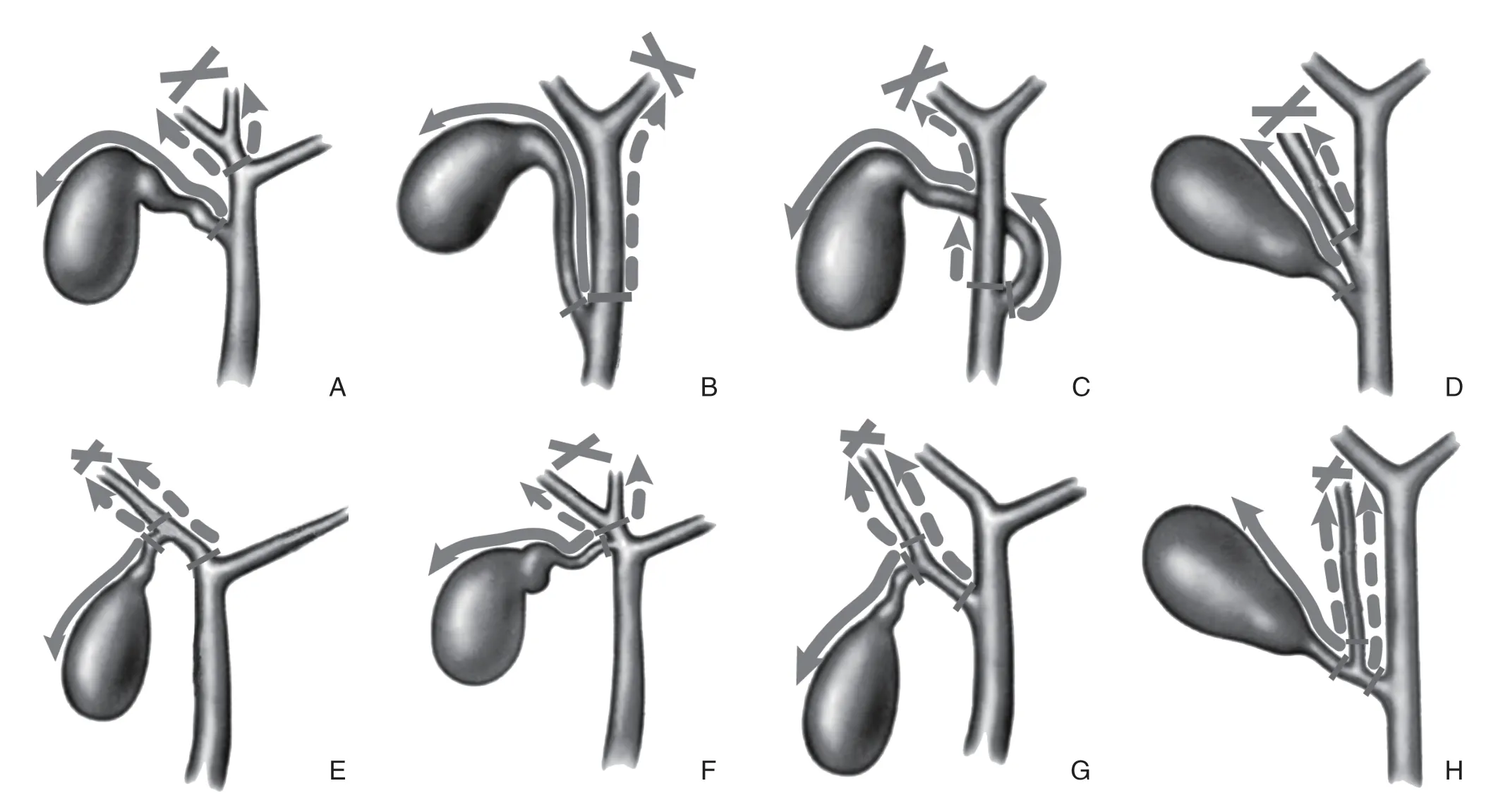
图1 逆行追踪法解剖模拟图 A:经典型胆囊管汇入胆总管;B:胆囊管与肝总管平行(低位汇入胆总管);C:胆囊管经胆总管后方汇入胆总管右侧壁;D:胆囊管与副右肝管并行汇入肝总管;E:胆囊管汇入右肝管;F:胆囊管汇入汇合部;G:胆囊管汇入副右肝管;H:副右肝管汇入胆囊管Figure 1 Simulated diagrams of retrograde tracing method A: Typical fashion of the cystic duct entering into the common bile duct; B: Cystic duct parallel to the common hepatic duct (entering into the common bile duct at a lower site); C: Cystic duct entering into right side of the common bile duct passing though the rear wall of the common bile duct; D: Cystic duct parallel to the right accessory hepatic duct before entering into the common bile duct;; E: Cystic duct entering into the right hepatic duct; F: Cystic duct entering the confluence of left and right hepatic ducts; G: Cystic duct entering into the right accessory hepatic duct; H: Right accessory hepatic duct entering into the cystic duct
1.4 逆行追踪法手术操作
L C 均用气管插管全麻,3 孔或4 孔法。进腹探查后,常规解剖胆囊三角,并尽量掏空其内脂肪和炎性组织,分离出胆囊动脉和“胆囊管” (图2A);如炎症粘连严重,胆囊三角难以解剖,可采用钝性解剖[6-7]、后三角入路[8-9]或胆囊(或壶腹)浆膜下径路[10-11]等方法,以助分离出“胆囊管”。再采用前述沿“胆囊管”逆行追踪法(图2B),向胆囊及肝脏方向解剖,如发现其延自胆囊而非发自肝内,则予以断夹,顺行切除胆囊。如发现其或另有分支延自肝内,且比较粗大(图2C),则终止进一步向上游离。此时,应调整思路、重新解剖,在确认的安全部位断夹胆囊管(图2D),直至完整切除胆囊。术毕视情放置腹腔引流。

图2 逆行追踪法术中操作 A:解剖胆囊三角;B:沿“胆囊管”逆行追踪(钝性或锐性)解剖;C:胆囊管有肝外右后叶胆管支延自肝内(黄色箭头);D:在胆囊管的安全部位断夹胆囊管(绿色箭头)Figure 2 Intraoperative performance of retrograde tracing approach A: Dissection of the Calot's triangle; B: Retrograde dissection along the “cystic duct” (blunt or sharp dissection); C: Right posterior sectoral duct opening into the cystic duct (yellow arrow); D: Clamp of the cystic duct at the safe site (green arrow)
2 结 果
2.1 患者术中情况
术中解剖胆囊三角、分离出“胆囊管”后,沿其向胆囊和肝脏逆行追踪游离,结果证实其319例为实际胆囊管或其安全部位;3例向上追踪解剖后发现为实际为肝(胆)总管,2例为变异的肝外右后叶胆管汇入胆囊管变异(图2C-D,对应于图1H)。 该5例均经改变解剖部位、重新游离确认胆囊管后切除胆囊。324例共发现各种胆管变异4例,2例如上述介绍;1例残余胆囊炎,术前MRCP提示可能存在胆囊管汇入肝外右后叶胆管,经逆行追踪法证实(图3,对应于图1G);另1例为胆囊管与肝总管平行低位汇入胆总管(对应于图1B)。
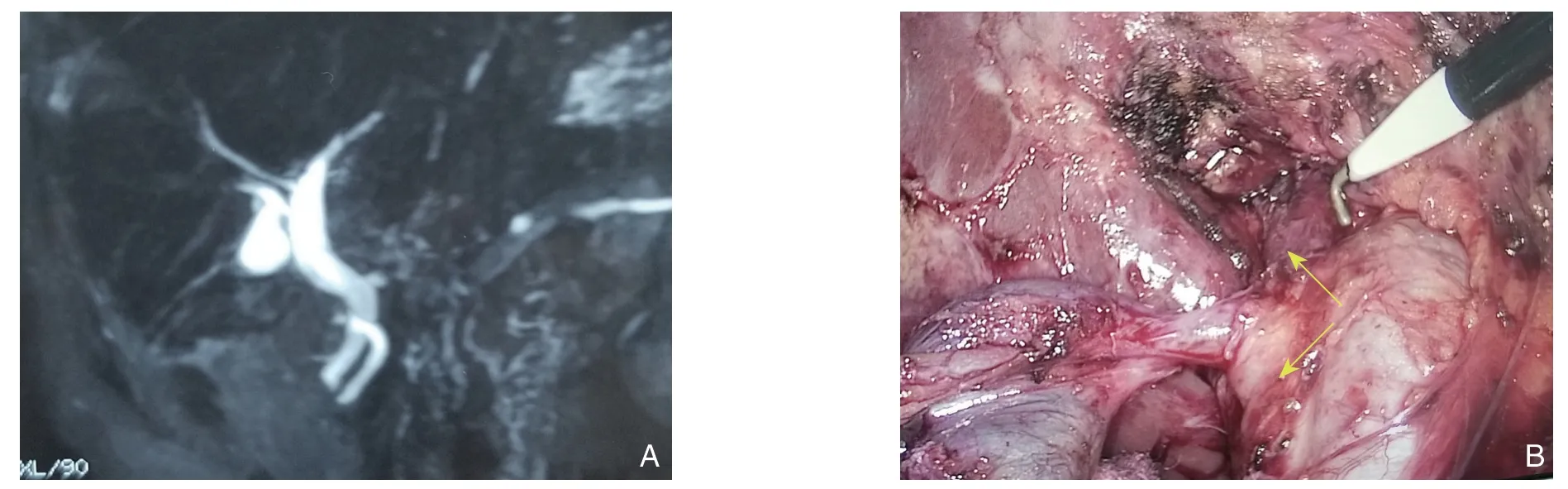
图3 残余胆囊炎患者胆囊管汇入肝外右后叶胆管 A:术前MRCP;B:术中经逆行追踪法解剖证实为胆囊管汇入变异右后叶胆管(黄色箭头)Figure 3 Cystic duct opening into extrahepatic right posterior sectoral duct in one case with Residual cholecystitis A: Preoperative MRCP; B: Cystic duct opening into right posterior sectoral duct (yellow arrow) found by retrograde tracing
2.2 手术结果
324例LC手术全部完成,无中转开腹,LC成功率100%。手术时间25~210 min,平均64.3 min;术中出血量2~150 mL,平均7.3 mL 。所有手术仅 1例术后出现轻微胆汁漏、胆囊区少量积液,穿刺孔感染2例,经穿刺引流、伤口换药而愈;其余患者未发现BDI[12],均恢复顺利。术后住院时间1~13 d,平均 2.6 d。1个月后复诊未见黄疸、腹痛和发热等异常。
3 讨 论
预防BDI的主要策略与方法有:术前必要的影像学检查、加强训练、提高术者BDI的警觉性[4,13]、 安全规范的手术操作、钝性分离[6-7]、术中导航 定 位[14]、以Rouviere沟[9,15-17]、Hartmann袋或前哨淋巴结作为解剖标志[18-19]、对分离出的管道反复多次辨认、或应用术中超声检查(intraoperative ultrasound,IUS)[20-21]、术中胆道造影(intraoperative cholangiography,IOC)[22-24]、术中注射吲哚菁绿荧光造影[25-27]、后三角入路[8-9]、胆囊(或壶腹)浆膜下径路[10-11]、胆囊动脉入路[28]、逆行胆囊切除或次全切除[29-30]以及适时中转开腹等。这些方法已为外科医师熟知、应用,对提高LC安全性,降低BDI发生率,发挥了重要作用。但这些方法有的比较繁琐或需要特殊设备,或延长手术时间、增加患者费用,且均不能完全预防BDI的发生,故有必要进一步探讨新的、更加有效的预防策略。
笔者近年在诊治不同类型BDI(横断或者切除)的基础上,结合LC实践,凝练提出一种新的预防BDI理论和方法,即逆行追踪法。有认为其日常LC即如此游离,因而不算新方法。但查阅文献,并无相关文献予以介绍或加以凝练命名为沿“胆囊管”逆行追踪法。与众多预防方法相比,逆行追踪法强调:在L C 初始分离出“胆囊管”后,应紧贴其向胆囊和肝脏方向逆行追踪游离,然后根据其是否汇入胆囊或发自肝内胆管,以甄别其真假,判断其是否为真实的胆囊管或胆囊管的安全部位。如游离后证实为真胆囊管,方可断夹、安全切除胆囊。否则应改变解剖部位,重新寻找胆囊管,直至胆囊切除。这是其根本不同之处,因而是一种新理论或新概念。
首先,本研究选取临床常见的8 种胆管结构(变异)图,应用逆行追踪法进行模拟解剖。如沿实际胆囊管或其安全部位向胆囊和肝脏逆行游离,则发现其并非发自肝内胆管,则可安全断夹之,并切除胆囊。如沿正常或变异胆管(类似于实际手术中可能分离出的假胆囊管)逆行追踪,会发现该其发自肝脏;此时,只要终止操作、改变解剖路径,就可避免BDI;否则,会致严重缺损。继之,本研究又在324例LC患者中进行临床应用。术中解剖胆囊三角、分离出“胆囊管”后,应用逆行追踪法向胆囊和肝脏游离,结果证实发现319例为真实胆囊管;另5例出自或与肝内胆管连通,而非真实的胆囊管或其安全部位。借助逆行追踪法,安全完成所有LC,仅1例术后出现轻微胆汁漏,无其他BDI发生,同时还发现4例胆管变异。
笔者体会逆行追踪法有如下优点:⑴ 可有效预防BDI。逆行追踪法强调,LC分离出“胆囊管”后,无论其是否为真实胆囊管,均应先紧贴其向胆囊和肝脏方向逆行追踪游离,以判断其真伪,再决定是否断夹或改变解剖部位,从而有效避免B D I,本组仅1 例术后发生轻微胆汁漏,效果显著。即便“胆囊管”于分离之初已被切断,如继续沿其向上逆行游离时发现为正常或变异胆管,则不会再将其于近肝处切断,就可避免胆管缺损这种严重的损伤。因为,仅有胆管横断者,对端吻合比较简单,疗效肯定;如被切除导致缺损过长,则不易对端吻合,多需行胆管空肠Roux-Y吻合术[31-34],日后易发返流性胆管炎或吻合口狭窄。⑵ 操作简便,不需要特殊仪器设备。无论术者分离出的“胆囊管”真假,只要沿之继续逆行解剖,均可进行甄别。当然,如遇重度炎症粘连,难以显示胆囊管和胆囊前三角等极端情况时,需结合其他方法如先解剖后三角、钝性解剖等,以助显露,为逆行“逆行追踪法”应用创造条件,本组共有急性胆囊炎57例(其中急性化脓或坏疽性胆囊炎12例),萎缩性胆囊炎7例,通过上述方法均能解剖出胆囊管,然后逆行分离以辨真假。⑶ 不刻意追求胆囊三角的解剖。逆行追踪法强调沿分离出“胆囊管”逆行追踪,以甄别其真假,无需拘泥于胆囊三角的解剖。⑷ 有助于发现胆管变异。模拟解剖显示,逆行追踪法能很好识别各种胆管变异。LC患者术前多行超声检查,无法判断是否存在胆管变异。但如果LC时严格采用逆行追踪法,则可发现潜在的胆管变异,并规避损伤。本研究共发现4例胆管变异,其中3例术前并无MRCP资料。因此,逆行追踪法同样适用于伴有各种胆管变异时的LC。
总之,逆行追踪法是一种新的预防BDI概念,具有安全有效、操作简便等优点,可作为其他预防方法的有益补充,值得临床进一步研究应用。当然,本研究所提逆行追踪法预防BDI,并不包括胆管撕裂伤、电灼伤及血管损伤等;其创新性、安全性和有效性还需多中心、前瞻性临床对照研究来检验。
