反式-茴香脑对叠氮钠诱导的PC12细胞损伤的保护作用
2019-03-14何中洪
何中洪,郑 茜,魏 静,杜 曦,郭 凯,张 春,王 钦
(西南医科大学药学院医药产业化研发中心,四川 泸州 646000)
阿尔茨海默病(Alzheimer's disease, AD)、帕金森病(Parkinson's disease, PD)等神经退行性疾病与脑内线粒体功能障碍密切相关[1-2]。有资料显示,AD患者线粒体内线粒体呼吸链复合体Ⅳ,即细胞色素C氧化酶(cytochrome C oxidase, COX)活性的减少较为明显且特异。因此,有些学者推测,COX的抑制可能导致培养细胞内出现类似AD的病理改变。叠氮钠(sodium azide, NaN3)是一种特异性COX抑制剂,它可以特异性抑制线粒体氧化磷酸化过程中的COX,造成细胞线粒体功能障碍,从而进一步导致细胞生命活动所需的ATP减少、自由基产生的增多、多种凋亡因子的释放和细胞膜的损伤,最终导致一系列类似AD的病理改变。因此,NaN3可以通过损伤线粒体活性,建立具有部分类似AD、PD病理改变的动物和细胞模型[3]。PC12细胞株来源于大鼠肾上腺嗜铬细胞瘤,具有神经内分泌细胞的一般特征,其稳定、生长迅速和不易发生自动转化等优点,可建立能传代的二倍体的细胞系,因其细胞结构、功能和形态类似于神经细胞,可作为体外研究神经性疾病的细胞模型[4]。
茴香广泛用于食品香精和传统药物,其所含成分反式-茴香脑(trans-anethole, TA)具有多种多样的生物活性。据报道,TA可以通过抑制细胞释放一氧化氮(nitric oxide,NO)和前列腺素E2(prostaglandin E2,PGE2),实现抗炎作用[5-6];通过有效抑制乙酰胆碱脂酶活性,起到抗氧化应激作用[7];通过激活N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体,减轻细胞内钙超载,进而明显改善氧葡萄糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)诱导的神经元损伤[8]。但TA的神经保护作用是否通过抑制线粒体损伤途径而发挥,目前研究并未完善。本实验以NaN3与PC12细胞共孵育,制备线粒体损伤模型,观察TA对NaN3诱导的PC12细胞损伤的保护作用,为探讨TA防治神经退行性疾病的作用及可能机制提供一定依据。
1 材料
1.1药物与试剂TA(阿达玛斯试剂,纯度>98%);NaN3(成都金山化学试剂有限公司);胰蛋白酶、青霉素、链霉素(Bioder公司);DMEM高糖培养基(Hyclone公司);胎牛血清(杭州四季青公司);CCK-8检测试剂盒(日本同仁化学研究所);乳酸脱氢酶(lactic dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)试剂盒(南京建成生物工程公司);其他试剂均为国产分析纯。
1.2仪器SW-CJ-1F型超净工作台(上海苏净实业有限公司);HERA·Cell 150i型CO2培养箱(赛默飞世尔科技有限公司);Spectra Max M3多功能酶标仪(美国Molecular Devices);CKX53-SLP倒置相差显微镜(日本Olympus公司)。
2 方法
2.1PC12细胞的传代培养PC12细胞购自中国科学院细胞库(上海)。用含10%胎牛血清的DMEM高糖培养基,于37 ℃、5% CO2培养箱中培养,每2~3 d传代1次,当细胞贴壁约80%时用于实验。
2.2CCK-8法测定细胞存活率将细胞接种于96孔培养板(细胞接种密度为5×107·L-1),生长至80%汇合时,弃去培养液,用PBS清洗1次,加入含7%浓度CCK-8工作液,37 ℃、5% CO2培养箱内孵育40 min。用全自动酶标仪在波长450 nm处测定其OD值。细胞存活率/%=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
2.3TA及NaN3对细胞的毒性考察选取对数生长期的PC12细胞,接种于96孔培养板(细胞接种密度为5×107·L-1),生长至80%融合时加入药物处理。处理分成溶剂对照组、TA处理组和NaN3处理组。TA处理组加入终浓度为10、30、60、100、150、200 μmol·L-1的TA,每个浓度设5个复孔;NaN3处理组加入终浓度为9、18、27、36、45、54 mmol·L-1的NaN3,每组5个复孔。将细胞置于37 ℃、5% CO2培养箱中培养48 h后,采用CCK-8法测定细胞存活率。
2.4TA对NaN3诱导PC12细胞损伤的保护作用选取对数生长期的PC12细胞,接种于96孔培养板(细胞接种密度为5×107·L-1),生长至80%融合时进行后续实验。将细胞分成溶剂对照组、模型组、处理组。模型组加入一定浓度NaN3(对细胞损伤模型的有效浓度);处理组预先加入TA(终浓度为10、30、60、100、150、200 μmol·L-1),每个浓度设5个复孔,置于37 ℃、5% CO2培养箱中分别培养8、16、24 h后,弃培养液,加入含NaN3(对细胞损伤模型的有效浓度)继续培养24 h后,倒置显微镜下观察各组细胞的形态学改变,采用CCK-8法测定细胞存活率。
2.5Hoechst33258染色观察细胞凋亡取处于对数生长期的PC12细胞,接种于6孔培养板(细胞接种密度为5×107·L-1),按照“2.4”项下方法处理细胞。培养结束,吸去培养液,95%乙醇固定10 min,PBS洗2次,每孔加入500 μL Hoechst 33258染色液,室温避光染色5 min,PBS洗2次,用中性树脂封片,于倒置荧光显微镜下观察细胞形态并拍照。镜下随机找到5个不重复区,计数200个细胞中凋亡细胞数。其中凋亡细胞所占百分比即为细胞凋亡率。
2.6细胞比色法测定细胞LDH、MDA及SOD活力根据细胞中LDH催化乳酸生成丙酮酸二硝基苯肼化合物,在碱性溶液里显棕红色,通过分光光度法,求出细胞上清液中LDH的含量。根据细胞中LDH的漏出量,可判断细胞的受损程度。按照“2.4”处理细胞结束后,取细胞培养上清液,按照LDH试剂盒操作说明进行检测和计算。2-(4-碘苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯基)-2氢-四唑盐,二钠盐(WST-1)能与超氧阴离子(O2-)反应生成一种水溶性染料,WST-1与超氧阴离子还原反应的比率与黄嘌呤氧化酶的活性呈线性关系,且能被SOD抑制。因此,通过WST-1法可测定样本中SOD含量。MDA和硫代巴比妥酸(thiobarbituric acid, TBA)在酸性和高温条件下能发生缩合反应,生成红棕色的三甲川(3,5,5-三甲基恶唑-2,4-二酮)产物,其在532 nm处有最大吸收峰。通过TBA法可测定样本中MDA的含量。消化收集各组细胞,每组加500 μL PBS使细胞重悬,采取反复冻融的方法(液氮5 s,-20 ℃冰箱30 s,室温解冻,如此重复3次)裂解细胞,1 000 r·min-1离心8 min,取上清液,按照SOD、MDA试剂盒操作说明进行检测和计算。将各组计算所得数据与正常组的数据的百分比值作为最终数值。

3 结果
3.1TA对PC12细胞存活率的影响Fig 1结果显示,与对照组比较,TA从低浓度到高浓度处理PC12细胞48 h,对细胞存活率无明显影响(P>0.05),表明TA对PC12细胞基本无毒性。
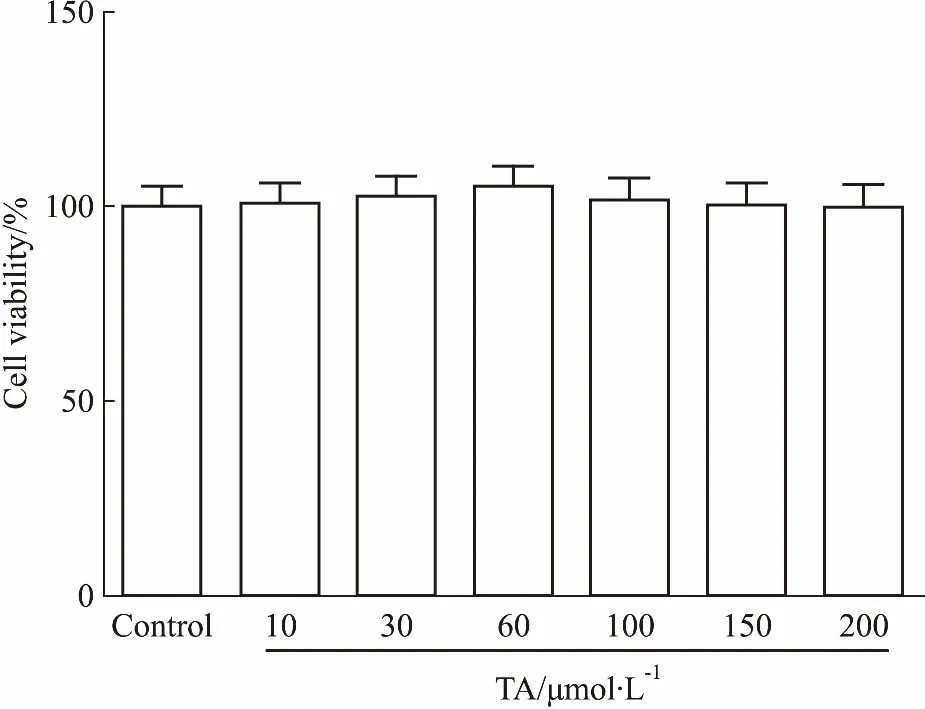
Fig 1 Effect of TA on cell viability of PC12 n=5)
3.2NaN3诱导PC12细胞损伤模型的建立Fig 2结果显示,与对照组比较,NaN3对PC12细胞损伤具有剂量依赖性,差异均有统计学意义(P<0.01)。其中27 mmol·L-1NaN3培养24 h,细胞存活率约为50%。因此,27 mmol·L-1NaN3为细胞损伤模型的有效浓度。选用27 mmol·L-1NaN3作用PC12细胞24 h作为PC12细胞损伤模型。

Fig 2 Effect of NaN3 on cell viability of PC12 n=5)
**P<0.01vscontrol
3.3TA对NaN3诱导PC12细胞损伤的保护作用如Fig 3所示,不同浓度TA预处理8 h,TA(10、30、60 μmol·L-1)给药组对NaN3诱导的PC12细胞损伤呈浓度依赖性的保护作用,即随着TA浓度增加,其对PC12细胞的保护作用增强。60 μmol·L-1TA预处理8、16、24 h,均对NaN3导致的细胞损伤具有明显的保护作用。
3.4TA对NaN3诱导PC12细胞损伤的形态学的影响如Fig 4所示,正常PC12细胞形态为梭形、小三角形等,各细胞间紧密接触,成簇生长,且从细胞边缘有突出的突起,相互交错的突起形成网络。模型组梭形细胞减少,细胞突起变短或者消失,部分细胞皱缩、变圆、脱落、漂浮于细胞培养液中,细胞出现明显损伤形态。10、60 μmol·L-1TA预处理8 h,与模型组相比,均能改善NaN3诱导PC12细胞损伤的细胞形态。
3.5TA对NaN3诱导PC12细胞Hoechst33258染色的影响如Fig 5所示,Hoechst 33258染色后,对照组PC12细胞核呈现弥散均匀微弱的蓝色荧光,表明其凋亡细胞少。模型组多数细胞呈现出较强的蓝白色荧光,细胞核明显变小,呈现不规则形状,有些细胞内可见浓染致密的颗粒状荧光,表明细胞凋亡数量明显增多(P<0.05)。根据Hoechst 33258染色结果,计算细胞凋亡率,10、60 μmol·L-1的TA均能明显减少NaN3诱导PC12细胞的凋亡。其中,60 μmol·L-1TA的保护作用最佳。
3.6TA对NaN3诱导PC12细胞损伤的LDH漏出量的影响细胞上清液中LDH水平反映了细胞的受损程度。NaN3损伤后,LDH漏出量明显增加,而10、60 μmol·L-1TA预处理可明显对抗NaN3诱导的PC12细胞内LDH的释放,减轻细胞损伤。见Fig 6。

Fig 3 Effect of TA on PC12 cell injury
#P<0.05vscontrol;*P<0.05vsNaN3model
3.7TA对NaN3诱导PC12细胞损伤的SOD活力和MDA含量的影响如Fig 7所示,与对照组相比,模型组PC12细胞内SOD活力明显降低(P<0.05)、MDA含量明显升高(P<0.05)。与模型组相比,10、60 μmol·L-1TA组均可明显提高PC12细胞内SOD活力(P<0.05),降低PC12细胞内MDA含量(P<0.05),表明TA能提高细胞的抗氧化能力,减轻细胞氧化损伤。

Fig 4 Effect of TA on morphology of PC12 cell injury induced by NaN3(×400)
A:Control;B:NaN3(27 mmol·L-1);C:TA(10 μmol·L-1)+NaN3(27 mmol·L-1);D:TA(60 μmol·L-1)+NaN3(27 mmol·L-1)
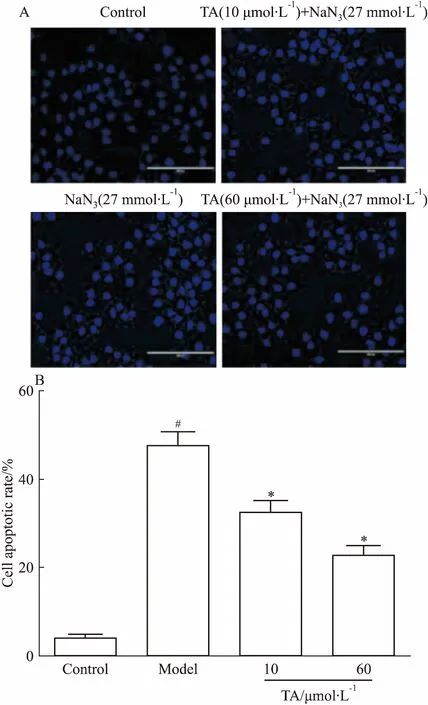
Fig 5 Effect of TA on Hoechst 33258 staining of PC12 cell injury induced by NaN3(×100)


Fig 6 Effect of TA on LDH leakage of PC12 cell injury induced by n=5)
#P<0.05vscontrol;*P<0.05vsNaN3model
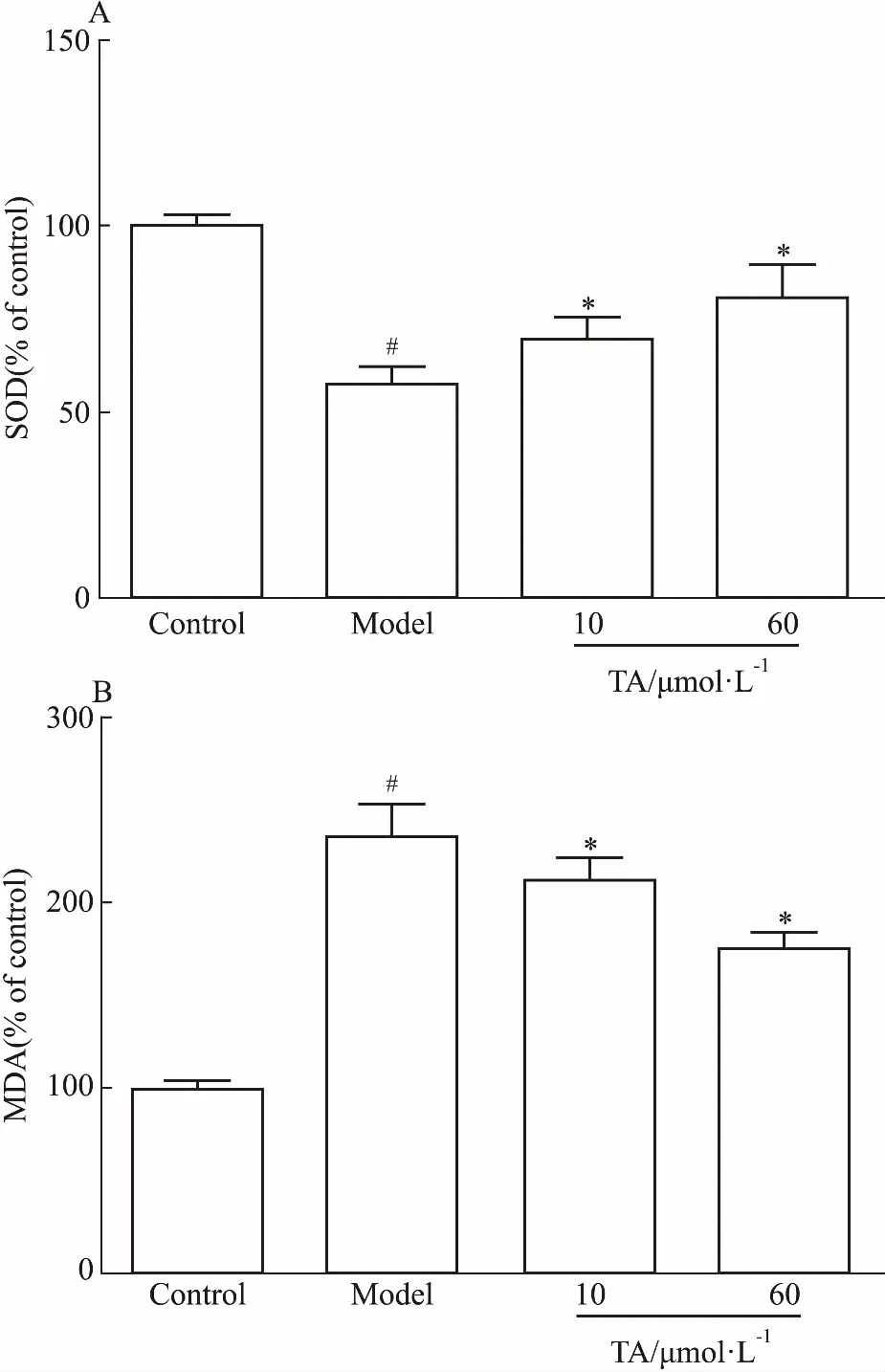
Fig 7 Effect of TA on activity of SOD(A) and MDA(B) of PC12 cell injury induced by n=5)
#P<0.05vscontrol;*P<0.05vsNaN3model
4 讨论
中枢神经系统退行性疾病的发生与线粒体功能障碍密切相关,线粒体功能失调以及由线粒体介导的神经细胞凋亡,在退行性疾病的发生、发展中起了重要的作用。氧化应激是指活性氧生成与抗氧化防御系统之间的不平衡状态,氧化应激可在活性氧生成超过抗氧化防御系统时,或者在抗氧化剂活性降低时发生。氧化应激能够导致脂质过氧化、蛋白和DNA氧化和氧化还原态的改变,从而促进神经细胞凋亡[9-10]。SOD是机体内天然存在的超氧自由基清除因子[11],它能将对机体有害的氧自由基转化成过氧化氢而被清除。MDA是脂质过氧化的产物之一[12],它能影响线粒体呼吸链复合物和线粒体内关键酶的生物活性,它的产生还能加重细胞膜的损伤。因此,考察细胞中抗氧化酶活性及细胞膜脂质过氧化物的产生,可以了解细胞的损伤程度。本研究采用常用的NaN3致PC12细胞损伤模型,考察TA对PC12细胞损伤后的保护作用。实验结果表明,经NaN3处理后,细胞内SOD活力降低,MDA含量升高。NaN3对PC12细胞的损伤呈剂量依赖性。TA对NaN3诱导PC12细胞损伤保护具有明显的时效、量效关系。60 μmol·L-1TA能明显改善PC12细胞形态,减少PC12细胞中LDH的漏出和凋亡细胞的数量,同时,可明显抵抗由NaN3损伤造成的细胞SOD活力下降,降低MDA含量。表明TA能提高机体的抗氧化能力,抑制NaN3诱导的氧化应激,减轻细胞氧化损伤。
综上所述,TA对NaN3损伤的PC12细胞具有明显的保护作用,其机制可能是TA通过提高受损PC12细胞内抗氧化酶SOD活性,减少脂质过氧化产物MDA的生成,防止细胞膜磷脂分子中的不饱和脂肪酸过氧化,维持细胞膜完整性。该结果提示,TA能够拮抗AD等神经退行性疾病中的线粒体功能障碍,对此类疾病的治疗具有一定的应用前景。
