以记忆力下降起病的原发性中枢神经系统淋巴瘤2例报告
2019-03-13蔡立君曹风雅
李 媛,楚 兰,贺 电,蔡立君,赵 艳,曹风雅
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)是指局限发生于中枢神经系统和眼球的侵袭性非霍奇金淋巴瘤,且未见累及神经系统以外的证据,病理上大多为弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)[1]。近期我院诊治2例以记忆力下降的原发性中枢神经系统弥漫性大B细胞淋巴瘤,现报道如下。
1 病例介绍
例1,患者,女,78岁,汉族,因“记忆力下降4 m,加重1 m”入院。4 m前患者无明显诱因出现记忆力下降,主要表现为近期记忆力下降。1 m前症状加重,随即就诊当地医院,2018年7月23日外院头部CT提示:侧脑室透明隔区、右侧侧脑室后角、左侧丘脑区多发病灶。头部MRI及MRI增强(见图1)提示:颅内多发结节稍高密度影,考虑:(1)淋巴瘤;(2)炎性肉芽肿;(3)其他。为进一步明确病因就诊我院。既往史、个人史、婚育史及家族史无特殊。入院查体:生命体征平稳,内科系统查体无特殊。神经系统:神志清楚,言语清晰,对答部分切题,高级认知功能减退,近期记忆力下降(无法回忆早餐、中餐等内容),计算力减退(100-7无法计算),时间空间定向力尚可。余神经系统查体未见特殊。入院后查MMSE 13分;MoCA 11分。腰椎穿刺提示脑压155 mmH2O,细胞总数90 M/L,有核细胞数30 M/L,蛋白115 mg/dl,脑脊液病毒全套、墨汁染色、细菌培养及脱落细胞学未见明显异常。2018年8月8日入院头部MRI提示右侧侧脑室后脚旁及左侧丘脑、背侧丘脑占位;DWI提示右侧侧脑室后脚旁及左侧丘脑、背侧丘脑病灶部分呈稍高信号。MRS提示考虑右侧侧脑室旁占位。2018年8月10日行“立体定向脑活检术”,头部MRI定位取右侧侧脑室后脚及三脑室周围病灶中心点分别穿刺,术中取组织送病理检查。普通病理活检提示:送检脑组织内片状异性细胞,考虑为恶性肿瘤。免疫组化病理检查结果提示:异型细胞呈Vimentin(+),CD20(+),CD79a(+),Bcl-6(+),MUM-1(+),Bcl-2 80%(+),C-myc 80%(+),CK点状(+),CD10(-),CD3(-),Ki67增值指数约90%。EBER原位杂交(-),阳性对照阳。组织形态特点结合上述标记诊断为: Bcl-2和C-myc双表达弥漫大B细胞淋巴瘤,侵袭性,活化后细胞来源。可符合原发中枢神经系统大B细胞淋巴瘤。综合患者临床表现、影像学检查及病理结果,诊断:原发性中枢神经系统大B细胞淋巴瘤。2018年8月16日予以贝伐珠单抗200 mg静脉输注治疗。2018年8月17日行“颅内淋巴瘤伽马刀治疗”。2018年8月23日追踪患者,外院复查头部MRI(见图2):第三脑室前部病灶较前稍增大,右侧侧脑室后脚及双侧侧脑室体部病灶较前略变小。2018年12月18日电话随访患者,患者家属诉患者认知功能进一步减退,记忆力下降较前更加明显,无法认识家人,无法自理生活。但四肢活动及饮食尚可。
例2,患者,女,66岁,汉族,因“睡眠障碍2 y,伴记忆力减退半年”入院。患者2 y前无明显诱因出现睡眠障碍,表现为难以入眠,易胡思乱想,夜间入睡时间约2~5 h,未诊治。半年前患者出现记忆力下降,放置物品无法回忆起所放位置,计算能力较前减退入院。既往发现血压升高1 m,最高血压180/90 mmHg,未正规治疗;10 y前外院行“子宫肌瘤切除术”;5 y前“右腿包块”行手术治疗,术后病检提示“胶质瘤”(具体不详,未见病理报告)。余既往史、个人史、家族史无特殊。入院查体:生命体征平稳,步入病房,心肺腹阴性。神经系统:神志清楚,言语清晰,查体合作,对答切题。记忆力减退,计算能力差100-7=93,93-7=79,余神经系统查体无特殊。入院后查:日常生活能力量表:18分,MMSE量表:16分;Moca量表:13分。脑电图提示:界限性脑电图及脑地形图。头部MR平扫:胼胝体体部-压部占位(见图3)。头部DWI:胼胝体体部-压部占位扩散受限。头部SWI诊断意见:胼胝体体部-压部占位内微出血灶。头部MR增强:胼胝体体部-压部占位,考虑淋巴瘤。头部MRS:胼胝体体部-压部占位符合脑内肿瘤MRS改变。腰椎穿刺:测脑压168 mmH2O,脑脊液常规+抗酸+革兰氏染色+真菌染色:蛋白质(),细胞总数16 M/L,有核细胞数2 M/L。脑脊液生化csf-pro 241.00 mg/dl。脑脊液墨汁染色未找到隐球菌。2018年6月25日行立体定向脑活检术。术后病理结果回示:脑组织肿瘤。脑组织穿刺活检免疫组化结果回示:送检脑组织均为非霍奇金淋巴瘤,弥漫性大B细胞性淋巴瘤,生发中心细胞来源,侵袭心,双表达。免疫组化结果:CD10(+),CD138(-),CD20(+),CD3(-),CD5(-),CD56(-),CD78a(+),CgA(-),CD(-),c-myc(+)40%,CyclinD(-),BCL-2(+)50%,BCL-6(+)80%,EMA(-),GFAP(-),GranzymeB(-),IDH1(-),Melan-A(-),P53(+),PAX5(+),s100(-),Syn(-),HMB45(-),MUM-1(-),ki-67(+)95%。补充脑组织活检病理:Eber原位杂交结果(-),阳性对照(+)。2018-6-28行头部伽玛刀治疗。术后辅以贝伐珠单抗化疗。骨髓细胞学:骨髓增生活跃,粒红比值2.5。意见:未见异常细胞。流式细胞学检查未见异常。骨髓淋巴瘤克隆性基因检测阴性;C-MYC(8q24)、IGH-CCND1、IGH-BCL2、P53均阴性。骨髓活检:破碎骨髓腔中见一些造血细胞分布,并见窦血和出血。粒红比值大致正常,各阶段粒、红细胞均可见,偏成熟的粒细胞易见。巨核细胞可见,见个别单原核巨核细胞。网状纤维明显增加(),未见其他异常。追踪患者,2017年7月3日复查头部MRI提示:胼胝体体部-压部占位术后改变,较前稍减小。
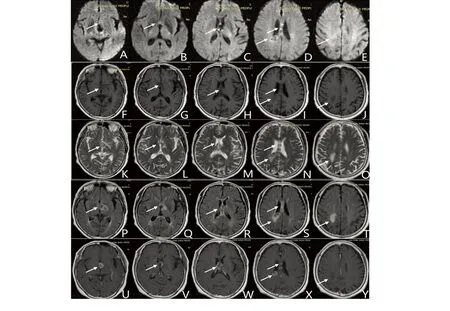
图1 例1患者头部MRI及增强(2018年7月23日)影像学资料。A~T为头部MRI轴位,U~Y为头部MRI增强轴位。A~E为DWI序列,箭头所指为右侧侧脑室后角、透明隔区、大脑镰病灶,DWI未见明显细胞毒性水肿;F~J为T1序列,箭头所指为透明隔区,大脑镰和右侧侧脑室后角病灶;K~O为T2序列,箭头所指为透明隔区,大脑镰和右侧侧脑室后角病灶及水肿带;P~T为FLAIR序列,箭头所指为透明隔及大脑镰、右侧侧脑室后角病灶;U~Y为头部MRI增强,箭头所指为透明隔、大脑镰及右侧侧脑室后角病灶增强,其中X图可见右侧侧脑室后角“开口征”
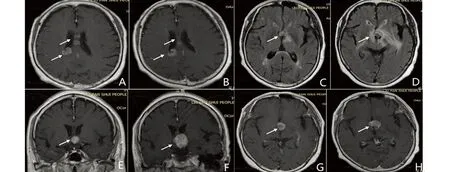
图2 例1患者治疗前后头部MRI对比:A/C/E/G为治疗前,B/D/F/H为治疗后。A、B为头部MRI增强侧脑室平面,病灶见箭头所指区域,患者经过伽马刀治疗后,右侧侧脑室后角、大脑镰病灶较前缩小;C、D为FLAIR序列,可见第三脑室前部病灶较前增大,水肿区域增大;E、F为头部MRI增强冠状位,可见第三脑室前部病灶较前增大;G、H为头部MRI增强轴位,可见第三脑室前部病灶较前增大
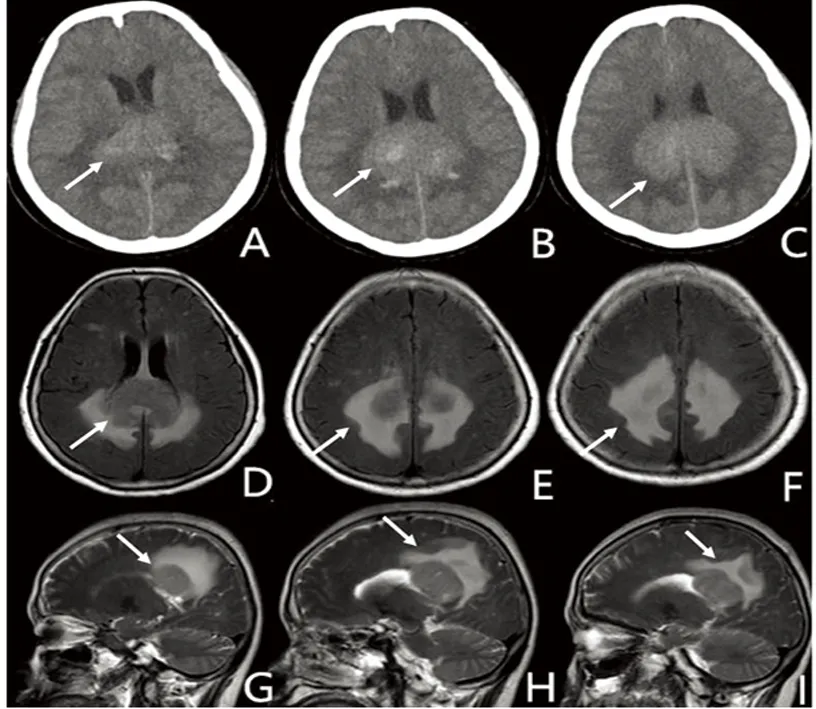
图3 例2患者头部影像学情况。A~C为患者头部CT检查提示中线结构区占位;D~F为头部MR平扫轴位:胼胝体体部-压部占位;G~H为患者头部MRI T2矢状位,可见胼胝体体部-压部占位及水肿
2 讨 论
原发性中枢神经系统淋巴瘤(PCNSL)是一种罕见的非霍奇金淋巴瘤(NHL),约占原发性中枢神经系统(CNS)肿瘤的4%[2],大多数非艾滋病相关的PCNSL患者年龄在45~65岁之间,中位数为60岁,年龄小于14周岁患者极少患病,男女比例均等[3]。本文中2例患者均为女性,1例66岁,1例80岁。PCNSL最显著的危险因素是免疫缺陷,包括艾滋病毒感染、医源性免疫抑制和先天性免疫缺陷。PCNSL常见5种临床病理学特征表现:(1)颅内病变(单个或多个);(2)弥漫性软脑膜或侧脑室旁病灶;(3)玻璃体/葡萄膜沉积;(4)硬膜内脊髓病灶;(5)神经淋巴瘤(非霍奇金淋巴瘤)。T细胞PCNSL和B细胞PCNSL比例基本相同,较少累及眼睛。本文中2例患者均仅有颅内病变,病灶部位是胼胝体及侧脑室周围。
PCNSL临床表现因病灶区域而不同,在248人的一项研究中显示[4]:70%患者临床表现为局灶性神经功能缺损;43%患者表现有神经精神症状;33%患者有颅高压表现;14%患者出现癫痫;仅有4%患者为眼部症状(同一名患者可存在多种临床症状)。PCNSL发病症状常表现为头痛、视物模糊、运动困难以及性格改变。最后可能出现抑郁、冷漠、精神病、记忆障碍、思维迟钝以及视幻觉等。性格改变常与额叶、侧脑室周围白质以及胼胝体病灶有关,且因为症状发展缓慢而忽视。本文中2例患者病灶位于胼胝体或胼胝体周围,均以神经精神症状缓慢起病,病程中均出现头痛等颅高压症状、记忆力减退等高级认知功能改变及性格改变等。除了病史及体格检查之外,怀疑PCNSL还需要完善头部MRI、脑脊液相关检查(除外颅高压等禁忌)、裂隙灯检查双眼以及老年男性患者睾丸检查(除外睾丸淋巴瘤可能)。颅内MRI及造影增强是首选的检查方式。因PCNSL好发部位依次为大脑半球、胼胝体、基底节及丘脑,其次为小脑、脑干,仅发生于脑室内者罕见,幕上半球约占87%。多发的病例呈多中心浸润的特点,可位于半球的一侧或两侧,病灶大小不一,较小的病灶呈结节状,增强才显示出来,病灶多靠近蛛网膜下隙。增强病灶大部分呈实性团块状或结节状均匀强化,累及胼胝体者可呈“蝴蝶”状,典型的出现“缺口征”、“尖角征”“握拳征”[5,6]。本文中例1患者右侧侧脑室旁病灶可见明显“缺口征”(见图1X);例2患者胼胝体病灶呈“蝴蝶”状(见图3E)。大多数病灶MRI平扫T1WI呈等低信号,T2WI等、稍低信号,增强扫描可见具有特征性的握拳样、团块状、多发结节状强化[6]。如脑脊液检查未进一步明确诊断,怀疑为孤立中枢神经系统淋巴瘤,定向脑活检术是首要选择。两位患者均仅有神经系统症状,未发现其他系统受累,且完善了脑活检术,病理结果均提示原发性中枢神经系统淋巴瘤。
PCNSL病理形态上与结外的非霍奇金淋巴瘤相似,主要有以下特点:(1)肿瘤细胞弥漫性密集排列、呈片状分布,无明显边界,瘤细胞大小比较一致,细胞质少,细胞核大,染色质呈粗颗粒状;(2)肿瘤细胞在血管周围间隙聚集形成“袖套状”结构,即肿瘤细胞的围观现象;(3)部分瘤组织中散在分布吞噬细胞,即“星空现象”;(4)免疫组化显示白细胞共同抗原(LCA)阳性,绝大多数B细胞标记阳性[6]。
PCNSL主要治疗手段有限,大剂量甲氨蝶呤诱导化疗是PCNSL初始治疗的标准手段。总的来说,大剂量系统性甲氨蝶呤化疗效果优于单独放疗或不含甲氨蝶呤的化疗方案[7,8]。文献报道,利妥昔单抗联合甲氨蝶呤治疗效果优于单药,且耐受良好[9,10]。除了化疗,PCNSL对放疗十分敏感,可作为化疗方案的替代方案或二线方案,同时,对于化疗禁忌证或复发、化疗难治性患者,放疗也是一种合理的姑息方案。此外,全脑放疗(whole brain radiation therapy,WBRT)联合糖皮质激素也可以作为非化疗患者症状缓解方案[11]。不经治疗的PCNSL患者病情常迅速恶化,生存期通常在确诊后1.5 m左右。经过WBRT治疗后的患者平均生存期在10~18 m,如治疗方案为化疗或放化疗的患者则平均为44 m。总体上非免疫缺陷的PCNSL患者5 y生存率为30%左右[12]。
3 结 论
PCNSL临床表现多样,本文收集2例患者均以记忆力下降起病,且病变部位类似。该病的诊断需要临床、辅助检查包括病理活检等共同证实,故明确诊断较为困难。PCNSL治疗方法有限,特别是老年体弱,对化疗不耐受的患者更是如此。故关于该病化疗联合放疗及鞘内化疗等手段疗效报道较少,尚需进一步观察及总结。
