阿帕替尼联合紫杉醇二线治疗Her-2阴性晚期胃癌临床分析
2019-03-12华高艳朱益平郑中显
华高艳,朱益平,程 亮,郑中显,潘 明
(1.池州市人民医院 肿瘤科,安徽 池州 247100;2.皖南医学院第一附属医院 弋矶山医院 肿瘤科,安徽 芜湖 241001)
我国是胃癌高发区,发病率及病死率均较高,中国癌症统计数据2015年报道胃癌发病率及病死率均居恶性肿瘤第2位[1]。由于胃癌早期症状不典型及我国普查措施的缺乏和不均衡,约70%确诊时已为中晚期,已无根治手术机会,细胞毒药化疗是主要治疗方法,但生存期多不超过1年[2]。曲妥珠单抗联合化疗与单纯化疗治疗HER2阳性的进展性胃或胃食管交界癌临床研究(ToGA)人表皮生长因子受体2(Her-2)阳性晚期胃癌一线曲妥珠单抗联合化疗延长中位生存时间(median survival time,mOS)达13.8个月,取得了令人瞩目的疗效。Ⅱ期临床研究评估了Her-2阳性胃癌二线曲妥珠单抗联合紫杉醇或多西他赛治疗取得较长的中位无进展生存时间(median progression free survival,mPFS)(5.1~6.8个月)及mOS(16.0~16.8个月)[3],但我国胃癌大多数表达Her-2阴性,二线治疗指南推荐单药紫杉醇类或伊立替康化疗,mOS约6个月左右。目前抗血管生成靶向药物研究进展给Her-2阴性晚期胃癌带来新的希望,小分子VEGFR-2酪氨酸激酶抑制剂阿帕替尼,多个临床研究显示可延长晚期胃癌生存期[4]。本研究探讨阿帕替尼联合紫杉醇二线治疗Her-2阴性晚期胃癌的疗效与不良反应。
1 资料与方法
1.1 临床资料 收集2015年1月~2017年6月在池州市人民医院诊治的Her-2阴性晚期胃癌经SOX、XELOX或mFOLFOX6方案一线化疗后病情进展患者30例,均符合以下标准:①经影像和病理确诊为复发转移晚期胃癌,IHC及FISH检测Her-2为阴性;②ECOG 1~2分,预计生存期>3个月;③根据实体瘤疗效评价标准(RECIST 1.1),可测靶病灶≥1个;④无化疗禁忌症及合并症;⑤经医院伦理委员会批准及签署知情同意书。观察组15例,中位年龄68岁;对照组15例,中位年龄67岁,两组患者临床资料具有可比性,差异无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较[n(%)]
注:采用Fisher确切概率法。
1.2 方法及随访 观察组:阿帕替尼500 mg餐后30 min口服,1次/日,持续至病情进展;同时联合紫杉醇化疗,紫杉醇135 mg/m2,滴注3 h,第1天,地塞米松、茶苯海明预防过敏反应,21 d为1周期。对照组:单药紫杉醇化疗,剂量及方法同观察组。均完成2个周期以上治疗,最多完成6个周期。采取电话、门诊及住院方式随访,随访至2018年5月31日或死亡,中位随访时间为20个月。每8周行CT/MR检查评估疗效,同时随访血尿常规、肝肾功能、心电图及血压变化。
1.3 评价标准 二线治疗开始时靶病灶CT/MR为观察基线,RECIST 1.1标准评估疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)[5]。
近期疗效:客观有效率(RR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
远期疗效:mPFS指二线治疗开始至病情进展的时间;mOS指二线治疗开始至死亡或随访结束时间。
不良反应采用NCI-CTC 3.0药物毒性评价标准进行分度,分为0~Ⅳ度[5]。
1.4 统计学方法 采用SPSS 18.0软件进行统计学分析,计数资料以百分率表示,组间采用Fisher确切概率法,并采用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 疗效比较 近期疗效:观察组RR(20.0%)与对照组(13.3%)比较无统计学意义(P>0.05);观察组DCR(66.7%)略高于对照组(46.7%),但差异无统计学意义(P>0.05)。远期疗效:观察组与对照组mPFS分别为5.1个月(95%CI:3.9~5.6个月)和3.6个月(95%CI:2.6~4.5个月),差异有统计学意义(Z=3.488,P=0.000);mOS分别为8.3个月(95%CI:6.0~11.81个月)和6.4个月(95%CI:4.76~8.04个月),差异无统计学意义(Z=1.619,P=0.105)。见表2,图1、2。
2.2 不良反应 两组不良反应主要为乏力、高血压、白细胞减少、肝功能损伤及恶心呕吐,以Ⅰ~Ⅱ度不良反应为主,Ⅲ~Ⅳ度少见。观察组乏力、高血压较对照组高(P<0.05),均经治疗后好转,没有因药物毒副反应而停止治疗及死亡病例。见表3。
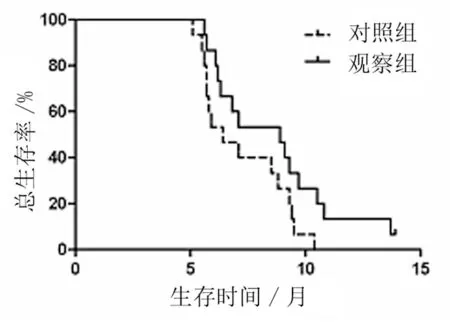
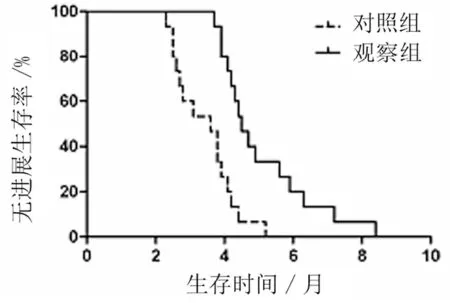
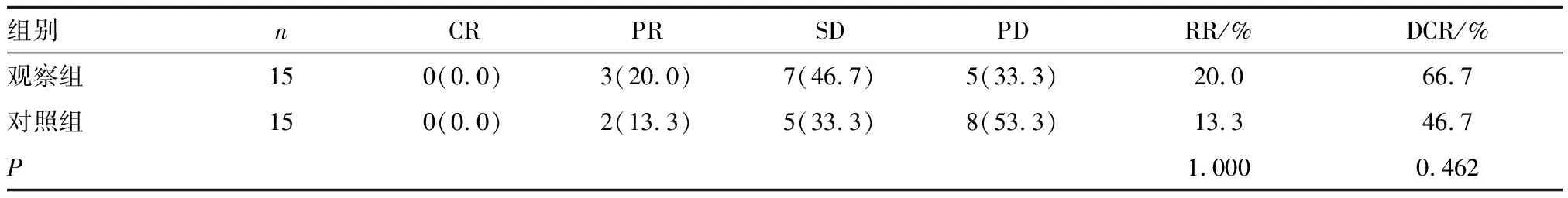
表2 两组患者近期疗效比较[n(%)]
注:采用Fisher确切概率法。

表3 两组患者不良反应比较[n(%)]
注:采用Fisher确切概率法。
3 讨论
胃癌是我国最常见的恶性肿瘤之一,占全球胃癌发病率48%,有一半以上在确诊时因局部晚期或远处转移而无法行根治性手术,化疗是晚期胃癌最有效的手段之一[6]。ToGA研究中亚组分析中国的Her-2阳性胃癌可从曲妥珠单抗联合化疗中获益[7],而我国患者Her-2阳性率约12%~13%[8],需要临床探讨Her-2阴性晚期胃癌新的治疗方法。目前抗肿瘤血管生成靶向药物在晚期胃癌治疗中取得新的进展,其中雷莫芦单抗是VEGFR-2拮抗剂,RAINBOW研究[9]证实了雷莫芦单抗联合紫杉醇二线治疗晚期胃癌优于紫杉醇单药,雷莫芦单抗可使mOS延长约2个月(9.63个月vs. 7.36个月,P=0.0169),基于此研究NCCN指南推荐其为转移性胃癌二线治疗,也说明VEGFR-2信号是晚期胃癌治疗一个重要靶点。
阿帕替尼是我国自主研发的口服小分子VEGFR-2酪氨酸激酶抑制剂,阻断介导肿瘤生长和血管生成信号通路,抑制肿瘤血管生成而发挥抗肿瘤作用。Ⅲ期临床研究纳入二线化疗失败的胃癌及胃食管结合部腺癌共273例,阿帕替尼组与安慰剂组mPFS分别为2.6个月和1.8个月(P<0.0001),不良反应轻[10]。赵鑫[11]报道晚期Her-2阴性胃癌一线治疗失败后紫杉醇联合阿帕替尼治疗较紫杉醇联合顺铂延长mPFS(9.63个月vs. 7.36个月,P<0.05)。本研究中,Her-2阴性晚期胃癌一线铂类联合氟尿嘧啶类化疗失败后阿帕替尼联合紫杉醇治疗较单药紫杉醇延长mPFS(5.1个月vs. 3.6个月,P<0.05),分析发现两组患者RR及DCR差异无统计学意义,但mPFS有获益,根据寻琛等[12]报道阿帕替尼治疗晚期胃癌部分患者CT影像上出现肿瘤密度减低和空洞生成,按照RECIST标准体积上无改善,但患者持续临床获益,与其他抗血管生成靶向药物相似,故在评估临床疗效时需考虑肿瘤密度变化。不良反应多为Ⅰ~Ⅱ度,Ⅲ~Ⅳ度少见,观察组乏力、高血压发生率高,均经对症治疗后好转,不良反应易控,安全性高。
综上所述,Her-2阴性晚期胃癌二线应用阿帕替尼联合紫杉醇方案较单药紫杉醇治疗延长中位无进展生存期,不良反应较轻。由于本研究样本量较小,需扩大样本量进一步研究,为Her-2阴性晚期胃癌二线治疗提供新的选择。
