SFPQ在肝细胞癌的表达及其对细胞增殖与细胞周期的影响
2019-03-11陈云茹丹增措姆白文东李青涂康生
陈云茹,丹增措姆,白文东,李青,涂康生
(西安交通大学第一附属医院 1. 感染科 4. 肝胆外科,陕西 西安 710061;2. 西藏自治区人民医院 妇产科,西藏 拉萨850000;3. 中国人民解放军九四三五三部队 卫生队,河南 商丘 476100)
肝细胞癌(hepatocellular carcinoma,HCC)是我国高发的恶性肿瘤,预后差,病死率高,对其研究一直是热点[1]。对HCC患者早诊断、早治疗及有效监测是延长患者生存期的有效手段[2-3]。目前,仅有甲胎蛋白(AFP)是广泛应用于临床的监测肝细胞癌预后的血清学指标,但对于AFP阴性的HCC患者不敏感,因此,寻找新的诊断指标及治疗靶点具有重要意义[4-5]。脯氨酸、谷氨酰胺的剪接因子(splicing factor proline- and glutaminerich,SFPQ)是一种DNA及RNA结合的核蛋白,由707个氨基酸组成,分子量为72 kD,碱基序列中GC含量丰富,对DNA的修复、细胞凋亡、转录调控和RNA的转运起到至关重要的作用[6-7]。近年来,对SFPQ的研究日益丰富,一些结果表明SFPQ的表达在一些癌组织低于正常组织[8]。然而,有趣的是,笔者对HCC组织的研究发现,SFPQ在HCC组织中呈高表达,为进一步探讨SFPQ在HCC组织中的表达水平、临床意义及其作用机制,本研究应用实时定量PCR法及Western blot法检测了SFPQ在HCC及癌旁组织中的表达,并利用生物信息学分析其表达水平与HCC组织学分级、临床分期及患者生存期的相关性[9-12];同时通过小干扰RNA技术体外敲低SFPQ在HCC细胞株中的表达,明确SFPQ对HCC细胞增殖的影响及其可能机制。
1 材料与方法
1.1 病例资料
收集2016年1月—2016年12月西安交通大学第一附属医院肝胆外科手术切除的HCC及癌旁组织标本39例。所有标本的病理诊断均由3位以上高年资病理医师进行诊断核对。每例患者术前均未接受任何抗肿瘤治疗,采集癌组织及相应癌旁组织(距肿瘤边缘2 cm)各200 g,立即置于液氮中保存。所取标本均经患者本人及家属同意。
1.2 主要材料
HCC细胞HepG2及Hep3B均为本实验室存储。DMEM高糖培养液购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;0.25%胰酶-EDTA,青霉素、链霉素溶液购自Hyclone公司;MTT试剂购自Abcam公司;反转录试剂盒、SYBR Premix EX Taq实时定量PCR试剂盒购自TaKaRa公司,TRIzol试剂、Lipofectamine 2000、无核酶水购自Invitrogen公司, SFPQ基因PCR引物(HPLC级制品)由TaKaRa公司设计、合成;SFPQ抗体购自Abcam公司,GAPDH抗体购自Sigma公司;二抗羊抗鼠IgG及羊抗兔购自Thermo Fisher Scientific公司;SFPQ siRNA购自GenePharma公司。
1.3 肝组织和肝细胞中SFPQ基因、蛋白的检测
1.3.1 实时定量PCR检测 将39例HCC及相应癌旁组织用于实时定量PCR检测。用TRIzol试剂提取总RNA,参照反转录试剂盒说明合成cDNA。人SFPQ正向引物:5'-ATG TCT CGG GAT CGG TTC CGG A-3', 反 向 引 物:5'-CCA ACA AAC AAC CGA CAT CGC TG-3';GAPDH正向引物:5'-TGC ACC ACC AAC TGC TTA GC-3',反向引物:5'-GGC ATG GAC TGT GGT CAT GAG-3'。参照SYBR Premix EX Taq实时荧光定量PCR试剂盒使用说明,应用ABI-PCR仪行实时PCR反应,每个模板设3个复孔,取平均CT值,以2-ΔCT(ΔCT=CTSFPQ-CTβ-actin)表示SFPQ基因的相对表达量。
1.3.2 Western blot检测 将6份HCC及癌旁组织用于Western blot检测。RIPA裂解液提取上述各组织和细胞中的总蛋白,BCA法分别测其浓度,加2×上样缓冲液后100 ℃ 5 min煮沸。行SDS-PAGE后,湿转至硝酸纤维素膜,将膜用5%脱脂奶粉封闭2 h,加入SFPQ一抗(1:1000,Abcam)、GAPDH一 抗(1:10000,Sigma) 于4 ℃共同孵育过夜,加入二抗(羊抗鼠抗体,1:1000和羊抗兔抗体1:1000,Thermo Fisher Scientific公司)室温孵育1 h,ECL增强发光,应用凝胶成像仪(Amersham™ Imager 600)拍照。
1.4 SFPQ基因在组织中的表达分析
从R2一个基因分析和可视化平台(http://r2.amc.nl)下载2个不同的G E O数据集(GSE45436和GSE54236),GSE45436数据包含39例正常组织及95例HCC组织,GSE54236包含80例正常组织及81例HCC组织,比较不同组织中SFPQ mRNA的表达情况。
1.5 SFPQ基因在HCC中的表达及生存期分析
从R2网站下载GEO数据库GSE6764,比较早期HCC及晚期HCC组织中SFPQ基因的表达差异;同时获得TCGA数据库中的366例HCC样本,提取临床分期、组织学分级及患者的生存期等资料,根据临床分期及组织学分级,比较SFPQ的表达水平;应用survival选项分析360例样本中SFPQ表达与生存时间的 Kaplan Meier关系图。
1.6 SFPQ基因与增殖及细胞周期基因的相关性
从R2网站下载TCGA数据库中的371例HCC标本的基因芯片数据,比较SFPQ与增殖相关基因PCNA和Ki-67的相关性,以及与细胞周期相关基因CCNE1和CDK2的相关性。
1.7 细胞基因干扰
SFPQ的小干扰RNA(siRNA)、阴性对照siRNA由GenePharma公司设计、合成。特异性SFPQ-siRNA正义链:5'-GAC GAC AGG AAG AAU UAA GTT-3'。阴性对照siRNA正义链:5'-CCU ACG CCA CCA AUU UCG U-3'。HepG2及Hep3B细胞接种于10%FBS的DMEM培养基中,37 ℃、50 mL/L CO2培养箱中培养,至对数生长期用于实验。细胞铺于6孔板中,待细胞长 至70%密度时根据Lipofectamine 2000说明书转染等量的对照SFPQ和SFPQ siRNA,6 h后换成2% FBS 培养基,培养48 h后检测蛋白 SFPQ的表达。
1.8 细胞增殖与细胞周期的测定
1.8.1 细胞增殖测定 将HCC细胞以3000/100 μL的密度接种于96孔板,设3个分组(空白组、干扰组、对照组),每组设8个复孔。采用MTT法连续3 d检测各组细胞的光密度(D450)值。以D450值为纵坐标、时间为横坐标绘制细胞生长曲线图。
1.8.2 平板克隆形成实验法检测细胞增殖能力将对数生长期的转染后HepG2及Hep3B细胞用胰蛋白酶消化制备细胞悬液,调整细胞密度,接种到6孔板中,每组细胞接种3个孔,500个/孔,轻轻晃动6孔板使细胞分散均匀,于37 ℃、50 mL/L CO2培养箱中静置培养约10 d,出现肉眼可见的克隆,弃去培养液,PBS小心冲洗细胞2次,甲醛固定15 min,0.4%结晶紫染色10 min,流水缓慢洗去染色液,空气干燥,镜下计数>50个细胞的克隆数,并按公式计算克隆形成率:克隆形成率=(克隆数/接种细胞数)×100%。
1.8.3 流式细胞术分析细胞周期 用0.25%胰酶消化并收集转染后的细胞,用PBS洗涤细胞1次,2000r/min,5 min离心,弃上清,取细胞沉淀,加500 μL的700 mL/L乙醇固定细胞,室温放置3 h。PBS洗涤细胞,2000r/min,5 min离心,弃上清,每 管 加 100 μL的 RNaseA,37 ℃ 水 浴 30 min,再加入400 μL的PI染色混匀,4 ℃,避光放置30 min。上流式检测,记录激发波长488 nm处红色荧光,实验重复3次,进行统计学分析处理。
1.9 统计学处理
实验结果采用GraphPad Prism 6.0软件进行统计学处理。组间比较采用Dunnet-t检验;采用双侧性检验,P<0.05为差异有统计学意义。
2 结 果
2.1 SFPQ在人HCC组织中的表达变化
实时定量P C R结果显示,39例H C C组织中S F P Q的表达明显高于相应的癌旁组织[(8.302±0.740)vs.(7.833±0.782),P=0.0081],Western blot结果显示,6例HCC组织中SFPQ蛋白水平均明显高于相应的癌旁组织[(0.6±0.06)vs.(1.06±0.11),P=0.0224](图1A)。利用TCGA数据库检索到50例正常组织及371例HCC组织,SFPQ mRNA的表达丰度在正常肝组织明显低于HCC组织,GEO数据库检索到的数据集(GSE45436和GSE54236)显示,SFPQ在HCC组织中的mRNA水平亦明显高于正常肝组织(P=0.0064、0.0011)(图1B)。
2.2 SFPQ表达与临床分期、病理分级及生存率的关系
基于GEO和TCGA数据库分析SFPQ表达与HCC临床分期、病理分级、TNM分期以及患者预后的关系。结果显示:进展期HCC组织中SFPQ mRNA水平明显高于早期HCC组织(P<0.0001);SFPQ mRNA水平在高病理分级(G3+G4)HCC组织中表达水平明显高于低病理分级(G1+G2)HCC组织(P<0.0001);SFPQ mRNA水平在高TNM分期(III+IV)HCC组织中表达水平明显高于低TNM分期(I+II)HCC组织(P=0.0090);生存期分析显示,SFPQ低表达组患者的总生存时间明显高于SFPQ高表达组(P<0.0001)(图2)。
2.3 SFPQ基因与其他细胞增殖基因的相关性
下载TCGA数据库中371例HCC组织基因芯片数据,比较SFPQ 与增殖基因及细胞周期基因的相关性,结果显示:SFPQ与增殖基因PCNA和Ki-67及细胞周期相关基因CCNE1和CDK2的表达均具有强的正相关性(r=0.486、0.553、0.443、0.523,均P<0.05)(图3)。

图2 SFPQ表达与HCC患者临床分期、病理分级及生存率的关系Figure2 Relations of SFPQ expression with clinical stage, histopathological grade and survival rate of the HCC patients

图3 SFPQ表达与增殖基因及细胞周期蛋白的相关性分析Figure3 Correlation analysis of SFPQ expression with proliferation genes and cell cycle proteins
2.4 干扰效果验证
使用Lipofectamine 2000瞬时转染SFPQ siRNA至HepG2及Hep3B细胞中,转染48 h后采用Western blot验证了对照组与干扰组HepG2及Hep3B细胞中SFPQ蛋白的表达情况。结果显示,采用siRNA成功干扰了HepG2及Hep3B细胞中SFPQ的表达(图4)。

图4 Western blot检测siRNA转染后SFPQ的表达Figure4 Western blot analysis of SFPQ expressions after siRNA transfection
2.5 干扰SFPQ表达对HCC细胞增殖的影响
采用MTT法检测细胞生长曲线,结果显示,干扰SFPQ的表达后,随着时间的延长,与对照组相比,HepG2及Hep3B细胞的生长明显受到抑制,与对照组差异有统计学意义(均P<0.05)(图5)。
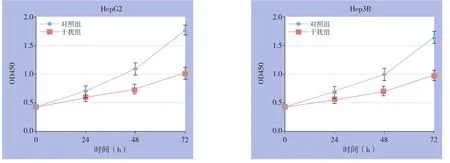
图5 细胞增殖曲线Figure5 Proliferation curves
2.6 平板克隆形成实验法检测细胞增殖能力
通过平板克隆形成实验法,并采用Image J软件扫描克隆点大小,重复3次,统计发现,转染siRNA组HepG2及Hep3B细胞克隆形成数与对照组相比明显减少,差异有统计学意义(t=14.22,P<0.01;t=10.92,P<0.01)(图6)。
2.7 流式细胞术检测细胞周期结果
转染siRNA组HepG2及Hep3B的G1期细胞比例增多、S期细胞比例减少,与对照组相比差异有统计学意义(均P<0.05)(图7)。

图6 平板克隆实验检测细胞增殖能力Figure6 Plate clone formation assay for cell proliferative ability
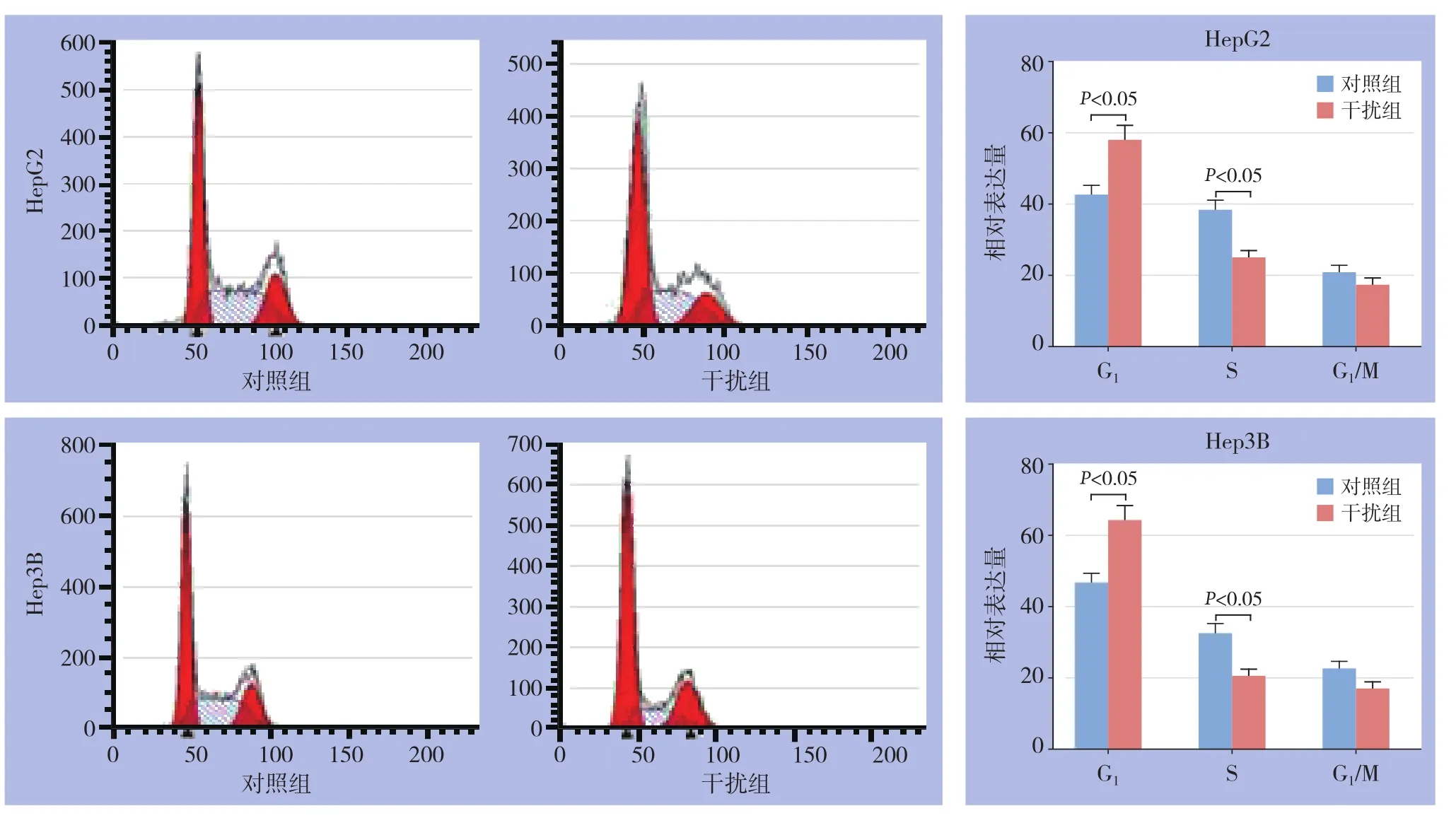
图7 流式细胞术检测细胞周期Figure7 Cell cycle analysis by flow cytometry
3 讨 论
SFPQ是一种分布广泛的核蛋白,存在DNA结合域和RNA 结合域[13]。其可与许多基因启动子的dsDNA相结合而影响基因的转录调节。同时,SFPQ可直接定位于受损DNA位点并与之结合,参与DNA修复,亦可与某些基因的长链非编码RNA(lncRNA)结合,参与肿瘤的形成及转移[14-17]。因此,近年来,SFPQ的研究越来越受到重视。有学者[18]应用蛋白组学技术比较了人恶性肿瘤细胞株(人肉瘤细胞株RD,U-2 OS和SK-UT-1B)、非恶性细胞株(人肾腺瘤细胞株A-498,769-P和OKP-GS)及两株前列腺癌细胞株(DU-145和PC-3)中SFPQ的表达,发现在所有恶性细胞株中,SFPQ均为高表达,但非恶性细胞中,均未见SFPQ的表达。此外,有研究[19]表明,SFPQ主要通过参与PPARγ的细胞增殖、肿瘤生长的信号通路影响细胞凋亡,从而调节结肠癌细胞的生长和存活。考虑到SFPQ在肿瘤细胞中似乎具有促进增殖的作用,且目前在HCC中SFPQ的表达以及细胞学影响等方面的研究较少,为此,本研究应用分子生物学技术及生物信息学初步探索了SFPQ与HCC的相关性。
本研究首先应用实时定量PCR法检测了39对HCC组织及癌旁组织的SFPQ mRNA水平,应用Western blot法检测了6对HCC组织及癌旁组织的SFPQ蛋白水平,发现在人HCC组织中的SFPQ基因表达明显高于癌旁组织,这与庄雄标等[20]的研究结果相符合。此外,本研究通过数据库调取了100余例HCC患者数据,通过统计学分析发现,SFPQ基因在HCC组织中均高于正常组织及肝硬化组织,与本研究的临床标本数据相符,提示HCC组织中存在SFPQ的高表达。为进一步研究SFPQ基因与HCC严重程度及预后的相关性,根据HCC的临床分期和组织病理学分级,应用TCGA数据库,分别比较了早期HCC和晚期HCC、(G1+G2)级和(G3+G4)级以及(I+II)期和(III+IV)期患者数据,同时进行了HCC组织中SFPQ mRNA的表达水平及患者生存率的相关性分析,结果提示,SFPQ基因表达与HCC的严重程度成正相关,与患者生存率负相关,提示SFPQ基因参与了HCC的形成及发展。
为明确SFPQ基因调控HCC的机制,我们选取增殖细胞核抗原PCNA及Ki-67,细胞周期蛋白CCNE1及CDK2,通过TCGA数据库调取HCC患者基因芯片数据,相关性分析显示SFPQ基因与PCNA、Ki-67,CCNE1及CDK2均具有正相关性,提示SFPQ基因可能通过调控细胞周期及增殖活性发挥促癌作用[21-24]。为此,本研究利用siRNA敲低HepG2及Hep3BHCC细胞SFPQ的表达,发现细胞增殖及有丝分裂均受到抑制,说明SFPQ基因可以通过调控细胞周期促进HCC细胞的生长,下一步需要更深入的探索SFPQ基因调控细胞周期及增殖的信号通路,为后期SFPQ基因的临床应用奠定基础。
综上所述,我们的研究发现,SFPQ基因可能通过促进HCC细胞的有丝分裂导致其增殖加快,促进HCC的发生发展,可能成为HCC的治疗靶点及预后指标。
(本文编辑 宋涛)
