ACE2基因多态性与2型糖尿病肾病的相关性
2019-03-09刘媛媛姜永玮曹永彤
刘媛媛,姜永玮,杨 辉,丛 笑,曹永彤
(1.中日友好临床医学研究所,北京 100029;2.中日友好医院 检验科,北京 100029)
据国际糖尿病联盟(IDF)统计,中国2017年糖尿病(diabetes mellitus,DM)的患病人数为1.14亿,到2045年将达到1.2亿[1]。糖尿病肾病(diabetic kidney disease,DKD)作为糖尿病最严重的慢性并发症之一,其患病率也逐年上升,男性的发病率高于女性[2]。ACE与ACE2表达失调被认为可能与DKD的发生发展相关。ACE2基因位于X染色体,相关的动物实验证实ACE2缺乏对不同性别的糖尿病小鼠模型会产生不同的影响,ACE2基因敲除的雄性小鼠可出现血管紧张素Ⅱ(AngⅡ)介导的肾小球损伤[3]。目前对于ACE2基因多态性的研究较少,本文旨在研究ACE2基因rs2285666多态与不同性别的2型糖尿病(T2DM)患者并发DKD的关系。
1 对象和方法
1.1 研究对象
选择2016年6月~2018年3月中日友好医院收治的T2DM患者,年龄在62.3±11岁。T2DM的诊断分型参照1999年世界卫生组织(WHO)修订的糖尿病诊断及分型标准,同时排除近期内用过肾毒性药物、妊娠、肿瘤、尿路感染、心力衰竭、活动性结核、精神病等疾病。根据2014年中华医学会糖尿病学分会(CDS)微血管并发症学组工作建议,将符合以下条件的纳入 DKD(+)组:(1)大量白蛋白尿 (诊断标准:ACR>300,3-6个月内复查,3次结果中至少2次查过临界值,并排除影响因素如24h内剧烈运动、感染、发热、明显高血糖);(2)糖尿病视网膜病变合并慢性肾脏病[慢性肾脏病诊断标准:GFR<60ml/(min·1.73m2),且至少满足1条肾脏受损标志:UACR≥30;尿沉渣异常;肾小管相关疾病;组织学异常;影像学所见结构异常;肾移植病史];(3)满足以上任1条并排除其他疾病引起的蛋白尿及肾功能不全:出现肾损伤但不伴糖尿病视网膜病变;蛋白尿急剧增多或肾病综合征;顽固性高血压;出现尿活动性沉渣等。符合以下条件的纳入DKD(-)组:满足T2DM病程≥10年,且 UACR<30。
以上全部研究对象均来自中国汉族人群,且无血缘关系。本研究通过本院伦理委员会批准(批号:2016-59),所有研究对象均签署临床研究知情同意书,入选575例研究对象,排除32例(包括符合以上排除标准者28例,失访者4例),共计纳入543例:其中 DKD(+)组 271例,包括男性 145例和女性 126例;DKD(-)组 272例,包括男性134例和女性138例。
1.2 研究方法
1.2.1 临床及生化指标
通过查询病历系统收集患者年龄、性别、身高、体重、体质指数(BMI)、血压、吸烟史及视网膜病变史等临床资料。检索检验科数据库收集患者外周血总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、血肌酐(Scr)、肾小球滤过率(eGFR)、内生肌酐清除率(Ccr)、尿素(Urea)以及尿 UACR 等检测结果。 以上生化项目由Beckman Coulter AU5800全自动生化分析仪(美国贝克曼库尔特公司)进行检测。
1.2.2 引物设计及合成
采集患者空腹外周静脉血1ml,应用全血基因组DNA快速提取试剂盒(广州美基生物科技有限公司)提取基因组DNA。根据genbank上ACE2的基因序列,采用引物设计软件primer5设计引物, 上游引物 F:5’-TACAATGAGCACCATCTACAGT-3’,下游引物 R:5’-TACAATGAGCACCATCTACAGT-3’。由北京擎科生物公司合成。
1.2.3 PCR-HRM
仪器采用Roche Light Cycler 480实时荧光定量PCR仪 (瑞士罗氏公司);试剂采用Light CyclerR480 High Resolution Melting Master,Version 07(德国罗氏公司)。优化反应条件确定反应体系:总体积为 20μl,包含 Master Mix(2×)10μl,MgCl2(25 mmol/L)2μl,上、下游引物(10μmol/L)各 0.5μl,DNA 模板(10ng/μl)5μl,灭菌超纯水 2μl补足体系。在Light CyclerR480实时荧光定量PCR仪上设置PCR-HRM反应程序如下:①95℃预变性10min。②40个循环的荧光定量Touchdown PCR 程序如下:95℃变性 10s,60℃退火 15s,72℃延伸15s,每次延伸完成后获取1次荧光信号。③HRM程序如下:95℃变性1min,40℃退火1min,65℃~97℃上升 0.02℃/s,每上升 1℃获取 25个信号,获得溶解曲线。④40℃冷却30s完成实验。
1.2.4 目的基因测序分析
①PCR扩增:PCR体系为50 μl,其中包括反应混合物Mix(包含Taq DNA聚合酶、dNTPs、Mgcl2、反应缓冲液)25μl,引物混合物 4 l,DNA 样本8μl,灭菌超纯水补足体系。采用TC-C1000 Touch热循环仪(美国Bio-Rad公司)进行扩增,热循环参数为:预变性95℃ 2min;再按下列程序循环30次,即 95℃变性 30s,60℃退火 30s,72℃延伸 30s;末次循环后,72℃延伸5min。扩增产物送北京擎科生物公司进行测序。②序列比对:将获得的基因序列在PubMed网站的BLAST中进行序列比对,结合HRM结果做出最终判断,以此作为阳性对照进行分型。

表1 DKD(-)组与 DKD(+)组临床资料比较
1.3 统计学方法
研究数据采用SPSS17.0软件进行分析。DKD(+)组和 DKD(-)组 ACE 基因 rs2285666 多态性基因型分布,采用Hardy-Weinberg遗传平衡检验,采用直接计数法计算各组ACE基因rs2285666多态性的基因型和等位基因频率,计数资料组间比较采用χ2检验。对于符合正态分布的计量资料组间比较采用独立样本t检验;非正态分布的计量资料组间比较采用Mann-Whiteney U检验。各组不同基因型受试者的计量资料比较,采用单因素方差分析。多因素分析采用非条件Logisitic回归分析。
2 结果
2.1 受试者相关临床资料比较
DKD(+)组与 DKD(-)组及 2 种基因型的一般临床资料见表1,2组男性患者临床资料比较,年龄、BMI DBP、TC、TG、HDL-C、LDL-C、HCY 差异均无统计学意义(P>0.05)。 DKD(+)组病程、吸烟比例、SBP、HbA1c、Scr水平高于 DKD (-) 组,eGFR、Ccr低于 DKD(-)组,差异均有统计学意义(P<0.05)。女性患者中,病程、吸烟比例、SBP、HbA1c、Scr、HCY 高于 DKD (-) 组,eGFR 低于DKD(-)组,差异均有统计学意义(P<0.05),其余资料差异无统计学意义(P>0.05)。
2.2 2组受试者ACE基因rs2285666多态性基因型及等位基因频率比较
本研究女性受试者的ACE2基因rs2285666多态性分布,均符合Hardy-Weinberg遗传平衡定律 (P>0.05)。DNA样品经HRM分析结果见图1(封三)。抽样测序分析结果见图2(封三)。2种方法分型结果保持一致。2组受试者等位基因频率的比较见表2。男性患者中,DKD(+)组G基因频率显著高于 DKD (-) 组 (53.1%比 37.3%,P<0.01)。 女性患者中,DKD(+)组 GG基因型高于DKD(-)组(28.6%比 15.9%,P<0.05)。
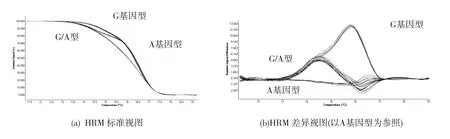
图1 DNA样品HRM分析结果
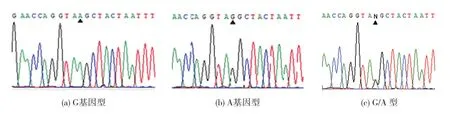
图2 ACE2 G8790A测序分析结果
2.3 rs2285666基因分型和DKD的相关性
使用2种统计模型,分别是未校正和校正了病程、 吸烟、SBP、HbA1c、Ccr、eGFR 和 HCY 的影响。表3示,ACE2 G8790A变异增加了DKD风险,其中女性患者在加性遗传模型在DKD(+)和DKD(-)组中的差异有统计学意义(校正后OR=1.56,95%CI=1.03~2.37,P<0.05)。相对于 AA 和GA基因型,GG基因型在加性遗传模型中均显著提升了DKD的患病风险(P<0.05)。而男性患者中携带G等位基因进展为DKD的风险显著高于A等位基因(校正后 OR=1.97,95%CI=1.15~3.37,P<0.05)。
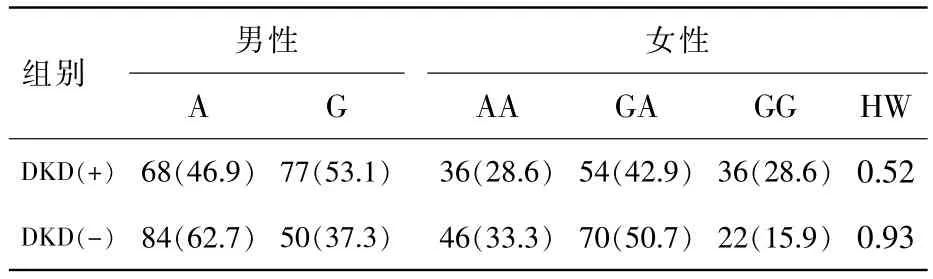
表2 DKD(+)组和 DKD(-)组患者ACE基因型和等位基因频率比较 n(%)
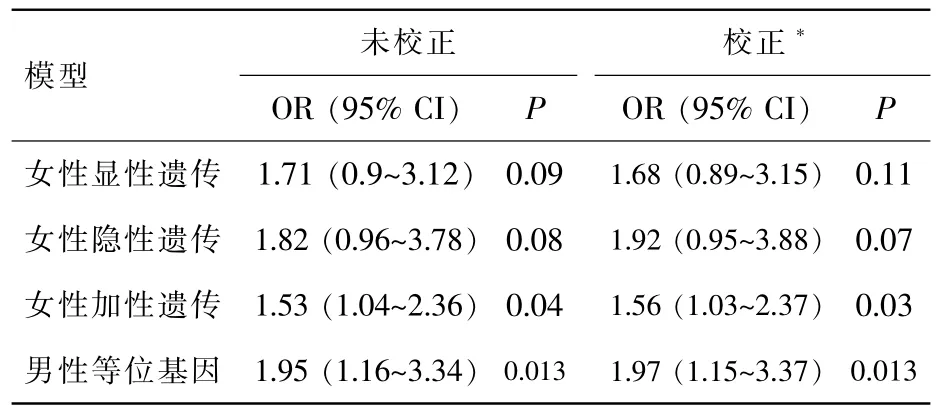
表3 T2DM并发DKD相关因素的Logistic回归分析
3 讨论
DKD是T2DM最主要、最严重的微血管并发症之一,在发达国家30%~40%的糖尿病患者并发DKD,是导致终末期肾脏病(end stage renal disease,ESRD)的首要原因[4]。 在中国,T2DM 并发DKD是导致ESRD的第二位病因(16.4%)[5]。DKD的发病机制尚未明确,主要认为是遗传因素与环境因素共同作用的结果。肾素-血管紧张素系统(renin-angiotensin system,RAS)被认为可以通过改变肾脏血流动力学、参与氧化应激等多种途径参与DKD的发生与进展,相关研究表明DKD患者的肾脏RAS的代偿水平存在性别差异[6]。血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)是近年来发现的RAS系统的新成员,是2000年由Donoghue等[7]从心衰患者心室组织的cDNA文库中克隆出一种新的ACE同源物。ACE2基因定位于Xp22,包含18个外显子,该基因的突变可能通过影响性激素而间接影响RAS的表达,从而引起不同性别的DM患者进展为DKD的风险存在差异。Clotet等[8]的实验表明ACE2基因敲除的雄性小鼠可出现肾ACE水平和活性增高,而雌性小鼠无差异。ACE2可对抗ACE与AngⅡ,促进Ang-(1-7)的生成,发挥舒张血管、抗组织纤维化、抗增殖和利尿等作用。在肾脏,局部内皮细胞和肾小管上皮细胞ACE2活性增高,可调节肾血流分布、水电解质的平衡,从而在维持血压稳定的同时保护肾功能。
既往通过对ACE2基因测序检出G8790A(rs2285666)多态位点,即第3个内含子第4个碱基存在G—A突变,该位点的变异可以改变mRNA的剪接,可能对基因的功能产生影响,因此可能与疾病遗传易感性有关,已有的研究表明该位点多态性与高血压伴心功能不全有关。目前国内外对于ACE2基因rs2285666多态性与DKD的关系的研究较少,且结果并不一致,可能与种族差异、研究方法不同有关。既往有关ACE2基因G8790A多态性的研究,多采用PCR-RFLP技术,技术操作繁琐,易造成污染出现假阳性,且结果可能出现拖带影响判读,影响结果的准确性,故有待于进一步改进。本研究采用目前检测SNP较为新型的HRM法,同时随机抽取30例样本进行测序验证,两种方法的检测结果保持一致,表明应用HRM技术检测ACE2基因G8790A多态性是可行的。HRM技术的原理是在PCR扩增前在体系中加入饱和荧光染料,该荧光染料可嵌入至双链DNA间,在激发光的作用下散发荧光,而该染料不与单链DNA结合,在激发光的作用下不发出荧光。随着温度逐渐上升,DNA双链渐打开,荧光强度渐减弱。不同样本的DNA双链因GC含量不同,排列顺序不同,因而呈现出不同的熔解曲线。由于ACE2基因的第3个内含子第4个碱基存在G-A突变,GC间氢键断裂所需的能量与AT间氢键断裂所需的能量不同,因此呈现出不同的熔解曲线。HRM技术的优点在于PCR扩增完成后只需运行一个升温程序即可完成检测,且结果准确、成本较低、操作简便、可以达到闭管操作从而避免污染,因此是一种快速、准确检测ACE2基因G8790A基因多态性的优选方法。
Frojdo等[9]用PCR-RFLP法分析了芬兰地区823例糖尿病患者ACE2基因G8790A多态性与DKD的关系,其中包括365例DKD和458例非DKD患者,结果表明DKD组与非DKD组的基因分布无明显差异,该位点突变与DKD无关。马增霞等[10]采用PCR-RFLP法的研究认为DKD组男性患者A基因频率(59.6%)明显升高,G基因频率(40.4%)显著降低(P<0.05)。携带 A 等位基因的T2DM男性患者更易发生DKD,G等位基因则为保护性基因。本研究应用HRM法对2型糖尿病合并DKD患者271例及2型糖尿病不伴DKD患者272例进行了ACE2基因rs2285666多态的分析,观察到男性患者中G等位基因的频率在DKD患者中明显升高(P=0.008)。在校正了病程、吸烟 、SBP、HbA1c、Ccr、eGFR 和 HCY 等的 影响后,发现在女性患者加性遗传模型中,G等位基因在两组间的差异有统计学意义(P=0.03),GG基因型在加性遗传模型中显著提升了DKD的患病风险(P<0.05)。 该结果与 Li等[11]的研究结果保持一致。在男性患者中,DKD(+)组携带G基因频率显著高于 DKD(-)组(校正后 P=0.013),因此,G 基因是男性DKD发病的独立危险因素。本研究对2型糖尿病合并DKD患者271例及2型糖尿病病程≥10年且不伴DKD患者272例进行了ACE2基因rs2285666多态性的研究,具有比较好的统计学效力,但仍有一定局限性。本研究是在汉族2型糖尿病患者中进行的,结果是否可以推广到其他民族,还需要进一步的调查。本研究为病例对照研究,还需要开展大样本前瞻性研究,并进一步检测不同基因型的酶表达水平来验证rs2285666基因型与DKD的关系。
DKD发病机制尚未完全阐明,本研究提示遗传因素在2型糖尿病患者DKD的发病中具有一定的作用,对于ACE2基因 rs2285666多态性的研究有可能为DKD的基因诊断及治疗提供依据,本研究同时为该多态性的研究提供了新的方法,只有明确遗传易感个体,尽早进行相关的干预治疗,才能控制和延缓DKD进展、改善患者的生活质量及减轻社会的的经济负担,ACE2基因rs2285666多态性与DKD的关系还需要进一步开展大样本前瞻性研究加以验证。
