农产品中手性农药对映体残留色谱法分析研究进展
2019-03-08张新忠黎洪霞王新茹罗逢健程有普陈宗懋
崔 璇,钟 青,张新忠*,黎洪霞,王新茹,罗逢健,程有普,陈宗懋*
(1.中国农业科学院 茶叶研究所 农产品质量安全研究中心,浙江 杭州 310008;2.天津农学院 园艺园林学院,天津 300384)
手性(Chirality),指左手与右手的差异特征,呈镜像对称却不能重合的性质。手性分子是指化合物基团组成相同但空间结构上互为镜像,二者互为对映异构体,简称对映体,分为S左旋体和R右旋体[1]。根据农药分子结构中是否具有手性中心,可将其分为手性农药和非手性农药[2]。手性农药一般是指化合物分子中的某个碳原子上连接有4个不同基团,该碳原子被称为不对称碳或手性碳中心,也有以磷或其它原子为手性中心的分子,一般多为有机磷类农药等。笔者根据农药大全丛书[3-6]不完全统计,常见50余种有机磷类农药中具有手性结构的有26种,约占总数的52%;20余种有机氯类农药具有手性结构的有11种,约占55%;50余种拟除虫菊酯类农药具有手性结构的有21种,约占42%;而三唑类农药有50余种,大部分具有手性。
农作物在生长过程中,由于环境、气候等因素的影响,病虫草害时有发生,喷施化学农药是现有最主要最有效的防治手段,但在达到防治目的的同时,也导致农产品中或多或少的农药残留。目前,世界上有至少40%常用农药具有手性结构[7],大部分以外消旋体形式出售使用,单一异构体仅占7%[8]。如我国茶园上登记允许使用的60多种农药有效成分中近2/3是具有手性结构的化合物,而绝大多数都是以外消旋体形式在使用。因此,导致在农产品和环境中大量手性农药外消旋体残留。手性农药在处于具有手性特性的环境中时,对映体表现为不同的环境行为和生物学效应影响[9]。尤其对于生物体而言,其自身就是一个内在的手性环境,生物体的组成单元如蛋白质、核酸和糖类物质等,以及生物体内进行新陈代谢具有专一性催化能力的酶、起调节作用的激素大部分也具有手性[10]。因而,手性农药对映体在生物体中的毒理作用、残留状况及其代谢转化归趋往往不同。随着人们对手性农药对映体认识越来越深刻,关于手性农药残留降解的研究逐渐增多,而要进一步深入研究手性农药对映体的残留行为特征,首先要建立对映体在不同农产品基质中的残留分析方法,因此手性农药对映体分离和残留分析越来越引起研究者的重视。
本文在对近10年来关于手性农药对映体残留分析的文献检索的基础上,从气相色谱法(GC)、毛细管电泳法(CE)、液相色谱法(LC)以及合相色谱法(CC)等不同色谱技术在手性农药对映体残留分析中的应用出发,对其在农产品中相关应用进行归纳、综述并展望,为后续开展农产品中手性农药对映体的深入研究提供借鉴。
1 气相色谱法在农产品中手性农药对映体残留分析中的应用
气相色谱法(Gas chromatography,GC),是手性拆分中较早使用的色谱法之一,以气体为流动相,利用样品中各组分在色谱柱固定相中的吸附力或溶解度不同,以及各组分在色谱柱中气相和固定相中的分配系数不同来实现分离[11]。根据待测物不同,需选择适合的检测器。
1.1 气相色谱/火焰光度检测法与电子捕获检测法
有机氯农药因持久性强,部分被列为POPs持久性污染物,是手性农药残留分析领域中最早研究的种类之一。虽然目前大部分有机氯农药已被禁用多年,但在环境样品中仍可监测到残留,而在农产品领域,近十多年来未见采用气相色谱/电子捕获检测法(GC/ECD)进行手性农药对映体残留的研究报道。
在有机磷农药手性对映体残留研究上,潘蓉等[12-13]利用BGB-176柱分离、气相色谱/火焰光度检测法(GC/FPD)研究了乙酰甲胺磷和甲胺磷对映体在茶叶中的残留,结果发现:(+)-甲胺磷和(+)-乙酰甲胺磷相对各自对映体先流出,在茶叶鲜叶上(+)-乙酰甲胺磷比(-)-乙酰甲胺磷降解快,存在立体选择性行为更易产生(+)-甲胺磷;红茶加工对乙酰甲胺磷的降解作用显著高于绿茶,但仅在干燥过程中表现出明显的立体选择性消解,(+)-乙酰甲胺磷对映体较(-)-乙酰甲胺磷更易发生消解。
拟除虫菊酯类农药是近年来使用最广泛的一类杀虫剂,具有手性中心多、对映体多的特点,其对映体分离和选择性残留研究难度更大,但随着手性分离技术的提高,相关研究逐渐增多。如Liu等[14-15]早期选择BGB-172柱采用GC/ECD对这类农药的手性分离方法、对映体在环境样品中的选择性行为进行了深入研究;Kuang等[16]利用GC/ECD分析了茶叶中的氯氰菊酯和顺式-联苯菊酯对映体残留,发现茶叶样品中顺式-联苯菊酯对映体(+)-体和(-)-体之间不存在差异,而不同茶类中氯氰菊酯残留对映体的EF值存在差异。
虽然气相色谱专一性检测器(ECD或FPD等)对特征化合物灵敏度高,但容易被样品基质干扰,尤其有机磷类农药基质效应明显,单纯依靠保留时间定性,易产生假阳性结果。气相色谱-质谱法(GC-MS)利用化合物的色谱保留时间和质谱图信息双重定性,以特征离子定量,使定性、定量结果更准确[17]。因此,近年来气相色谱-质谱法在农药残留分析方面的应用越来越多。
1.2 气相色谱-质谱法与气相色谱-串联质谱法
气相色谱-质谱联用,在样品经色谱分离后进行电离,通过质谱测定化合物离子质荷比进行分析,具有高效、准确、灵敏度高、选择性好的优点。Lee等[18]利用γ-DEX-120柱分离,GC-MS法研究了手性(反式-氯丹(TC)和顺式-氯丹(CC))和非手性(反式-九氯(TN))氯丹通过空气-叶和土壤-根途径被西葫芦吸收及其体内的迁移规律,发现氯丹在空气-叶的过程中无对映体选择性,而叶-茎干的过程中主要有TC、CC,土壤-根中主要有TN,茎干-叶中主要有TC及TN,表现出差异性;Li等[19]采用BGB-172柱分离,GC-MS/MS测定,建立了蔬菜(黄瓜、番茄)、水果(苹果、梨)和谷物(小麦、大米)中硅氟唑对映体残留分析方法,(+)-硅氟唑和(-)-硅氟唑保留时间分别为13.09 min和13.65 min,方法回收率高于86%,检出限(LOD)低于0.9 μg/kg;Wang等[20]选用BGB-176 SE柱分离,建立了卷心菜、小白菜中乙酰甲胺磷及其代谢物甲胺磷残留的GC-MS/MS分析方法,(+)-甲胺磷、(-)-甲胺磷、(+)-乙酰甲胺磷和(-)-乙酰甲胺磷保留时间分别为12.76、12.87、14.84和14.93 min,回收率为71.9%~81.4%,相对标准偏差(RSD)小于8.8%,乙酰甲胺磷及甲胺磷对映体的LOD分别为0.008 mg/kg和0.005 mg/kg;同年,该课题组还利用GC-MS/MS研究发现乙酰甲胺磷及甲胺磷在未灭菌土壤中表现出对映体选择性降解[21]。
多氯联苯(PCB)对映体多,对其分析可为手性农药对映体残留分析提供借鉴。戴守辉等[22]采用Chirasil-Dex和BGB-172柱分离,建立了莲藕、荷叶、荷茎中6种多氯联苯(PCB 91、95、136、149、176和183)对映体的GC-MS分析方法,该法以正己烷-丙酮加速溶剂辅助提取样品,硫酸磺化后结合Florisil-SPE柱净化。结果显示:Chirasil-Dex柱能较好分离PCB 95、91、136、149和176对映体,BGB-172能较好分离PCB 183对映体。尽管ECD灵敏度高,但GC-MS采用选择离子扫描能有效排除含氯或含硫物质的干扰,减少净化步骤,显著缩短分离时间,污染区莲藕、荷茎和荷叶中PCB 95-1、PCB 91-2和(+)-PCB 136含量均高于其对映体PCB 95-2、PCB 91-1和(-)-PCB 136含量,而PCB 149、176和183的两个对映体之间均无显著差异。
目前,国外GC-MS研究手性农药残留主要集中在土壤和水基质,为农产品中的分析带来一定的借鉴。如Ignaz等[23-24]发现在碱性土壤中氟丁酰草胺对映体的降解表现出选择性,(-)-对映体降解较慢;Thomas等[25]利用自制Permethyl-β-cyclodextrin手性柱结合GC-MS分离测定,发现在未灭菌土壤中S-氟吡甲禾灵迅速转化为R-氟吡甲禾灵,而在灭菌土壤中无此现象。
气相色谱-质谱法虽然具有应用领域广、灵敏度高等优点,但其对于高沸点、难挥发、强极性化合物的分析存在局限性。因此毛细管电泳法、液相色谱法等被逐渐开发用于手性农药对映体残留分析。
2 毛细管电泳法在农产品中手性农药对映体残留分析中的应用
毛细管电泳(Capillary electrophoresis,CE)是一类以毛细管为分离通道、高压直流电场驱动的液相分离技术[26]。毛细管电色谱(Capillary electrochromatography,CEC)是CE与液相色谱(LC)相结合的高效、快速微分离分析技术,其利用缓冲溶液的电渗流作为泵流动相,使被分析分子通过对其具有不同保留程度的第二相达到分离[27],在手性对映体分析方面也得到了一定的发展。
Schneider等[28]以γ-环糊精(γ-CD)为手性选择剂结合毛细管区带电泳(CZE)分离测定了异丙甲草胺的2种极性代谢产物(ESA和OXA)的立体异构体,发现当CZE电解质由含有20%甲醇和2.5%γ-CD的硼酸盐缓冲液组成时背景最佳,15 ℃的毛细管温度和30 kV的电压下能实现ESA和OXA对映体的最大分离;李佳等[29]采用P/ACETM MDQ高效毛细管电泳仪,配备PDA检测器,在234 nm波长下以含15 976 mg/L DM-β-CD的5 332.0 mg/L乙酸钠缓冲液(pH 5.8)为电解液,利用CE实现了精喹禾灵与其S-对映体的手性分离,分离度达2.7,两者的RSD分别为1.4%和2.3%,S-对映体的LOD为11.9 mg/L。张宏福等[30]利用CE建立了黄瓜、梨、苹果和西红柿中粉唑醇对映体残留量的测定方法,结果表明,粉唑醇对映体1和2在1.3~250 μg/mL范围线性良好,在4种样品基质中的回收率依次为94.6%、95.2%、94.7%、95.8%和97.8%、98.3%、98.6%、94.5%。
国内外有关CE和CEC在手性农药残留方面的研究较多集中于土壤[31-33]、水[34]样品,涉及甲霜灵[31-32,34]、灭草喹、地虫磷、育畜磷、敌敌畏[31-32]、抑霉唑[33]、烯唑醇、苯霜灵、己唑醇、腈菌唑、戊唑醇、烯效唑和粉唑醇[34]等,各种手性农药对映体均得到了较好地分离,亦可为农产品中这些手性农药对映体残留研究提供思路。但在CE分析中,决定分离的主要因素是化合物的分子状态和缓冲液的离子强度,因此常在流动相中加入不同种类或浓度的缓冲盐及环糊精等改性剂,而正是由于改性剂中难挥发性盐的存在,造成CE在残留检测时灵敏度不高,难以与质谱仪联用,致使其应用范围较窄。
3 液相色谱法在农产品中手性农药对映体残留分析中的应用
液相色谱是以液体为流动相,不同类型填料为固定相,利用化合物在固液之间的吸附交换分配实现分离的技术。根据固定相或流动相的不同,可分为正相液相色谱法和反相液相色谱,前者流动相多为正己烷、异丙醇等,后者则多以甲醇与水、乙腈与水等为流动相。也可因其检测器不同分为液相色谱/紫外法(LC/UV)、液相色谱-质谱法(LC-MS)等,分析时根据不同化合物的性质,选择不同的色谱类型和检测器。
3.1 液相色谱/紫外检测法
紫外检测器是基于溶质分子吸收紫外光原理设计的光谱型检测器,当待分析物在溶液状态下存在紫外吸收,且吸收值与物质的量之间具有较好的线性关系时,可采用紫外检测法。早期由于色谱柱填料技术的局限,多采用正相色谱分析,同时大多数有机磷、有机氯和拟除虫菊酯类农药都有紫外特征吸收,因此液相色谱/紫外检测法(LC/UV)是早期手性农药对映体研究最具实用性的方法之一。
Cheng等[35]以正己烷-乙醇(95∶5)为流动相,Chiralcel OD-H柱分离,在220 nm波长下,LC/UV法测定葡萄等样品中丙环唑对映体,4个立体异构体的平均回收率为89.6%~99.8%,RSD为1.6%~9.5%,LOD均小于0.02 mg/kg,LOQ不超过0.05 mg/kg;曹佳[36]采用Chiralcel OD-H柱,正己烷-异丙醇(75∶25)为流动相,利用LC/UV建立了水稻植株、糙米、稻壳和田泥中茚虫威对映体残留分析方法,并发现茚虫威对映体在水稻植株上选择性降解差异明显,对映体1先于对映体2降解;王美云[37]采用Lux Cellulose-2柱以乙腈-0.1%甲酸水溶液(40∶60)为流动相,反相LC/UV研究了温室、露地条件下菠菜、青菜、黄瓜和甘蓝中甲霜灵对映体的降解,结果发现温室黄瓜中R-(-)-甲霜灵半衰期(2.9 d)短于S体(4.3 d),露地甘蓝中甲霜灵对映体降解无明显差异,而温室和露地条件下菠菜和青菜中均为S-(+)-甲霜灵先降解。
紫外检测器常只能采用一或两个波长测定,当多种化合物最大吸收波长不一致时,同时测定存在很大局限,无法对所有化合物得到最佳的灵敏度,而二极管阵列检测器(DAD或PDA)可进行全波长扫描,通过数据后处理针对不同化合物选择不同的波长提取色谱峰进行定量,或同时选多个波长针对不同化合物进行扫描检测,极大地提高了效率和灵敏度。因此,在手性农药残留分析和降解规律研究方面,LC/PDA应用逐渐增多。如Cheng等[38]选择Chiralpak AS-H柱,以正己烷-乙醇(95∶5)为流动相,利用LC/PDA建立了黄瓜、番茄、苹果、梨和土壤中茚虫威对映体残留的分析方法,方法回收率为87.0%~117%,RSD小于10%,定量下限(LOQ)为0.05 mg/kg;Liu等[39]选择Whelk-01柱,以正己烷-异丙醇(95∶5)为流动相,采用LC/PDA研究发现在大白菜中氟虫腈对映体的R-体降解比S-体快,导致S-体残留富集;Marucchini等[40]利用正相LC/PDA测定发现向日葵植株中S-(+)-甲霜灵降解比R-(-)-甲霜灵快,而土壤中则相反;Wang等[41]利用正相LC/PDA研究发现黄瓜中S-(+)-苯霜灵降解比R-(-)-甲霜灵快,而土壤中R-(-)-苯霜灵降解更快;Gu等[42-43]利用LC/PDA研究发现油菜和大白菜上禾草灵S-体降解速率比R-体快,其手性降解产物禾草灵酸S-体生成和降解速率均高于R-体,在土壤中则相反;Dong等[44]选择Chiralcel OJ-H柱,正相LC/PDA分析,发现灌根处理时番茄果实中苯醚甲环唑对映体(2R,4S)-体和(2R,4R)-体降解快,导致番茄中(2S,4R)-体和(2S,4S)-体的富集,而叶面喷药处理时,黄瓜果实中(2R,4S)-体和(2S,4S)-体优先消解,而在番茄和黄瓜植株中均为(2S,4S)-体和(2R,4R)-体优先降解;Sun等[45]利用Lux Cellulose-1柱采用正相LC/PDA研究发现在北京白菜中(-)-茚虫威优先降解,而在安徽白菜中(+)-茚虫威优先降解,两地土壤中均为(+)-茚虫威优先降解;陈秀[46]选用Chromega Chiral CCA柱在正相条件下建立了呋虫胺对映体LC/PDA分析方法,并确定了对映体构型的流出顺序,在黄瓜和土壤中均为(-)-呋虫胺优先降解,呋虫胺两个对映体在土壤中的降解半衰期比在黄瓜中长,黄瓜灌根处理的降解半衰期比叶面喷施长;Sun等[47]采用HPLC/PDA研究发现有机磷类手性农药马拉硫磷对映体在白菜和油菜中S-(-)-马拉硫磷先降解,而甜菜中R-(+)-马拉硫磷先降解,在水稻和小麦中没有立体选择性;Cao等[48-49]选用Chiralpak AS-H柱,利用正相条件下LC/PDA研究发现三唑醇对映体在黄瓜果实上RS-体降解快于SR-体,SS-体降解快于RR-体,导致SR-体和RR-体富集,而在黄瓜不同组织器官中,三唑醇对映体在黄瓜根和茎上选择性降解慢,而在黄瓜叶片和果实中降解较快,叶片是积累和立体选择性降解的主要部位;Gu等[50]选用Lux Cellulose-2柱,正相LC/PDA测定发现葡萄中S-苯霜灵降解比R-苯霜灵慢,而在烟草、甜菜、番茄和辣椒中S-体比R-体降解快。
早期由于液相色谱固定相填料多采用硅胶颗粒外表涂覆改性材料等,随着使用时间的增长,柱流失严重,尤其不适合以水为流动相的反相液相色谱。随着技术的发展,键合型固定相的出现,反相液相色谱在手性农药残留领域应用越来越多。如曹志刚等[51]采用乙腈提取,氨基固相萃取柱净化,自制单脲基衍生化β-环糊精键合有序介孔SBA-15手性固定相柱(UCDP),以甲醇-水(40∶60)为流动相,测定建立了HPLC/PDA测定梨中烯唑醇对映体残留分析的方法;廖玉芹等[52]采用自制邻苯二甲酰亚胺-β-环糊精手性固定相(PCDP)色谱柱,成功实现了己唑醇、粉唑醇、灭菌唑和烯唑醇对映体拆分,采用Fe3O4磁性粒子QuChERS方法净化,HPLC/PDA分析建立了黄瓜中灭菌唑对映体残留分析方法,灭菌唑对映体保留时间分别为23.3 min和26.1 min,平均回收率分别为92.5%和93.2%,RSD不超过1.3%,LOD均小于20 μg/kg。王雪松[53]选择Lux 5u Amylose-2柱,采用反相HPLC/PDA分析,发现甘蓝中(+)-S-戊唑醇半衰期为7.81 d,比(-)-R-戊唑醇的10.50 d快,黄瓜中(+)-S-戊唑醇半衰期为1.68 d,比(-)-R-戊唑醇的0.93 d慢;王美云[37]选择Lux Cellulose-2柱,采用反相HPLC/PDA研究发现葡萄和番茄中S-(+)-甲霜灵均先降解(番茄中S-体和R-体半衰期分别为2.2 d和3.0 d,葡萄中分别为5.5 d和6.9 d),而水稻植株中则是R-(-)-甲霜灵先降解(S-体和R-体半衰期分别为2.3 d和2.8 d);孙明婧[54]选用CDMPC柱,分别以乙腈-水(55∶45)和正己烷-异丙醇(80∶20)为流动相,采用HPLC/PDA研究发现番茄和油菜中多效唑R-体比S-体降解快,苹果中戊唑醇R-体比S-体降解快。
3.2 液相色谱-串联质谱法
液相色谱的高分离性能和质谱的高定性能力相结合[55],以及二级质谱进一步去除干扰的功能,使液相色谱-串联质谱(LC-MS/MS)逐渐成为手性农药多残留分析的主要研究手段。如章虎等[56]选择Lux Cellulose-2柱,以甲醇-水(60∶40)为流动相,反相LC-MS/MS测定建立了稻米中乙虫腈对映体残留分析方法,方法LOD和LOQ分别为0.001 mg/kg和0.003 mg/kg;Li等[57]选择Chiralcel OD-RH柱反相分离,LC-MS/MS研究发现在番茄、黄瓜两种蔬菜中甲霜灵均是(-)-R-体先降解,从而导致农产品中(+)-S-体残留富集;Rimkus等[58]选择Chiralpak AGP柱,梯度洗脱,采用LC-MS/MS测定了不同地区40个蜂蜜样品中氯霉素(CAP)对映体及其代谢产物残留,氯霉素4个立体异构体保留时间分别为3.65、4.84、6.00、10.95 min,方法的LOQ为0.08~0.12 μg/kg,9个蜂蜜样品中检出RR-CAP残留,其余31个主要来自乌克兰和东欧的蜂蜜样品中检出SS-CAP残留;王欢庆等[59-60]选择Chiralpak AD -RH柱,反相LC-MS/MS测定建立了番茄、葡萄、黄瓜和水中茚虫威对映体残留的分析方法,研究其在黄瓜和番茄上的残留降解行为,发现(+)-S-茚虫威在黄瓜和番茄中的半衰期分别为3.0、5.9 d,(-)-R-茚虫威分别为7.3、12.2 d,表明(+)-S-茚虫威在黄瓜和番茄中均先降解且在黄瓜中降解更快;Zhang等[61]选择Chiralpak IC柱分离,反相LC-MS/MS研究发现3种绿茶中均为(+)-S-茚虫威比(-)-R-茚虫威降解快,造成绿茶中后者的残留富集。
三唑类杀菌剂是目前世界上应用最广泛的杀菌剂,在我国使用量约占国内杀菌剂总量的15%,且近年来呈显著增加趋势[62],而三唑类杀菌剂很多具有手性结构,对映体间毒性差异明显。因此,近年来有关三唑类手性农药在农产品中的残留分析越来越多,大多利用LC-MS/MS分析。如王雪松[53]选择Lux 3u Amylose-2柱,反相LC-MS/MS分析戊唑醇对映体在黄瓜、甘蓝中的残留降解动态,发现黄瓜中(-)-R-戊唑醇的降解快于(+)-S-戊唑醇,半衰期分别为0.93 d和1.68 d,而甘蓝中(+)-S-戊唑醇的降解比(-)-R-戊唑醇快,半衰期分别为7.81 d和10.50 d,与LC/UV方法相比,LC-MS/MS灵敏度提高10倍左右;Li等[63]选择Lux 3u Amylose-2柱,采用LC-MS/MS建立了番茄、黄瓜、梨和苹果等样品中戊唑醇对映体残留的分析方法,方法回收率为89.6%~102%,日内和日间RSD分别为3.3%~10.2%和5.1%~7.7%,LOD小于0.6 μg/kg,LOQ不超过2.0 μg/kg;叶小兰[64]同样选择Lux 3u Amylose-2柱,利用LC-MS/MS研究发现三地麦粒中(-)-戊唑醇的残留量高于(+)-戊唑醇,在北京、浙江两地麦秆中(-)-戊唑醇比(+)-戊唑醇降解快,而在湖南麦秆中(+)-戊唑醇比(-)-戊唑醇降解快;Wang等[65]选用Lux Amylose-2柱(250 mm×4.6 mm,5 μm,以乙腈-水(40∶60)为流动相)和Lux 3u Cellulose-2柱(150 mm× 2 mm,3 μm,以乙腈-水(90∶10)为流动相)分别建立了小白菜和土壤中戊唑醇对映体残留的LC/PDA分析方法,以及黄瓜中戊唑醇对映体残留的LC-MS/MS分析方法,研究发现甘蓝中(+)-S-戊唑醇消解快,而在黄瓜果实和土壤中(-)-R-戊唑醇消解快,LC-MS/MS方法抗干扰能力强、节省分析时间、提高分析效率。随后该课题组[66]又基于Lux Cellulose-2柱,采用LC-MS/MS法研究发现,结球甘蓝和小白菜中(-)-戊菌唑先降解,导致(+)-戊菌唑残留富集,而在黄瓜和番茄中未发现对映体选择性降解差异;Zhang等[67]选择Lux Cellulose-1柱,利用LC-MS/MS分析发现草莓中苯唑醇对映体不存在选择性降解差异,而(+)-腈菌唑比(-)-腈菌唑降解快,易导致草莓中(-)-腈菌唑残留富集;Dong等[68]选用Chiralcel OD-RH柱,通过LC-MS/MS研究降解行为,发现(+)-腈菌唑优先降解导致黄瓜和土壤中(-)-腈菌唑富集,黄瓜灌根施药处理下腈菌唑的立体选择性降解比叶面喷施处理方式强。
Liang等[62,69-71]选择Lux Cellulose-1柱,反相LC-MS/MS测定分析,先后发现葡萄果实和土壤中的(-)-氟环唑比(+)-氟环唑降解快,造成(+)-氟环唑富集,三唑酮(TF)在北京和郑州土壤中均是R-(-)-TF先降解,而在小麦中TF对映体无选择性降解,在三地麦秆中三唑醇(TN)对映体残留量大小均为SR-(-)-TN>RR-(+)-TN>RS-(+)-TN>SS-(-)-TN,而在土壤中为RR-(+)-TN>SS-(-)-TN>SR-(-)-TN>RS-(+)- TN;李远播[71]选择Chiralpak OD-RH柱,反相LC-MS/MS测定,建立了戊唑醇、四氟醚唑、氟环唑、烯唑醇、己唑醇、多效唑、腈菌唑、三唑酮、三唑醇、腈苯唑及其手性代谢物RH-9129和RH-9130在不同样品中的残留分析方法,研究发现设施条件下黄瓜、番茄和土壤中己唑醇降解均存在明显的立体选择性,黄瓜和番茄果实中(+)-己唑醇优先降解,而土壤中(-)-己唑醇优先降解,三唑酮对映体在黄瓜、番茄和土壤中表现出一致的S-(+)-三唑酮优先降解规律,从而导致样品中R-(-)-三唑酮累积,而三唑酮降解产物三唑醇对映体表现为叶面喷雾施药下番茄中RS-(+)-三唑醇累积最多,黄瓜和土壤中RR-(+)-三唑醇累积最多,当采用土壤灌根施药时,番茄和土壤中RS-(+)-三唑醇累积最多,黄瓜中RR-(+)-三唑醇累积最多;方松等[72]选择Lux Cellulose-2柱,采用LC-MS/MS研究发现甲霜灵在烟草上部叶片中无明显立体选择性降解,中、下部叶片存在显著的立体选择性降解行为,S-甲霜灵优先于R-甲霜灵降解,且叶片部位越低,立体选择性降解越明显。

3.3 超高效液相色谱-串联质谱法
超高效液相色谱-串联质谱联用技术(UPLC-MS/MS)是将超高效液相色谱的高分离性能与串联质谱高定性能力相结合的现代分析技术,随着色谱填料技术和小内径装柱技术的发展以及抗超高压液相系统的出现和应用,提高了其分析通量、分析速度和灵敏度,使之越来越多地用于手性农药对映体残留分析。如程莉[76]选择Chiralcel OD-RH柱,利用UPLC-MS/MS测定了腈菌唑对映体在黄瓜中的残留,(+)-腈菌唑和(-)-腈菌唑的LOQ分别为6.71、6.50 μg/kg;Li等[77]选用Lux Cellulose-2柱,采用UPLC-MS/MS建立了苹果中抑霉唑对映体残留分析方法并研究了其降解规律,发现苹果中S-(+)-抑霉唑比R-(-)-抑霉唑降解快;Li等[78]选择Lux Cellulose-4柱,采用反相UPLC-MS/MS法测定了丁虫腈对映体在水稻、稻草、糙米和田泥中的残留,方法回收率为83.6%~107%,RSD为1.0%~5.8%,LOQ均低于2.0 μg/kg;Pan等[79]选择Lux Amylose-2柱,以乙腈-水(70∶30)为流动相,利用UPLC-MS/MS建立了番茄、辣椒、黄瓜和葡萄中苯酰菌胺对映体残留分析方法,发现在番茄中(-)-R-苯酰菌胺比(+)-S-苯酰菌胺降解快,半衰期分别为3.80 d和5.17 d,而在辣椒和葡萄中则相反,(+)-S-苯酰菌胺的降解更快,半衰期分别为S-体为1.95 d和2.03 d、R-体为2.28 d和2.87 d,黄瓜中未见明显的对映体选择性降解。

超高效液相色谱-四极杆飞行时间质谱技术(UPLC-Q-TOF/MS)更是充分结合了飞行时间质谱的高质荷比准确度、高通量、高分辨率和高选择性,以及四极杆质量分析器宽泛的定量线性范围和超高效液相色谱的高分离能力,逐渐成为手性农药残留分析研究手段之一,以该技术研究农产品中手性农药对映体的降解代谢受到越来越多的关注[82]。如本课题组[83-84]采用Lux Cellulose-1柱分离,建立了UPLC-Q-TOF/MS测定茶鲜叶、绿茶、红茶、普洱茶和红茶茶汤中茚虫威和顺式-氟环唑对映体残留分析方法,发现对映体流出顺序依次为(-)-顺式-氟环唑、(+)-顺式-氟环唑、(-)-茚虫威和(+)-茚虫威,咖啡碱的存在会严重影响对映体拆分EF值,方法回收率为61.0%~130%,RSD小于17%,不同茶叶中的LOQ为2.0~4.7 μg/kg,茶汤中为0.17 μg/L,采用此方法研究顺式-氟环唑和茚虫威对映体在茶叶生长、加工过程中的降解行为,发现茚虫威和顺式-氟环唑对映体在茶叶生长加工中降解呈现不同的对映体选择性降解差异趋势,顺式-氟环唑对映体在茶鲜叶中半衰期差别不大,分别为6.1 d 和5.5 d,而茚虫威对映体在茶鲜叶中半衰期差别明显,分别为8.0 d 和5.9 d,(+)-茚虫威降解快于(-)-茚虫威,通过EF值发现,茚虫威在茶鲜叶生长过程中表现出潜在的(-)-体富集趋势,而从鲜叶到成茶的加工过程中,顺式-氟环唑表现出潜在的(+)-体向(-)-体转化趋势,茚虫威表现出潜在的(-)-体转化成(+)-体的趋势。
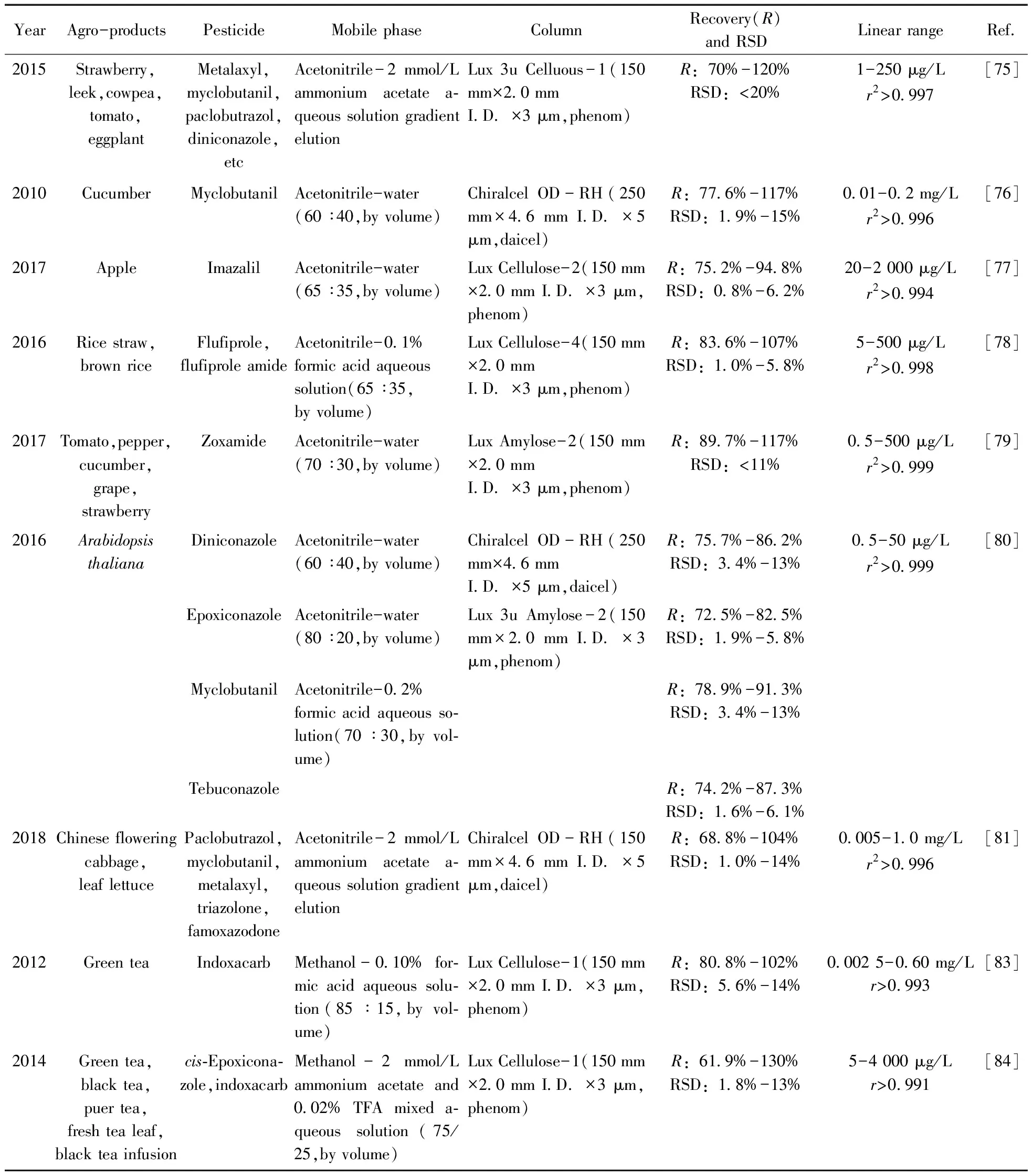
LC在农产品中手性农药对映体残留分析应用见表1。

表1 液相色谱法在农产品中手性农药残留分析应用文献Table 1 Application literatures of liquid chromatography in the analysis of chiral pesticide residues in agricultural products
(续表1)

YearAgro-productsPesticideMobile phaseColumnRecovery(R) and RSDLinear rangeRef.2010Cucumber,tomato,apple,pearIndoxacarbn-Hexane-ethanol (95∶5,by volume)Chiralpak AS-H(250 mm×4.6 mm I.D.×5 μm,daicel)R:87.0%-117%RSD:<10%0.05-5 mg/kgr2≥0.99[38]2008Chinese cabbageFipronilHexane-isopropanol(95∶5,by volume)(R,R)Whelk-01(250 mm×4.6 mm I.D.Regis Tech.)R:83.1%-90.9%RSD:2.1%-5.5%1.0-250 mg/Lr2>0.98[39]2002Sunflower plantMetalaxylHexane-isopropanol(85∶15,by volume)Chiralcel OJ(250 mm×4.6 mm I.D.×5 μm,daicel)R:74%-80%RSD:0.86%-1.3%-[40]2007Cucumber plantBennalaxyHexane-isopropanolHome made CDMPC-CSP column(250 mm×4.6 mm I.D.)R:81.0%-98.8%RSD:2.8%-3.7%0.25-25 mg/Lr2≥0.99[41]2010GrapeDiclofop-methyl diclofop0.1% TFA in n-Hexane-2-propanol(98∶2,by volume)Chiralpak AS-H(250 mm×4.6 mm I.D.×5 μm,daicel)R:>60%RSD:1.5%-8.1%0.5-250 mg/Lr2>0.999[42]2008Chinese cabbageDiclofop-methylHexane-2-propanol(90∶10,by volume)Lux Cellulose-1(150 mm×2.0 mm I.D.×3 μm,phenom)R:80.6%-101%RSD:2.1%-6.0%0.5-500 mg/Lr2>0.98[43]2011Cucumber,tomatoDifenoconazolen-Hexane-ethanol(90∶10,by volume)Chiralpak OJ-H(250 mm×4.6 mm I.D.×5 μm,daicel)R:84.1%-94.3%RSD:<8.5%0.5-50 μg/mLr2>0.998 9[44]2012CabbageIndoxacarbHexane-isopropanol (85∶15,by volume)Lux Cellulose-1(150 mm×2.0 mm I.D.×3 μm,phenom)R:88%-110%RSD:0.6%-11%0.1-10 mg/L,r2>0.99[45]2013CucumberDinotefurann-Hexane-methanol-ethanol(85∶10∶5,by volume)Chromega Chiral CCA(150 mm×4.6 mm I.D.×5 μm,ES)R:75.8%-99.4%RSD:2.2%-16%0.5-500 μg/mLr2>0.999[46]2008,2010Cucumber roots,stems,leaves,cucumberTriadimenolHexane-ethanol (95∶5,by volume)Chiralpak AS-H(250 mm×4.6 mm I.D.×5 μm,daicel)R:79.7%-90.4%RSD:4.1%-14%0.1-1 μg/mLr2>0.995[48-49]2008Tomato,tobacco,sugar beet,capsicumBennalaxyn-Hexane-ethanol (85∶15,by volume)Lux Cellulose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:76.3%-90.8%RSD:2.0%-8.0%0.5-50 mg/mLr2>0.999[50]2016PearDiniconazoleMethanol-water (40∶60,by volume)Home made UCDP col-umn(150 mm× 4.6 mm I.D.)R:91.2%-94.4%RSD:1.8%-2.4%0.5-125 μg/mLr2>0.995[51]2017CucumberTriticonazoleMethanol-water (35∶65,by volume)Home made PCPD col-umn(150 mm×4.6 mm I.D)R:92.5%-93.2%RSD:<1.3%1-50 μg/mLr2=0.986[52]2011Cabbage,cucumberTebuconazoleAcetonitrile-water (50∶50,by volume)Lux 5u Amylose-2(150 mm×2.0 mm I.D.×5 μm,phenom)R:80.4%-96.8%RSD:3.1%-9.3%0.25-1.25 μg/mLr2>0.999 7[53]2011CabbageTebuconazoleAcetonitrile-water (40∶60,by volume)Lux 5u Amylose-2(250 mm×4.6 mm I.D.×5 μm,phenom)R:82.0%-100%RSD:<9%0.25-25 μg/mLr≥0.999[53]CucumberAcetonitrile-water(90∶10,by volume)Lux 3u Amylose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:91.2%-101%RSD:<6%0.0005-0.5 μg/mLr≥0.9992014Tomato,grapePaclobutrazolAcetonitrile-water (55∶45,by volume)CDMPC(250 mm×4.6 mm I.D.×5 μm)R:80.6%-91.3%0.25-50 mg/Lr2>0.999[54]AppleTebuconazolen-Hexane-isopropanol (90∶10,by volume)R:83.0%-97.8%0.5-100 mg/Lr2>0.9892012RiceEthiproleMethanol-water(60∶40,by volume)Lux Cellulose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:87.4%-97.8%RSD:3.1%-9.3%0.1-1.25 mg/kgr2>0.996[56]2013Tomato,cucumberMetalaxyl and metalaxyl acidAcetonitrile-water (60∶40,by volume)Chiralpak OD-RH(150 mm×4.6 mm I.D.×5 μm,daicel)R:95.1%-106%RSD:3.5%-6.9%0.01-1 mg/Lr2>0.995[57]
(续表1)

YearAgro-productsPesticideMobile phaseColumnRecovery(R) and RSDLinear rangeRef.2012Cucumber,tomato,grapeIndoxacarbAcetonitrile-water(65∶35,by volume)Chiralpak AD-RH(150 mm×4.6 mm I.D.×5 μm,daicel)R:65.5%-117%RSD:4.1%-18%0.005-1.25 mg/kgr2>0.997[59-60]2015Green teaIndoxacarbAcetonitrile-water(60∶40,by volume)Chiralpak IC-3(250 mm×4.6 mm I.D.×5 μm,daicel)R:83.8%-109%RSD:3.9%-10%0.025-5 μg/mLr2>0.990[61]2012GrapeEpoxiconazoleAcetonitrile-water(90∶10,by volume)Lux Cellulose-1(150 mm×2.0 mm I.D.×3 μm,phenom)R:76.0%-91.9%RSD:3.9%-11%0.01-5 mg/l,r2>0.99[62]2012Tomato,cucumber,pear,appleTebuconazoleAcetonitrile-2 mmol/L ammonium acetate(70∶30,by volume)Lux 3u Amylose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:79.3%-102%RSD:2.8%-12%1-125 μg/Lr2>0.998[63]2013Wheat plant and seedTebuconazoleAcetonitrile-water(60∶40,by volume)Lux 3u Amylose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:73.4%-112%RSD:≤14%0.01-10 mg/Lr2>0.994[64]2013Cabbage,cucumberTebuconazoleAcetonitrile-water(40∶60,by volume)Lux Amylose-2(250 mm×4.6 mm I.D.×5 μm,phenom)R:82.0%-100%RSD:≤15%0.25-25 mg/Lr2>0.999[65]Acetonitrile-water(90∶10,by volume)Lux 3u Cellulose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:91.2%-101%RSD:≤7.7%0.5-500 μg/Lr2>0.9942014Cucumber,tomato,head cabbage,pakchoiPenconazoleMethanol-2 mmol/L ammonium acetate+0.1% formic acid aqueous solution(70∶30,by volume)Lux Cellulose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:78.5-102%RSD:2.8%-12%0.5-500 μg/Lr2>0.998[66]2011StrawberryFenbuconazole,myclobutanilAcetonitrile-0.1% for-mic acid solution(60∶40,by volume)Lux Cellulose-1(150 mm×2.0 mm I.D.×3 μm,phenom)R:82.1%-91.5%RSD:2.7%-5.4%1-500 μg/Lr2>0.997[67]2012CucumberMyclobutanilAcetonitrile-water(70∶30,by volume)Chiralpak OD-RH(150 mm×4.6 mm I.D.×5 μm,daicel)R:77.6%-117%RSD∶2.5%-8.8%1-1 000 μg/Lr2≥0.997 5[68]2012,2013Wheat,strawTriadimefon,triadimenolMethanol-water gradi-ent elutionLux Cellulose-1(250 mm×4.6 mm I.D.×5 μm,phenom)R:84.0%-107%RSD:0.79%-9.2%0.003-4 mg/Lr2>0.99[69-70]2013Tomato,cucumber,apple,pearTebuconazoleAcetonitrile-2 mmol/L ammonium acetate aqueous solution (70∶30,by volume)Lux Amylose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:79.3%-102%RSD:<12%1-125 μg/Lr2≥0.998[71]Tomato,cucumberHexaconazoleAcetonitrile-2 mmol/L ammonium acetate a-queous solution(60∶40,by volume)Chiralpak OD-RH(250 mm×4.6 mm I.D.×5 μm,daicel)R:81.6%-104%RSD:<13%1-500 μg/Lr2≥0.999Tomato,cucumberTriadimefon,triadimenolAcetonitrile-2 mmol/L ammonium acetate aqueous solution gradi-ent elutionChiralpak OD-RH(250 mm×4.6 mm I.D.×5 μm,daicel)R:81.6%-105%RSD:<13%5-2 000 μg/Lr2≥0.9982018TobaccoMetalaxylAcetonitrile-water gra-dient elutionLux Cellulose-2(150 mm×4.6 mm I.D.×3 μm,phenom)R:95.1%-106%RSD:3.5%-6.9%0.001-0.5 mg/Lr2>0.999[72]2016Cucumber,tomato,pakchoi,pepper,strawberryPyrisoxazoleMethanol-water(70∶30,by volume)Lux Cellulose-3(150 mm×2.0 mm I.D.×3 μm,phenom)R:64.2%-126%RSD:0.3%-14%2-250 μg/Lr>0.99[74]
(续表1)
YearAgro-productsPesticideMobile phaseColumnRecovery(R) and RSDLinear rangeRef.2015Strawberry,leek,cowpea,tomato,eggplantMetalaxyl,myclobutanil,paclobutrazol,diniconazole,etcAcetonitrile-2 mmol/L ammonium acetate a-queous solution gradient elutionLux 3u Celluous-1(150 mm×2.0 mm I.D.×3 μm,phenom)R:70%-120%RSD:<20%1-250 μg/Lr2>0.997[75]2010CucumberMyclobutanilAcetonitrile-water(60∶40,by volume)Chiralcel OD-RH(250 mm×4.6 mm I.D.×5 μm,daicel)R:77.6%-117%RSD:1.9%-15%0.01-0.2 mg/Lr2>0.996[76]2017AppleImazalilAcetonitrile-water (65∶35,by volume)Lux Cellulose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:75.2%-94.8%RSD:0.8%-6.2%20-2 000 μg/Lr2>0.994[77]2016Rice straw,brown riceFlufiprole,flufiprole amideAcetonitrile-0.1%formic acid aqueous solution(65∶35,by volume)Lux Cellulose-4(150 mm×2.0 mm I.D.×3 μm,phenom)R:83.6%-107%RSD:1.0%-5.8%5-500 μg/Lr2>0.998[78]2017Tomato,pepper,cucumber,grape,strawberryZoxamideAcetonitrile-water(70∶30,by volume)Lux Amylose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:89.7%-117%RSD:<11%0.5-500 μg/Lr2>0.999[79]2016Arabidopsis thalianaDiniconazoleAcetonitrile-water(60∶40,by volume)Chiralcel OD-RH(250 mm×4.6 mm I.D.×5 μm,daicel)R:75.7%-86.2%RSD:3.4%-13%0.5-50 μg/Lr2>0.999[80]EpoxiconazoleAcetonitrile-water(80∶20,by volume)Lux 3u Amylose-2(150 mm×2.0 mm I.D.×3 μm,phenom)R:72.5%-82.5%RSD:1.9%-5.8%MyclobutanilAcetonitrile-0.2% formic acid aqueous so-lution(70∶30,by vol-ume)R:78.9%-91.3%RSD:3.4%-13%TebuconazoleR:74.2%-87.3%RSD:1.6%-6.1%2018Chinese flowering cabbage,leaf lettucePaclobutrazol,myclobutanil,metalaxyl,triazolone,famoxazodoneAcetonitrile-2 mmol/L ammonium acetate a-queous solution gradient elutionChiralcel OD-RH(150 mm×4.6 mm I.D.×5 μm,daicel)R:68.8%-104%RSD:1.0%-14%0.005-1.0 mg/Lr2>0.996[81]2012Green teaIndoxacarbMethanol-0.10% for-mic acid aqueous solu-tion(85∶15,by vol-ume)Lux Cellulose-1(150 mm×2.0 mm I.D.×3 μm,phenom)R:80.8%-102%RSD:5.6%-14%0.002 5-0.60 mg/Lr>0.993[83]2014Green tea,black tea,puer tea,fresh tea leaf,black tea infusioncis-Epoxicona-zole,indoxacarbMethanol-2 mmol/L ammonium acetate and 0.02% TFA mixed a-queous solution(75/25,by volume)Lux Cellulose-1(150 mm×2.0 mm I.D.×3 μm,phenom)R:61.9%-130%RSD:1.8%-13%5-4 000 μg/Lr>0.991[84]
4 超高效合相色谱法在农产品中手性农药对映体残留分析中的应用
合相色谱技术(Convergence chromatography,CC)是基于超临界流体色谱(SFC)的原理,以超临界流体CO2为主要流动相,辅以一定比例的有机溶剂作为改性剂,利用超临界流体CO2黏度系数较低、传质性能好的特点,在色谱柱中对不同化合物进行分离分析的绿色环保色谱技术[85]。CC的分析条件温和,不受样品挥发性的限制,既可分析GC不适合的高沸点、低挥发性样品,又能对LC难分离的结构类似物、手性化合物等进行分离分析。超高效合相色谱(UPCC)结合了UPLC和SFC技术的优点,具有溶剂加载量小、分辨率高、峰形窄和分离快等特点,而由于UV灵敏度缺陷,目前合相色谱大多配备辅助泵与质谱等联用,近年来在手性农药对映体残留分析上的应用逐渐增多,尤其是对复杂样品基质的分析[82]。

本课题组选择Chromega Chrial CCA手性柱,以CO2-异丙醇(95∶5)为流动相,建立了超高效合相色谱-四极杆飞行时间质谱(UPCC-QTOF MS)测定苹果、葡萄和茶叶中腈菌唑对映体残留的分析方法,回收率为62.5%~103%,RSD不大于9.9%,LOQ为0.005 mg/kg和0.01 mg/kg[95],随后建立了苹果、葡萄和红茶中顺式-氟环唑、丙环唑、烯唑醇和乙酰甲胺磷对映体残留分析方法,回收率为63.3%~102%,RSD小于10%,LOQ不大于0.01 mg/kg[96-97],并用该方法研究茶鲜叶生长过程中烯唑醇的降解,发现两对映体差异不明显,在茶叶加工步骤中,揉捻是影响绿茶中烯唑醇对映体降解的关键步骤,而红茶中关键步骤是揉捻和发酵共同作用[98]。目前TOF MS在农药残留中与GC、LC及UPLC联用较多,方法以筛查定性、半定量为主,四极杆质量分析器的串联引入,拓宽了定量线性范围,又能通过二级质谱增加定性准确度,未来Q-TOF MS与UPCC等联用在手性农药残留分析中应用将越来越多。
5 总结与展望
由于不同色谱法的特点不同,当前农产品中手性农药对映体残留分析方法主要集中在液相色谱,尤其是近年来发展的高效液相色谱、超高效液相色谱与质谱联用方面。随着四极杆质量分析器与飞行时间质谱串联,以及合相色谱技术的不断发展,人们对手性农药对映体的研究不断深入,需求范围不断扩大,未来农产品中手性农药对映体研究应侧重以下方面:①当前研究还集中在手性农药对映体拆分及其残留降解行为上,未来更应该利用这些技术去探究为什么会出现差异;②当前有关手性农药残留研究更多在单一手性农药在不同基质中的残留分析方面,而随着高通量检测的需求不断增加,未来应将新方法开发集中于多种手性农药对映体的多残留分析上;③目前绝大多数情况下,手性农药对映体与非手性农药残留分析分开进行,伴随着新型色谱填料、质谱等技术的发展进步,以及对成本控制的需求增加,应转向利用新色谱材料技术增加复杂基质中手性农药对映体与非手性农药混合多残留分析的应用及风险评估研究。
