连作植烟土壤酚酸类物质变化特征及其与主要环境因子的Mantel Test分析*
2019-03-08白羽祥杨成翠史普酉杨焕文徐照丽
白羽祥, 杨成翠, 史普酉, 贾 孟, 杨焕文, 徐照丽, 王 戈**
连作植烟土壤酚酸类物质变化特征及其与主要环境因子的Mantel Test分析*
白羽祥1, 杨成翠1, 史普酉1, 贾 孟1, 杨焕文1, 徐照丽2, 王 戈1**
(1. 云南农业大学烟草学院 昆明 650201; 2. 云南省烟草农业科学研究院 昆明 650021)
为明确酚酸类物质在连作植烟土壤中的变化特征, 探讨土壤主要环境因子对酚酸类物质的影响, 以不同连作年限(4 a, 6 a, 8 a, 14 a和16 a)植烟土壤为对象, 研究了不同连作年限植烟土壤酚酸类物质、理化性状、酶活性和细菌多样性的变化特征, 并利用Mantel Test分析了酚酸类物质与土壤主要环境因子的相关性。结果表明, 随连作年限增加, 土壤酚酸类物质和速效钾含量升高, pH、有机质含量、细菌菌群丰度和多样性降低, 水解性氮和有效磷含量呈先降低后升高趋势, 酶活性呈先升高后降低趋势。Mantel Test分析表明, 土壤酚酸类物质含量与理化性状、酶活性和细菌丰度显著相关, 且与理化性状相关性最高; 不同酚酸类物质含量与土壤主要环境因子相关性存在差异, 其中, 对羟基苯甲酸和阔马酸与植烟土壤理化性状、酶活性以及细菌丰度的相关性最高。因此, 在本试验条件下, 连作植烟土壤酚酸类物质具有明显积累特征, 植烟土壤环境恶化; 酚酸类物质积累受理化性状、酶活性和细菌多样性影响, 且理化性状影响最大; 不同酚酸类物质受主要土壤环境因子的影响存在差异, 其中对羟基苯甲酸和阔马酸积累所受影响最大。
烤烟; 连作; 酚酸类物质; 土壤环境; Mantel Test
烤烟()是忌连作作物, 长期连作严重影响其生长发育及产质量形成[1]。虽然我国一直提倡轮作, 但在耕地面积逐年减少和利益驱使下, 烤烟连作现象依然普遍, 严重制约了植烟土壤的可持续发展[2]。研究表明, 连作会导致土壤养分失衡[3-4]、酶活性变化[5-6]、微生物多样性降低[7]和自毒物质积累[8]等一系列土壤问题, 以上各因素相互作用并对土壤环境产生综合影响进而导致植株生长发育受抑。
目前学术界普遍认为有毒物质积累是导致连作障碍发生的重要因素, 主要通过植物挥发、淋溶、根系分泌、凋落物及其残体分解等方式释放到土壤环境中[9-10], 其中酚酸类物质在其中扮演的角色备受关注[11-14]。研究表明, 在连作条件下酚酸可以间接刺激土传病原微生物繁殖, 提高植株发病率[15], 如黄瓜()根系分泌物中的香豆素可以显著影响根际土壤微生物群落并促进土传病原菌的生长[16], 香草醛可以显著影响黄瓜根际镰刀菌属()和木霉属()真菌群落结构和丰富度[17]。酚酸类物质在连作土壤中的积累特性已在水稻()、大豆()、花生()、黄瓜、中药材以及林木等多种植物中被证实[18-20], 而有关连作植烟土壤中有毒物质特别是酚酸类物质种类和含量的变化特征研究相对薄弱, 尚未有直接证据表明其在土壤中是否存在积累特征[21-22]。另外, 土壤环境因子之间存在密切的相互关系并共同塑造着土壤环境, 那么酚酸类物质通过根系分泌、淋溶、腐解等多种途径进入土壤环境后也必将参与到这一复杂的过程中[23]。然而, 进入土壤后的酚酸类物质与其他环境因子的相互作用关系并未受到太多关注, 但其对进一步明确酚酸类物质在土壤中的作用机制及其在连作障碍中的作用具有重要意义[24-26]。本试验拟通过研究土壤各环境因子与酚酸类物质间相关性以明确酚酸类物质与土壤其他环境因子的关系, 但目前采用的相关性分析方法仅可以判断两个变量之间的关联程度, 无法对两类变量之间的相关性进行分析, 这在一定程度上限制了对土壤各环境因子间关系的探究。
Mantel Test是对两个矩阵(两类变量)相关关系的检验, 由Mantel在1967年提出[27]。该方法在种群遗传学、群落生态学等领域具有广泛应用, 在生态学中多用于研究生物因素和非生物因素之间的相关性[28-29], 前人在黑胡椒()园[30]和热带雨林[31]等土壤环境因子和相关性研究中发现, 相对于一般相关性分析方法, Mantel Test具有可以直接分析两类变量(如土壤理化性状和微生物多样性)之间相关性的优点, 这对研究土壤各环境因子之间关系具有十分重要的意义, 但该方法在植烟土壤各环境因子关系的研究中少见报道。因此, 本研究在描述连作植烟土壤酚酸类物质、理化性状、酶活性和细菌多样性变化特征基础上, 利用Mantel Test方法探讨了酚酸类物质与土壤各环境因子的相关关系, 旨在为研究影响土壤酚酸类物质含量的环境因素及其在连作障碍中的作用机理提供一定理论依据。
1 材料与方法
1.1 土样采集区基本概况
试验地选择在云南省保山市施甸县姚关镇陡坡村的连片烤烟种植示范区(99°14′E, 24°36′N, 海拔1 820 m), 年平均气温17 ℃, 年平均降雨量1 120 mm。该区域土地由同一农户承包, 植烟历史可考。除连作年限外, 其他因素一致: 土壤质地为砂壤土, 种植烤烟品种为‘K326’, 每年烤烟施氮量(纯氮)为120 kg∙hm-2, 施磷量(P2O5)为90 kg∙hm-2、施钾量(K2O)为321 kg∙hm-2, 肥料由当地烟草公司提供, 栽培管理措施统一按照当地优质烟叶生产技术进行。
1.2 试验设计和样品采集
试验田种植制度为“大麦()-烤烟”复种连作模式, 一年两熟。试验设置5个处理, 分别为连续种植4 a(T4)、6 a(T6)、8 a(T8)、14 a(T14)和16 a(T16)烤烟的土壤, 每一处理设置3次重复, 共计15个小区, 每一小区面积为667 m2。于2017年9月20日利用五点取样法采取每一小区植烟土壤0~20 cm土样2 kg, 除去表层并混匀后每一重复用5 mL离心管装取3管并立即放入液氮中保存待测, 其余土样立即放入4 ℃冰箱中保存待测。
1.3 测定项目与方法
1.3.1 土壤酚酸类物质的测定

仪器为Aglient 1200高效液相色谱仪, 色谱柱为SunFireTMC18(4.6 mm×250 mm, 5mm), 条件为流速 1 mL∙min-1, 柱温为25 ℃, 检测波长为280 nm。流动相A(甲醇)和流动相B(pH=2.5的乙酸水溶液)设置的具体梯度为: 0 min, 流动相A 30%、B 70%; 15 min, 流动相A 50%、B 50%; 16 min, 流动相A 70%、B 30%; 30 min, 流动相A 0%、B 100%。标准样品分别为阔马酸、对羟基苯甲酸、间苯三酚、香草酸、香兰素、阿魏酸、邻苯二甲酸、苯甲酸、肉桂酸和水杨酸, 进样量为10 μL。每个周期分析结束后, 等待10 min, 以便去除干扰成分的影响, 保证分析结果的稳定性和重复性。
1.3.2 土壤理化性状的测定
土壤pH采用2.5∶1的水土比, 用电位计法测定; 有机质采用重铬酸钾-硫酸外加热法测定; 碱解氮采用碱解扩散法测定; 有效磷采用NaHCO3浸提、钼锑抗比色法测定; 速效钾采用醋酸铵浸提、火焰光度计测定。测定的主要仪器分别为火焰光度计、分析天平、凯式定氮仪、电热恒温鼓风干燥箱和紫外分光光度计等。以上测试指标分别按照行业标准NY/T 1377—2007、NY/T 87—1988、LY/T 1229—1999、NY/T 1121.7—2006、NY/T 889—2004进行测定。所有土样的测定均为3次重复。
1.3.3 土壤酶活性的测定
过氧化氢酶活性采用KMnO4滴定法、脲酶活性采用靛酚蓝比色法、蔗糖酶活性采用3,5-二硝基水杨酸比色法、酸性磷酸酶活性采用磷酸苯二钠比色法进行测定[32]。所有土样测定均为3次重复。
1.3.4 土壤细菌多样性的测定
1.3.4.1 基因组DNA的提取和PCR扩增
利用CTAB法提取各处理样本的基因组DNA, 然后利用琼脂糖凝胶电泳来检测DNA的纯度和浓度。取适量样品放在离心管中, 用无菌水稀释样品至浓度为1 ng×μL-1。以稀释处理后的基因组DNA为模板, 依据细菌和真菌测序区域的选择, 利用带Barcode的特异引物(New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer)和高效高保真酶进行PCR。
1.3.4.2 引物对应区域
515F和806R(16S V4区引物)用于鉴定细菌多样性。
1.3.4.3 PCR产物的混样和纯化
应用2%琼脂糖凝胶对PCR产物进行电泳检测, 依据PCR产物浓度进行等量混样, 充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物, 对得出的目的条带进行拍照记录, 一次电泳条带不清晰的目的条带进行二次电泳直至条带清晰可用为准, 之后使用Qiagen公司提供的胶回收试剂盒对目的条带产物进行回收。
1.3.4.4 文库构建和上机测序
使用建库试剂盒(TruSeq® DNA PCR-Free Sample Preparation Kit)进行文库的构建, 构建好的文库经过Qubit和Q-PCR定量检测确定文库是否合格。
1.3.4.5 土壤细菌基因组DNA信息分析
1)测序数据处理
首先从Illumina HiSeq测序平台得到的下机数据中分离出样品数据, 使用FLASH[33]拼接截去Barcode和引物序列后的样品reads, 得到Raw Tags, Raw Tags经过过滤处理[34]后得到Clean Tags。然后按照Tags质量控制流程[35]通过数据库Gold database与UCHIME Algorithm[36]比对后将Clean Tags进行检测和去除嵌合体序列[37]的处理, 最终得到可用于后续分析的有效数据Effective Tags。数据处理过程中各步骤得到的序列统计结果见表1。
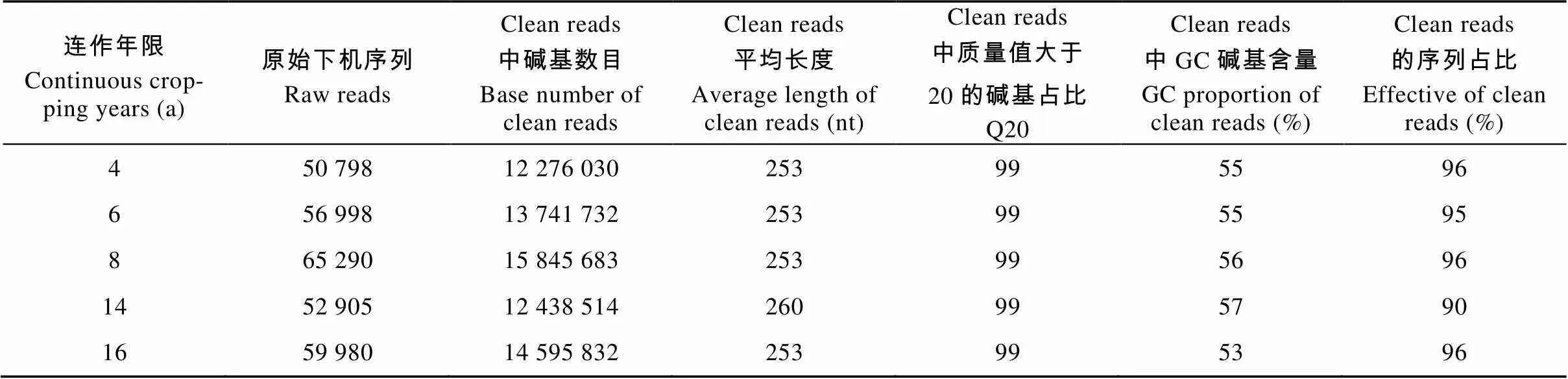
表1 不同连作年限烤烟土壤样品细菌基因测序数据预处理统计及质控
2)OTU聚类和物种注释
利用Uparse软件[38]对各处理样品Effective Tags进行聚类。默认以97%的一致性将序列聚类成为OTUs, 同时选取OTUs的代表性序列, 依据其算法原则, 筛选的是OTUs中出现频数最高的序列作为OTUs的代表序列。对OTUs代表序列进行物种注释, 用Mothur方法与Altschul等[39]的SSUrRNA数据库[40]进行物种注释分析(设定阈值为0.8~1)。获得分类学信息并分别在各个分类水平[界(kingdom)、门(phylum)、纲(class)、目(order)、科(family)、属(genus)、种(species)]统计各样本的群落组成。最后对样品的数据均一化处理, 以样品中数据量最少的为标准进行均一化处理。
3)样品多样性分析(Alpha diversity)
使用Qiime软件(Version 1.7.0)计算各处理样本的Observed-species、Chao1(Chao1 estimator)、ACE (ACE estimator)、Shannon (Shannon index)、Simpson (Simpson index)、Goods-coverage (Good’s coverage)指数。Alpha多样性指数的具体应用为: Chao和ACE指数用于分析菌群丰富度(community richness), Shannon和Simpson指数用于分析菌群多样性(community diversity), Coverage用于分析测序深度。
1.4 数据处理
试验数据采用Microsoft Office 2013进行初步处理, 采用SPSS 22.0软件对数据进行统计分析, 利用 Duncan’s 新复极差法进行数据的多重比较和分析, 利用PCORD 5.0软件对相关数据进行Mantel test分析。
2 结果与分析
2.1 连作植烟土壤主要环境因子变化特征
2.1.1 土壤酚酸类物质及其含量变化特征
在5个连作年限植烟土壤中检出8种酚酸类物质, 分别为间苯三酚、阔马酸、对羟基苯甲酸、香草酸、香兰素、阿魏酸、苯甲酸和肉桂酸(表2)。随连作年限增加, 间苯三酚含量依次显著升高; 连作4 a和6 a处理的阔马酸和阿魏酸含量无显著差别, 但显著低于连作14 a和16 a处理; 除连作8 a处理外, 随连作年限增加, 对羟基苯甲酸、香草酸和香兰素含量升高, 且除连作6 a和连作14 a处理的香兰素含量差异不显著外, 其余处理间差异达到显著水平(表2)。以上结果表明, 在连作条件下, 土壤间苯三酚、阔马酸、对羟基苯甲酸、香草酸、香兰素和阿魏酸含量出现富集效应, 且连作年限越长富集效应越明显。对于苯甲酸和肉桂酸而言, 两者含量的峰值均出现在连作8 a处理, 说明在长期连作条件下, 苯甲酸和肉桂酸含量呈先升高后降低趋势。结合土壤酚酸类物质总含量变化趋势并综合分析可知, 长期连作导致植烟土壤酚酸物质含量升高, 呈现显著的积累特征。
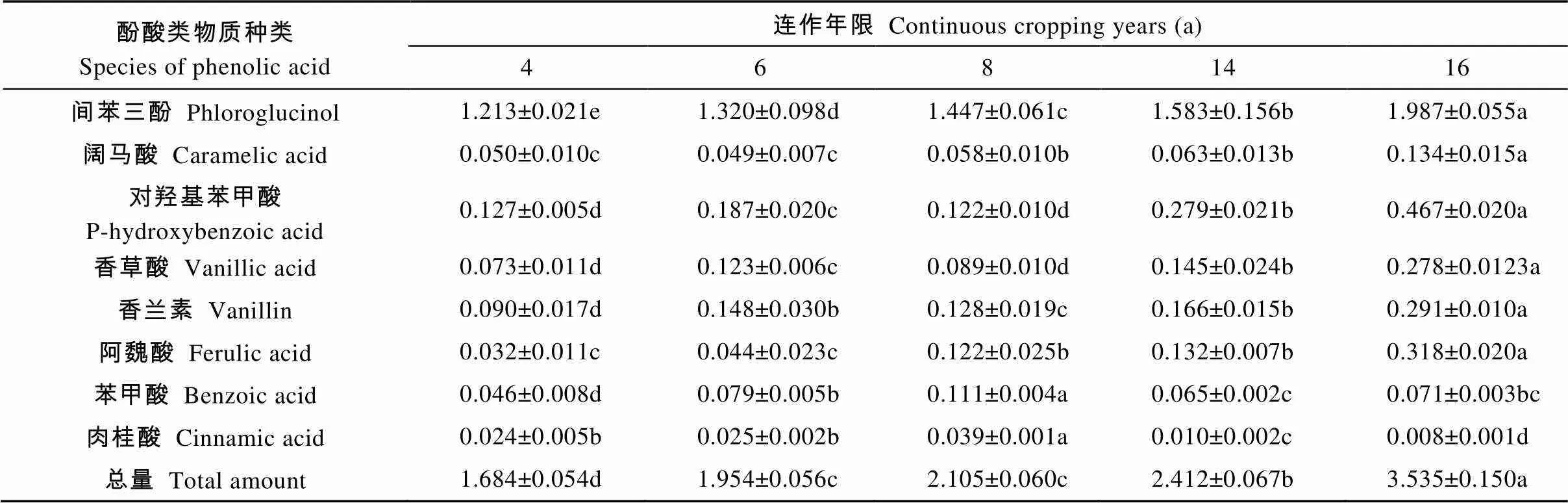
表2 不同连作年限植烟土壤酚酸类物质种类和含量
不同小写字母代表不同连作年限在5%水平显著。Different lowercase letters represent significant differences among different continuous cropping years at 0.05 level.
2.1.2 土壤理化性状变化特征
对不同连作年限植烟土壤理化性状的分析(表3)可知, 随连作年限增加, 植烟土壤pH呈下降趋势, 其中连作14 a和16 a处理显著低于其他处理; 相对于连作4 a处理而言, 其他处理土壤有机质含量显著降低, 其中连作14 a处理最低, 但与连作8 a和16 a处理差异不显著; 除连作16 a处理显著高于其他处理外, 随连作年限增加, 水解性氮含量降低, 总体呈先下降后升高趋势; 连作4年处理的有效磷含量显著高于其他处理, 随连作年限增加呈先降低后升高趋势, 但连作8 a、14 a和16 a处理之间的差异不显著; 随连作年限增加, 速效钾含量呈升高趋势, 其中连作4 a、6 a和8 a处理间差异不显著, 但均显著低于连作14 a和16 a处理。以上结果表明, 连作导致植烟土壤酸化和各养分发生非均衡变化。
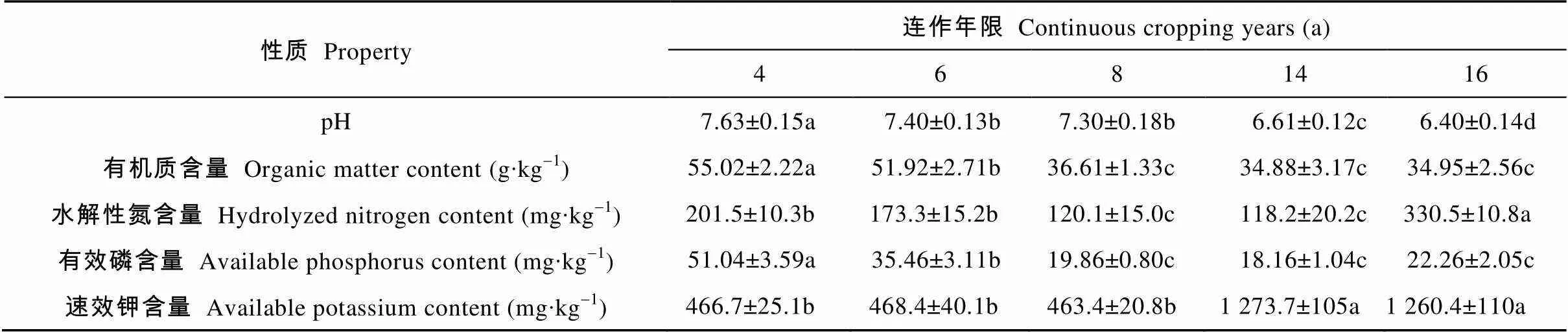
表3 不同连作年限植烟土壤理化性状的影响
不同小写字母代表不同连作年限在5%水平显著。Different lowercase letters represent significant differences among different continuous cropping years at 0.05 level.
2.1.3 土壤酶活性变化特征
随连作年限增加, 植烟土壤中过氧化氢酶、脲酶、酸性磷酸酶和蔗糖酶活性均呈先升高后降低趋势, 但不同酶活性的峰值出现在不同年限, 其中, 连作8 a处理的过氧化氢酶和酸性磷酸酶活性显著高于其他年限; 除连作6 a处理的蔗糖酶活性与连作8 a处理间差异不显著外, 连作6 a处理的脲酶和蔗糖酶活性显著高于其他年限(表4)。
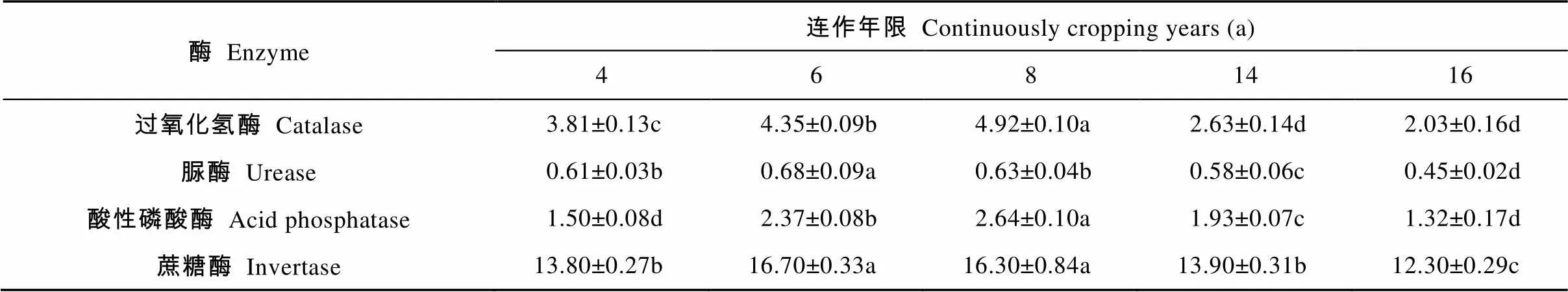
表4 不同连作年限植烟土壤酶活性的变化
不同小写字母代表不同连作年限在5%水平显著。Different lowercase letters represent significant differences among different continuous cropping years at 0.05 level.
2.1.4 连作植烟土壤细菌变化特征
2.1.4.1 连作植烟土壤门水平细菌的相对丰度
不同处理细菌区系在门水平上的组成相似, 主要由变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)构成, 占到总量的88.72%, 其中变形菌门占49.92%。连作4 a和6 a处理的土壤细菌群落组成相似, 但连作8 a后的细菌群落组成差异较大。连作8 a和连作14 a处理检出的变形菌门的相对丰度较连作4 a处理分别降低了19.46%和37.41%, 拟杆菌门分别降低了40.90%和56.36%。另外, 随连作年限增加, 放线菌门、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)呈先升高后降低趋势, 且峰值分别出现在8 a、14 a和14 a(表5)。总体来看, 连作导致植烟土壤细菌群落结构发生改变。
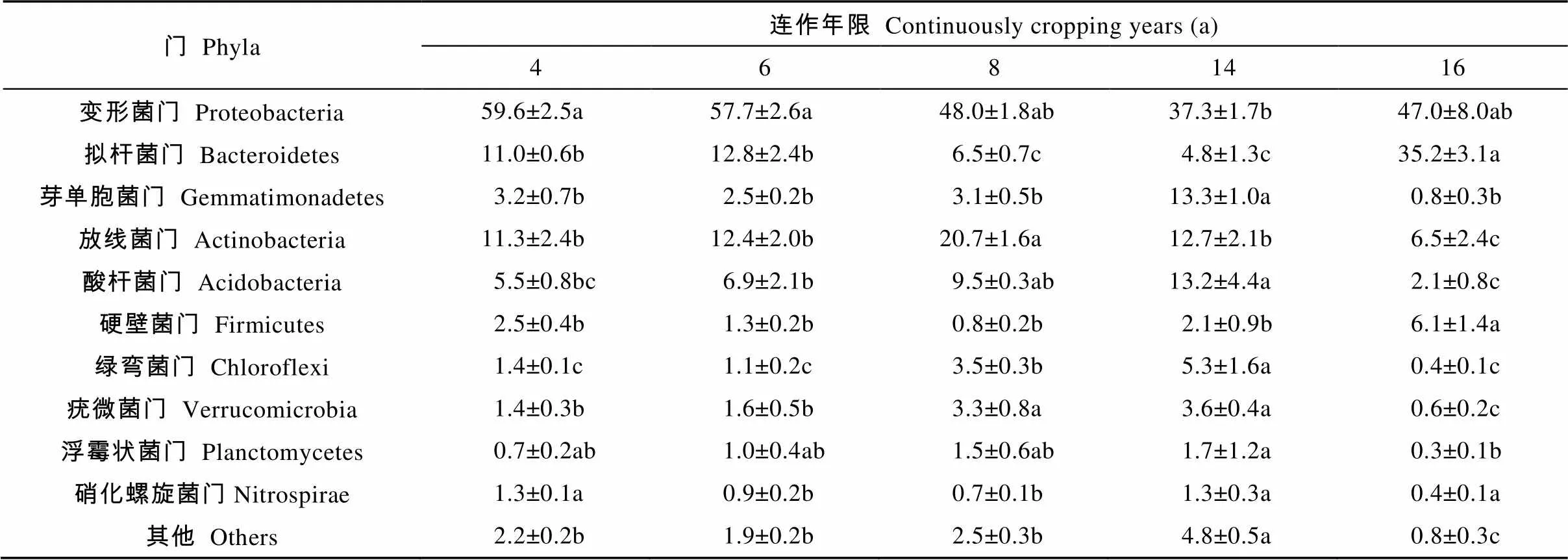
表5 不同连作年限植烟土壤中门水平细菌的相对丰度
不同小写字母代表不同连作年限在5%水平显著。Different lowercase letters represent significant differences among different continuous cropping years at 0.05 level.
2.1.4.2 连作植烟土壤细菌的Alpha多样性
覆盖率(coverage)是指样本中序列被检测出的概率, 其值越高, 代表本次测序结果越符合样本中微生物的实际情况。在本试验中, 连作4 a、6 a、8 a、14 a和16 a的烤烟土壤样本的覆盖率分别为97.0%、96.8%、98.4%、96.8%和97.5%, 表明测序读长可以进行此项分析。从图1可知, 随连作年限增加, 各处理Shannon指数和Simpson指数呈降低趋势, 其中连作4 a、6 a和8 a处理间差异不显著, 连作14 a后, 两者则显著降低; 对于ACE指数和Chao1指数而言, 连作4 a和6 a处理显著高于其他处理, 连作16 a处理最低, 且显著低于其他处理, 总体而言, 表现出随连作年限增加而降低的趋势。以上结果表明, 连作导致烤烟土壤细菌群落丰富度和多样性降低, 且连作年限越长降低越明显。
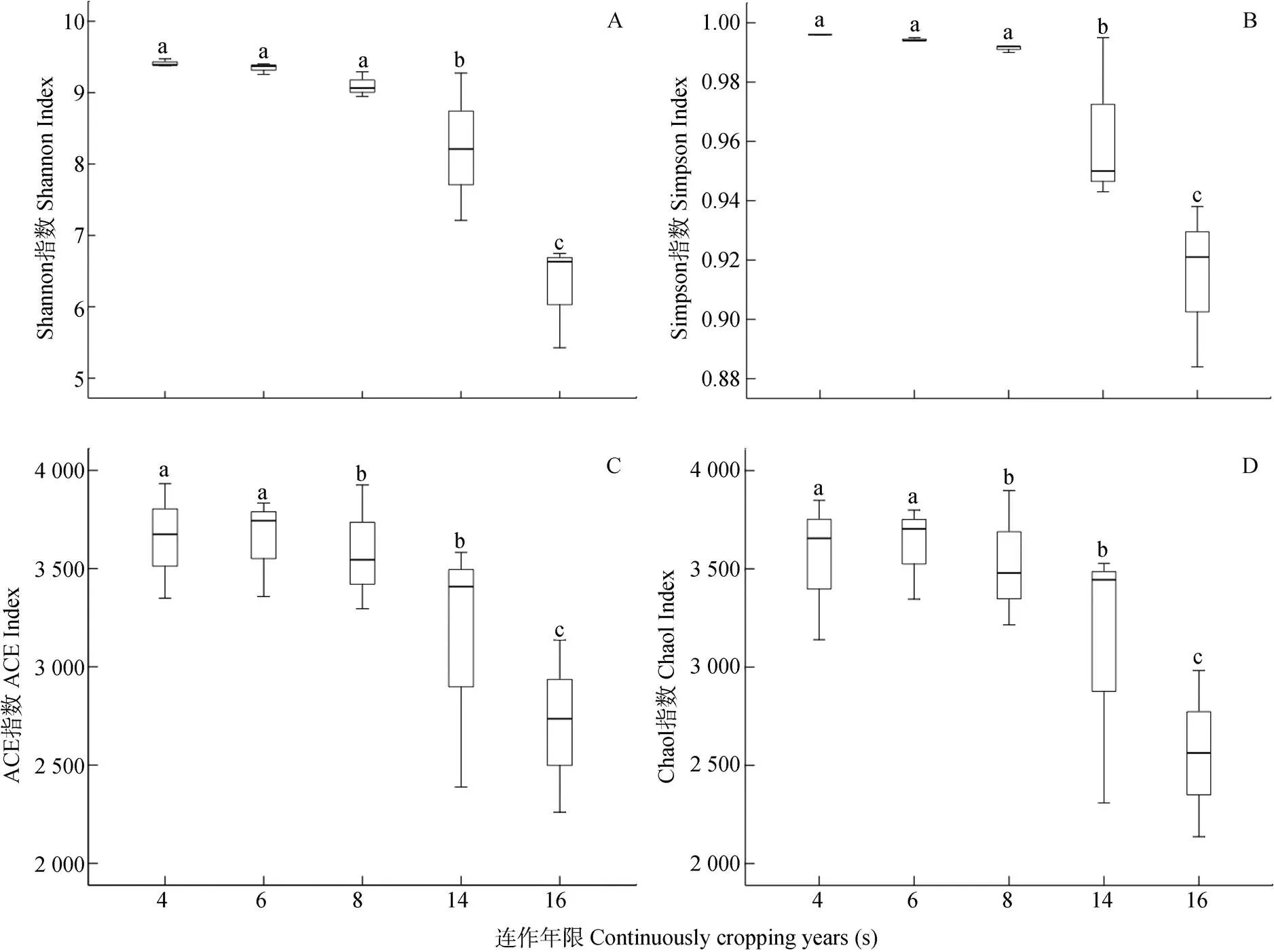
图1 不同连作年限植烟土壤细菌群落的Shannon、Simpson、ACE和Chao1指数
不同小写字母代表不同连作年限在5%水平显著。Different lowercase letters represent significant differences among different continuous cropping years at 0.05 level.
2.2 基于Mantel Test的酚酸类物质与土壤主要环境因子关系分析
2.2.1 酚酸类物质与土壤主要环境因子的Mantel Test结果比较
以酚酸类物质为一矩阵, 分别与其他土壤环境因子进行Mantel Test分析, 可以得出酚酸类物质与其他环境因子之间的相关性。从结果(图2)看, 酚酸类物质与土壤理化性状、酶活性以及细菌丰度之间的相关性均达到极显著水平, 且与理化性状的相关性显著高于酶活性、细菌丰度。表明酚酸类物质与各环境因子之间具有显著的相关性, 且与土壤理化性状相关性最高。
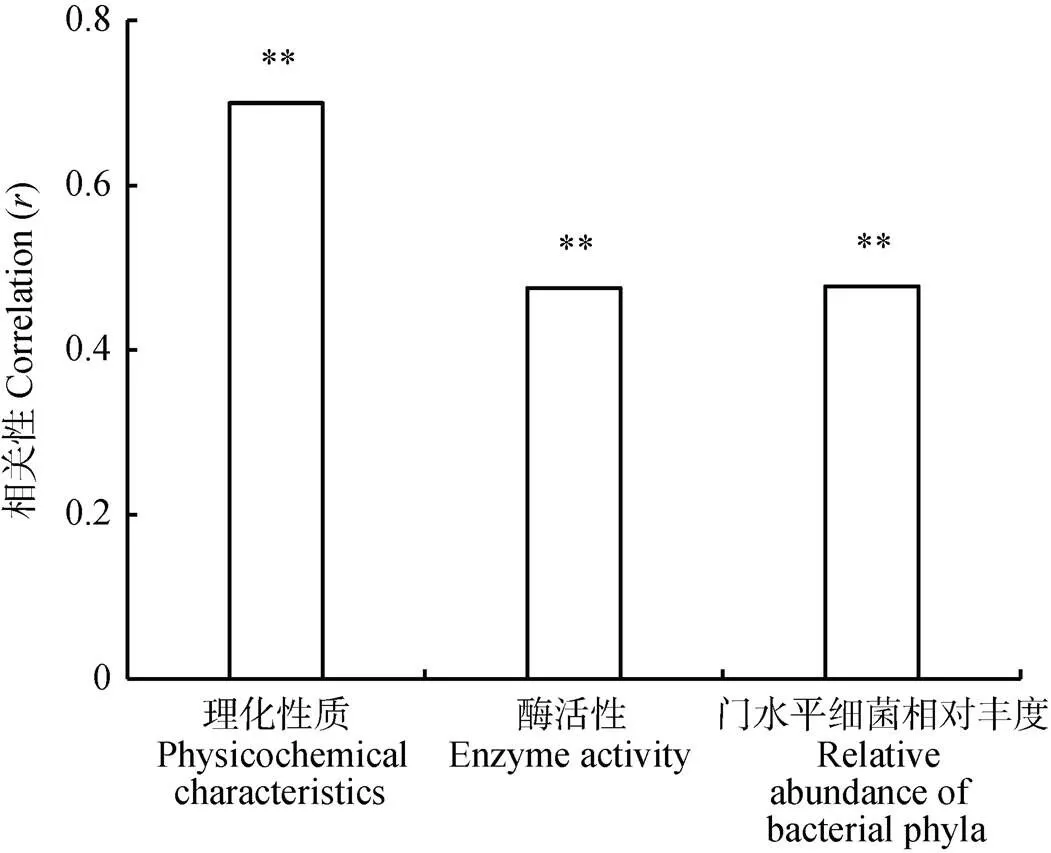
图2 连作植烟土壤酚酸类物质与环境因子相关性
**表示在0.01水平显著相关。** indicates significant correlation at 0.01 level.
2.2.2 各酚酸类物质与土壤主要环境因子的Mantel Test结果比较
分别将各种酚酸类物质作为一个矩阵, 依次与土壤理化性状、酶活性和细菌丰度做Mantel Test, 可以得出各酚酸类物质分别与三者的相关性。结果表明, 除苯甲酸外, 其余酚酸类物质与土壤主要环境因子之间的相关性均达到极显著水平。其中, 与土壤理化性状相关性最高的前4位酚酸类物质依次为对羟基苯甲酸、肉桂酸、间苯三酚、阔马酸; 与酶活性相关性最高的前4位依次为肉桂酸、阔马酸、对羟基苯甲酸和香兰素; 与细菌丰度相关性最高的前4位依次为阔马酸、对羟基苯甲酸、香草酸、香兰素。各酚酸类物质与土壤主要环境因子之间的相关性有一定的差异, 总体来看, 各酚酸类物质与土壤理化性状之间的相关性较高, 其次为细菌丰度(图3)。
2.2.3 受环境因子影响较大的酚酸类物质的确定
根据2.2.2结果, 分别取与理化性状、酶活性和细菌丰度相关性最高的前4种酚酸类物质做韦恩图, 发现与这三者相关性均较高的酚酸为对羟基苯甲酸和阔马酸(图4), 说明理化性状、酶活性和细菌丰度对对羟基苯甲酸和阔马酸含量的影响最大。
3 讨论
前人对茄子()[9]、大豆[10]、苹果()[41]和草莓()[42]的连作土壤研究表明, 酚酸类物质在连作土壤中积累并在某种程度上导致了连作障碍的发生。此类研究在植烟土壤中涉及较少, 大都以植烟土壤浸提液为研究对象, 证明土壤浸提液中具有自毒物质, 但未明确自毒物质的种类和含量[21-22]。本试验在前人研究的基础上, 利用高效液相色谱法在不同连作年限植烟土壤中均检测出8种酚酸类物质, 分别为间苯三酚、阔马酸、对羟基苯甲酸、香草酸、香兰素、阿魏酸、苯甲酸和肉桂酸。随连作年限增加, 间苯三酚含量依次显著升高; 阔马酸和阿魏酸含量在连作小于8 a时积累并不明显, 但连作达到14 a后则表现出显著的积累趋势; 除连作8 a处理外, 对羟基苯甲酸和香草酸含量随连作年限增加依次呈显著积累趋势。总体而言, 长期连作导致植烟土壤间苯三酚、阔马酸、对羟基苯甲酸、香草酸、香兰素和阿魏酸含量出现富集效应, 且连作年限越长富集效应越明显, 这可能是长期的连作降低了微生物对这类酚酸的降解能力导致的。苯甲酸和肉桂酸含量随连作年限增加呈先升高后降低趋势, 且峰值出现在连作8 a处理, 原因可能是连作初期导致苯甲酸和肉桂酸积累, 而后长期的连作改变了微生物群落结构, 使降解这两种物质的菌群增加。结合植烟土壤酚酸类物质总含量变化趋势并综合分析各酚酸类物质含量变化情况可知, 长期连作导致植烟土壤酚酸物质积累, 进一步验证了酚酸类物质在连作障碍中扮演重要角色。
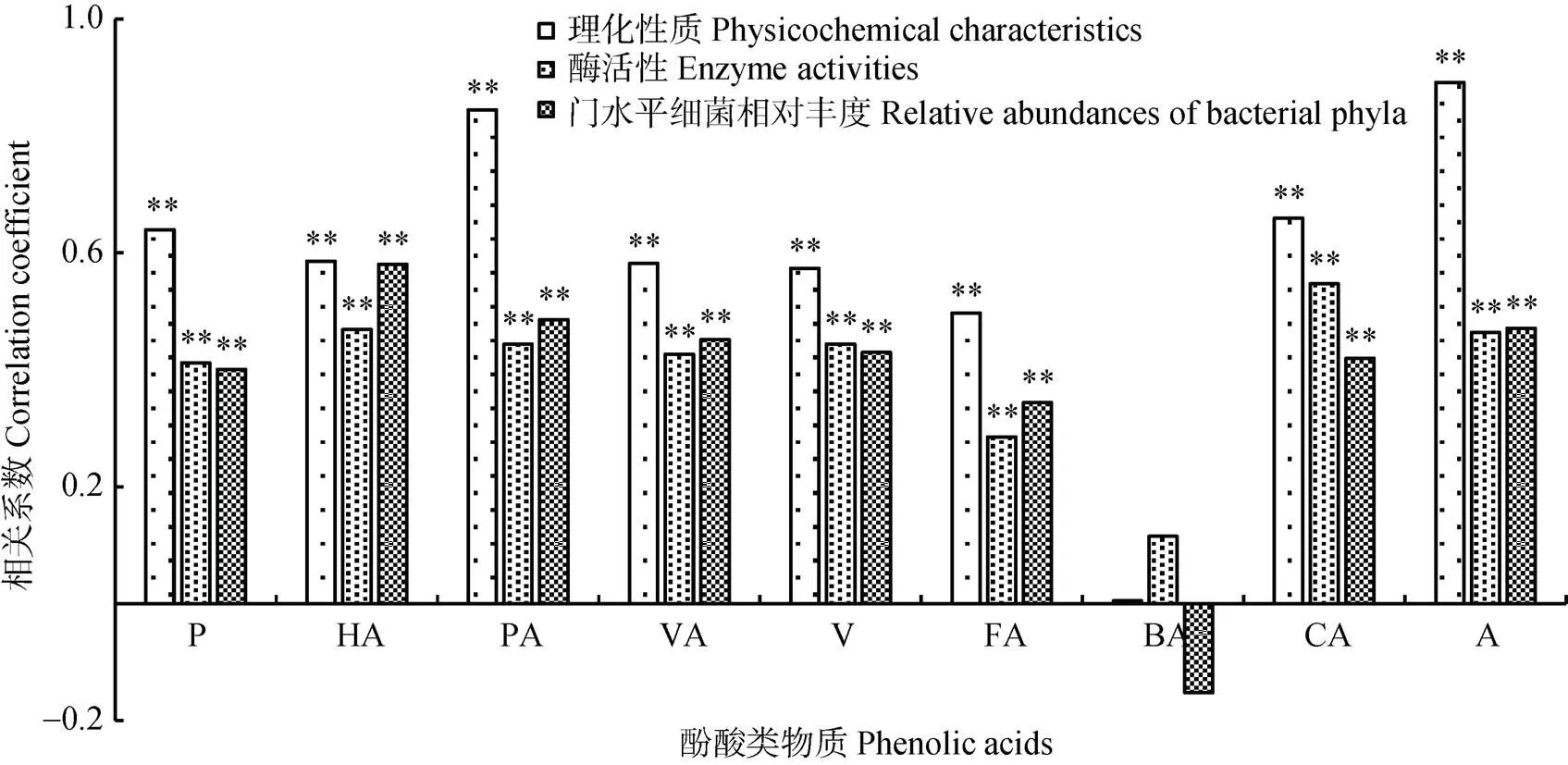
图3 基于Mantel Test的连作植烟土壤酚酸类物质与土壤环境因子相关性
**表示在0.01水平显著相关。P: 间苯三酚; HA: 阔马酸; PA: 对羟基苯甲酸; VA: 香草酸; V: 香兰素; FA: 阿魏酸; BA: 苯甲酸; CA: 肉桂酸; A: 总量。** indicates significant correlation at 0.01 level.P: phloroglucinol; HA: caramelic acid; PA: p-hydroxybenzoic acid; VA: vanillic acid; V: vanillin; FA: ferulic acid; BA: benzoic acid; CA: cinnamic acid; A: total amount.
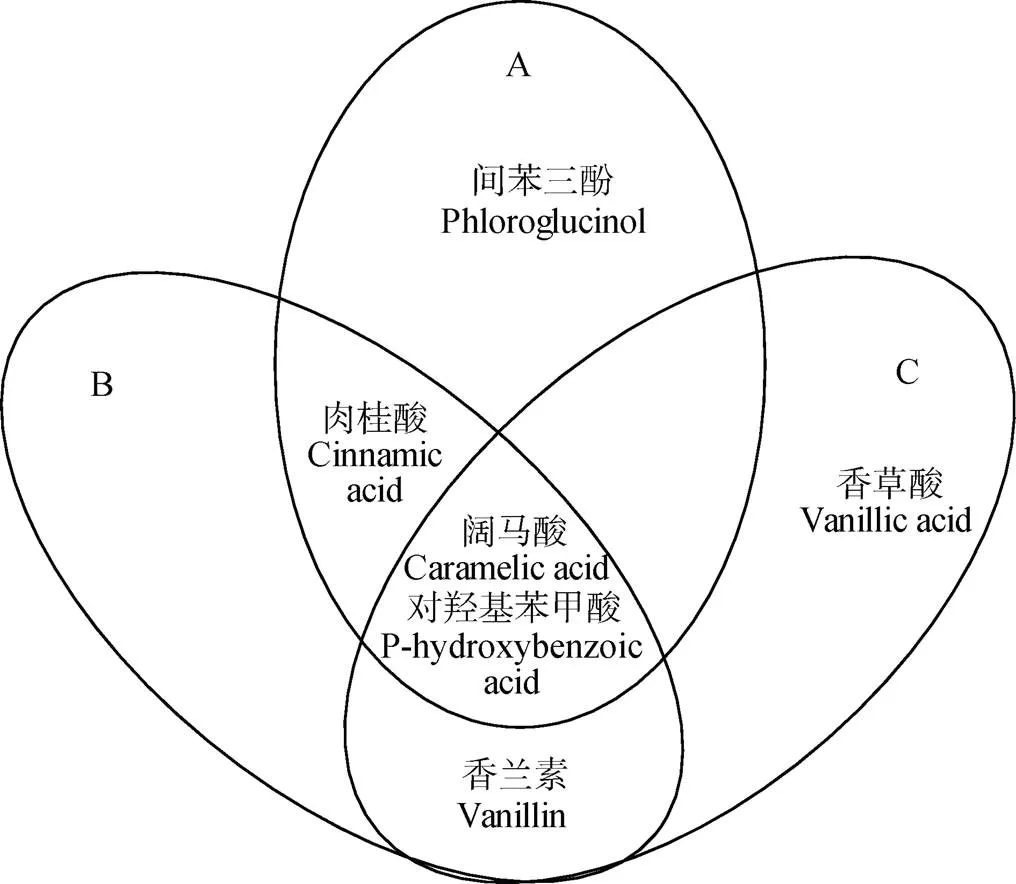
图4 连作植烟土壤中与土壤环境因子相关性最高的前4种酚酸类物质的韦恩图
A: 理化性状; B: 酶活性; C: 细菌门水平相对丰度。A: soil physic-chemical properties; B: soil enzyme activity; C: relative abundances of bacterial phyla.
连作导致土壤酶活性变化、理化性状恶变和细菌群落结构以及多样性改变[3-7], 本研究也得出相似结论。随连作年限增加, 4种酶活性的变化趋势均为先升高后降低, 且酶活性峰值出现在不同年限, 原因可能是由于连作未达到酶活性峰值年限时, 表层土壤中烟株和根系残留物逐年积累, 为酶提供了足够的底物, 酶活性升高, 连作超过酶活性峰值年限后, 土壤中病菌和有毒物质等的积累, 导致酶活性降低。综合以上分析可知, 长期的连作导致土壤酶活性先升高后降低。目前普遍认为, 土壤理化性状的改变是导致作物连作障碍发生的主要原因之一[3]。本研究中, 随烤烟连作年限增加, 植烟土壤pH呈显著下降趋势, 表明连作导致植烟土壤酸化, 酸化的土壤为病原菌提供了滋生条件, 形成了连作障碍发生的一个因子; 除连作16 a处理外, 水解性氮和有效磷含量随连作年限增加呈下降趋势; 随连作年限增加, 土壤有机质含量呈降低趋势而速效钾含量呈升高趋势, 土壤钾含量激增可能是烤烟为喜钾作物, 在生产上人为追加了过量的硫酸钾导致的, 过量的K+又与Ca2+、Mg2+等阳离子交换, 进一步导致土壤板结, 使有机质含量下降, 进而加剧了连作障碍的发生。本研究表明, 连作6 a以下的植烟土壤优势菌群相似, 主要分布在变形菌门、拟杆菌门和放线菌门, 连作8 a后的细菌群落组成则差异较大, 除变形菌门外, 其余优势菌群则不尽相同, 且不同菌门的丰度在不同处理间下降或升高的趋势也有一定的差异, 表明短期连作(6 a以下)对植烟土壤细菌群落结构影响不是很大, 但连作达到一定年限时(8 a以上)细菌群落结构则发生剧变; 从Alpha多样性指数上来看, 连作4 a、6 a和8 a处理的Shannon 指数和Simpson变化不明显, 而连作14 a和16 a处理则显著下降, 表明长期连作导致细菌丰富度明显降低, 对于ACE指数和Chao1指数而言, 随连作年限增加呈显著下降趋势, 表明连作导致植烟土壤细菌多样性降低。以上结果表明, 细菌群落结构、菌群丰度和多样性的改变也是造成连作障碍的原因之一。总体而言, 长期连作导致植烟土壤酶活性发生变化、土壤酸化、养分失衡和细菌群落结构发生变化以及菌群丰度和多样性降低。
前人研究表明, 酚酸类物质与土壤理化性状之间具有显著相关关系[43], 而土壤酶活性与土壤养分之间互相影响[44], 可以推测酚酸物质与酶活性之间具有一定的相关关系; 酚酸物质可以为土壤微生物提供碳、氮源, 因此, 土壤中微生物的数量和种类直接影响着土壤酚酸的含量[45]。综合以上分析可以推测, 植烟土壤酚酸物质的含量受理化性状、酶活性和细菌多样性的影响, 但由于研究方法和手段的限制, 前人并未对4者的相关关系进行探讨[21-22]。本研究通过Mantel Test方法明确植烟土壤酚酸类物质与理化性状、酶活性和细菌丰度的相关关系, 研究结果对进一步明确酚酸类物质在连作土壤中的积累特征以及与环境因子的关系具有重要作用, 同时对今后开展酚酸类物质与环境因子的相互作用研究也提供了一定的理论依据。从分析结果来看, 理化性状、酶活性和细菌丰度与酚酸类物质的相关性均为极显著, 其中土壤理化性状与酚酸类物质相关性最高, 其次为细菌丰度, 酶活性相关性最低, 说明植烟土壤中酚酸类物质含量受这3者影响, 且理化性质影响较大, 表明土壤理化性状、酶活性和细菌多样性的改变可能是导致酚酸类物质积累的原因之一。从单个酚酸与环境因子的Mantel Test结果上来看, 除苯甲酸外, 各酚酸类物质与土壤主要环境因子之间均具极显著相关关系, 其中理化性状与对羟基苯甲酸、肉桂酸、间苯三酚和阔马酸的相关性较高; 酶活性与肉桂酸、阔马酸、对羟基苯甲酸和香兰素相关性较高; 细菌丰度与阔马酸、对羟基苯甲酸、香草酸和香兰素相关性较高。综合以上分析并结合韦恩图可知, 3种土壤环境因子均与对羟基苯甲酸和阔马酸的相关性较高, 说明这两种酚酸含量受土壤环境因子影响较大, 因此, 在今后对酚酸类物质的研究中, 可侧重对对羟基苯甲酸和阔马酸的研究。以上结果从统计分析的角度阐述了酚酸类物质与酶活性、理化性状和细菌多样性之间的相关关系, 为通过外源添加酚酸等方式进一步验证土壤各环境因子对其的影响提供了一定的理论依据, 丰富了酚酸类物质在烤烟连作障碍中的作用机制。
4 结论
1)连作导致植烟土壤酚酸类物质积累, 土壤酸化和养分失衡, 酶活性先升高后降低, 细菌群落结构改变以及菌群丰度和多样性降低。
2)Mantel Test分析表明, 植烟土壤理化性状、酶活性和细菌丰度与酚酸类物质具有极显著相关性, 且理化性状相关性最高。
3)相对于其他酚酸类物质而言, 植烟土壤理化性状、酶活性和细菌丰度对对羟基苯甲酸和阔马酸的影响最大。
[1] 张继光, 姚忠达, 张忠锋, 等. 皖南地区不同烤烟种植模式的土壤环境及经济效益分析[J]. 土壤, 2016, 48(3): 553–558 ZHANG J G, YAO Z D, ZHANG Z F, et al. Effects of different tobacco planting patterns on soil environment and economic benefits in South Anhui Province[J]. Soil, 2016, 48(3): 553–558
[2] 张继光, 申国明, 张久权, 等. 烟草连作障碍研究进展[J]. 中国烟草科学, 2011, 32(3): 95–99 ZHANG J G, SHEN G M, ZHANG J Q, et al. Advance in continuous cropping problems of tobacco[J]. Chinese Tobacco Science, 2011, 32(3): 95–99
[3] 康亚龙, 景峰, 孙文庆, 等. 加工番茄连作对土壤理化性状及微生物量的影响[J]. 土壤学报, 2016, 53(2): 533–542 KANG Y L, JING F, SUN W Q, et al. Effects of continuous cropping of processing tomato on physical-chemical properties of and microbial biomass in the soil[J]. Acta Pedologica Sinica, 2016, 53(2): 533–542
[4] 妙佳源, 李夏, 周达, 等. 连作对谷子土壤酶活性及养分的影响[J]. 干旱地区农业研究, 2016, 34(3): 123–126 MIAO J Y, LI X, ZHOU D, et al. Effects offoxtail millet continuous cropping on soil enzyme activities and nutrients[J]. Agricultural Research in the Arid Areas, 2016, 34(3): 123–126
[5] 宋旭红, 谭均, 潘媛, 等. 连作对玄参产量和根际土壤肥力及酶活性的影响[J].中药材, 2017, 40(6): 1243–1248 SONG X H, TAN J, PAN Y, et al. Effect of continuous monoculture ofon yield, rhizophere soil fertility and enzyme activities[J]. Journal of Chinese Medicinal Materials, 2017, 40(6): 1243–1248
[6] TAN Y, CUI Y S, LI H Y, et al. Diversity and composition of rhizospheric soil and root endogenous bacteria induring continuous cropping practices[J]. Journal of Basic Microbiology, 2017, 57(4): 337–344
[7] 王娟英, 许佳慧, 吴林坤, 等. 不同连作年限怀牛膝根际土壤理化性质及微生物多样性[J]. 生态学报, 2017, 37(17): 5621–5629 WANG J Y, XU J H, WU L K, et al. Analysis of physicochemical properties and microbial diversity in rhizosphere soil ofunder different cropping years[J]. Acta Ecologica Sinica, 2017, 37(17): 5621–5629
[8] BHAT R G, SCHMIDT L S, BROWNE G T. Quantification ofsp. in roots of almond and peach trees from orchards affected byreplant disease[J]. Phytopathology, 2011, 101: S15
[9] CHEN S L, ZHOU B L, LIN S S, et al. Accumulation of cinnamic acid and vanillin in eggplant root exudates and the relationship with continuous cropping obstacle[J]. African Journal of Biotechnology, 2011, 10(14): 2659–2665
[10] XIAO C L, ZHENG J H, ZOU L Y, et al. Autotoxic effects of root exudates of soybean[J]. Allelopathy Journal, 2006, 18(1): 121–127
[11] VÁZQUEZ G, FONTENLA E, SANTOS J, et al. Antioxidant activity and phenolic content of chestnut () shell and eucalyptus () bark extracts[J]. Industrial Crops and Products, 2008, 28(3): 279–285
[12] YU J Q, MATSUI Y. Effects of root exudates of cucumber () and allelochemicals on ion uptake by cucumber seedlings[J]. Journal of Chemical Ecology, 1997, 23(3): 817–827
[13] YE S F, YU J Q, PENG Y H, et al. Incidence of Fusarium wilt inL. is promoted by cinnamic acid, an autotoxin in root exudates[J]. Plant and Soil, 2004, 263(1): 143–150
[14] SCHUTTER M, SANDENO J, DICK R. Seasonal, soil type, and alternative management influences on microbial communities of vegetable cropping systems[J]. Biology and Fertility of Soils, 2001, 34(6): 397–410
[15] ZHANG S S, JIN Y L, ZHU W J, et al. Baicalin released frominduces autotoxicity and promotes soilborn pathogens[J]. Journal of Chemical Ecology, 2010, 36(3): 329–338
[16] ZHOU X G, WU F Z.-acid influenced cucumber rhizosphere soil microbial communities and the growth off.sp.Owen[J]. PLoS One, 2012, 7(10): e48288
[17] ZHOU X G, JIA H T, GE X, et al. Effects of vanillin on the community structures and abundances ofandspp. in cucumber seedling rhizosphere[J]. Journal of Plant Interactions, 2018, 13(1): 45–50
[18] LIU P, LIU Z H, WANG C B, et al. Effects of three long-chain fatty acids present in peanut (L.) root exudates on its own growth and the soil enzymes activities[J]. Allelopathy Journal, 2012, 29(1): 13–24
[19] LIU P, WAN S B, JIANG L H, et al. Autotoxic potential of root exudates of peanut (L.)[J]. Allelopathy Journal, 2010, 26(2): 197–206
[20] QU X H, WANG J G. Effect of amendments with different phenolic acids on soil microbial biomass, activity, and community diversity[J]. Applied Soil Ecology, 2008, 39(2): 172–179
[21] 柯文辉. 烟草连作障碍的根际微生态研究[D]. 福州: 福建农林大学, 2009 KE W H. Studies on rhizospheric microecology of continuous tobacco cropping obstacle[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009
[22] 符建国, 易建华, 贾志红, 等. 轮作与连作烟田根际土壤酸性有机组分的初步分离与鉴定[J].中国烟草科学, 2011, 32(6): 67–71 FU J G, YI J H, JIA Z H, et al. Initial isolation and identification of acidic component of organic compounds in rhizospheric soils of flue-cured tobacco with rotation and mono-cropping[J]. Chinese Tobacco Science, 2011, 32(6): 67–71
[23] 石秋环, 焦枫, 耿伟, 等. 烤烟连作土壤环境中的障碍因子研究综述[J]. 中国烟草学报, 2009, 15(6): 81–84 SHI Q H, JIAO F, GENG W, et al. An overview on research into factors hindering continuous cropping in flue-cured tobacco[J]. Acta Tabacaria Sinica, 2009, 15(6): 81–84
[24] YU J Q, SHOU S Y, QIAN Y R, et al. Autotoxic potential of cucurbit crops[J]. Plant and Soil, 2000, 223(1/2): 149–153
[25] 宋慧. 小豆连作障碍中自毒机理研究[D].杨凌: 西北农林科技大学, 2013 SONG H. Autointoxication in adzuki bean replant disease[D]. Yangling: Northwest A&F University, 2013
[26] 邵财. 人参连作障碍化感作用研究[D].长春: 中国农业科学院, 2009 SHAO C. Study on allelopathy in continuous cropping obstacle of[D]. Changchun: Chinese Academy of Agricultural Sciences, 2009
[27] MANTEL N. The detection of disease clustering and a generalized regression approach[J]. Cancer Research, 1967, 27(2): 209–220
[28] 覃光莲, 谭劲英. Mantel方法在生态学中的应用[J]. 生物数学学报, 2014, (3): 507–512 QIN G L, TAN J Y. Mantel test and its applications in ecology[J]. Journal of Biomathematics, 2014, (3): 507–512
[29] 王强, 戴九兰, 付合才, 等. 空间分析方法在微生物生态学研究中的应用[J].生态学报, 2010, 30(2): 439–446 WANG Q, DAI J L, FU H C, et al. The application of spatial analysis methods to microbial ecology[J]. Acta Ecologica Sinica, 2010, 30(2): 439–446
[30] SCHAPPE T, ALBORNOZ F E, TURNER B L, et al. The role of soil chemistry and plant neighbourhoods in structuring fungal communities in three Panamanian rainforests[J]. Journal of Ecology, 2017, 105(3): 569–579
[31] XIONG W, LI Z G, LIU H J, et al. The effect of long-term continuous cropping of black pepper on soil bacterial communities as determined by 454 pyrosequencing[J]. PLoS One, 2015, 10(8): e0136946
[32] 梅守荣. 土壤酶活性及其测定[J]. 上海农业科技, 1985, (1): 17–18MEI S R. Soil enzyme activity and its determination[J]. Shanghai Agricultural Science and Technology, 1985, (1): 17–18
[33] MAGOČ T, SALZBERG S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957–2963
[34] BOKULICH N A, SUBRAMANIAN S, FAITH J J, et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods, 2013, 10(1): 57–59
[35] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335–336
[36] EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194–2200
[37] HAAS B J, GEVERS D, EARL A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research, 2011, 21(3): 494–504
[38] EDGAR R C. UPARSE: Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996–998
[39] ALTSCHUL S F, GISH W, MILLER W, et al. Basic local alignment search tool[J]. Journal of Molecular Biology, 1990, 215(3): 403–410
[40] KÕLJALG U, NILSSON R H, ABARENKOV K, et al. Towards a unified paradigm for sequence-based identification of fungi[J]. Molecular Ecology, 2013, 22(21): 5271–5277
[41] 孙海兵, 毛志泉, 朱树华. 环渤海湾地区连作苹果园土壤中酚酸类物质变化[J].生态学报, 2011, 31(1): 90–97 SUN H B, MAO Z Q, ZHU S H. Changes of phenolic acids in the soil of replanted apple orchards surrounding Bohai Gulf[J]. Acta Ecologica Sinica, 2011, 31(1): 90–97
[42] 李贺勤, 刘奇志, 张林林, 等. 草莓连作土壤酚酸类物质积累对土壤线虫的影响[J].生态学杂志, 2014, 33(1): 169–175 LI H Q, LIU Q Z, ZHANG L L, et al. Accumulation of phenolic acids in the monocultured strawberry soils and their effect on soil nematodes[J]. Chinese Journal of Ecology, 2014, 33(1): 169–175
[43] 李亮亮, 李天来, 张恩平, 等. 四种酚酸物质在土壤中降解的研究[J].土壤通报, 2010, 41(6): 1460–1465 LI L L, LI T L, ZHANG E P, et al. Experimental study on degradation of four phenolic acids in soil[J]. Chinese Journal of Soil Science, 2010, 41(6): 1460–1465
[44] 巩庆利, 翟丙年, 郑伟, 等. 渭北旱地苹果园生草覆盖下不同肥料配施对土壤养分和酶活性的影响[J]. 应用生态学报, 2018, 29(1): 205–212 GONG Q L, ZHAI B N, ZHENG W, et al. Effects of grass cover combined with different fertilization regimes on soil nutrients and enzyme activities in apple orchard in Weibei dryland, China[J]. Chinese Journal of Applied Ecology, 2018, 29(1): 205–212
[45] LI X G, DING C F, HUA K, et al. Soil sickness of peanuts is attributable to modifications in soil microbes induced by peanut root exudates rather than to direct allelopathy[J]. Soil Biology and Biochemistry, 2014, 78: 149–159
Correlation analysis of main environmental factors and phenolic acids in continuous tobacco cropping soils using Mantel Test*
BAI Yuxiang1, YANG Chengcui1, SHI Puyou1, JIA Meng1, YANG Huanwen1, XU Zhaoli2, WANG Ge1**
(1. College of Tobacco Science, Yunnan Agricultural University, Kunming 650201, China; 2. Yunnan Academy of Tobacco Science, Kunming 650021, China)
Flue-cured tobacco is a crop sensitive to continuous cropping. Continuous cropping over the long-term has seriously affected growth and production quality of flue-cured tobacco by affecting the soil environment. Phenolic acids can cause growth disorders under continuous cropping. Although the interaction between phenolic acids and other environmental factors after entering the soil environment has not much been investigated, it is clear that phenolic acids occur in soils under continuous tobacco cropping. The action process and the role in limiting continuous cropping are critical for successful tobacco cultivation. An experiment was conducted to determine the relationship between phenolic acids and soil environmental factors in the soil by analyzing the correlation between various environmental factors and phenolic acids in soil. The purpose was to identify the environmental factors affecting the concentration of phenolic acids in soils under continuous cropping systems. Soils of four tobacco fields with different durations of continuous cropping (4 a, 6 a, 8 a, 14 a and 16 a) were sampled. The changes in phenolic acids, physical and chemical properties, enzyme activities and bacterial diversities in soils under different continuous cropping years of tobacco were investigaed. The correlation between phenolic acids and soil environmental factors was analyzed using the Mantel Test. The results showed that long-term continuous cropping of tobacco resulted in an increase in soil phenolic acids content. Higher pH of soil under tobacco continuous cropping resulted in low soil organic matter content, but increased available potassium. The activities of catalase, urease acid phosphatase, and invertase first increased and then later decreased. When continuous cropping for less than 6 years, bacterial community structure changed little. However, bacterial community structure changed significantly after 8 years of continuous cropping. In general, continuous cropping changed bacterial community structure and reduced community diversity. Mantel Test analysis showed that phenolic acid content was significantly correlated with enzymes activities and physical and chemical properties of soil. Bacterial abundance had the highest correlation with soil physical and chemical properties. There were differences in correlation between different phenolic acids and soil environmental factors. P-hydroxybenzoic acid and phoronic acid had the highest correlation with physical and chemical properties of soil, enzyme activity and bacterial abundance in soils. Therefore, phenolic acids in soils under continuous tobacco cropping obviously accumulated over time with deteriorated soil environment. The accumulation of phenolic acids was affected by soil physical, chemical and biological properties of soil. P-hydroxybenzoic acid and tartaric acid were two kind phenolic acids most affected.
Flue-cured tobacco;Continuous cropping; Phenolic acid; Soil environmental factor; Mantel Test
, E-mail: wangge302@126.com
Jul. 27, 2018;
Oct. 15, 2018
S572; S154.1
A
2096-6237(2019)03-0369-11
10.13930/j.cnki.cjea.180703
白羽祥, 杨成翠, 史普酉, 贾孟, 杨焕文, 徐照丽, 王戈. 连作植烟土壤酚酸类物质变化特征及其与主要环境因子的Mantel Test分析[J]. 中国生态农业学报(中英文), 2019, 27(3): 369-379
BAI Y X, YANG C C, SHI P Y, JIA M, YANG H W, XU Z L, WANG G. Correlation analysis of main environmental factors and phenolic acids in continuous tobacco cropping soils using Mantel Test[J]. Chinese Journal of Eco-Agriculture, 2019, 27(3): 369-379
* 国家自然科学基金项目(31860357)、云南省应用基础研究计划项目(2015FB145)、云南省研究生学术新人奖(A2008057)和云南烟用有机肥养分资源利用研究(2017YN07)资助
王戈, 主要从事烟草栽培生理生化研究。E-mail: wangge302@126.com
白羽祥, 主要从事烟草生理生化研究。E-mail: cotsbyx@163.com
2018-07-27
2018-10-15
* This study was supported by the National Natural Science Foundation of China (31860357), the Applied Basic Research Project of Yunnan Province (2015FB145), the Graduate Scholar Newcomer Award of Yunnan Province (A2008057) and the Study on Utilization of Organic Fertilizer of Tobacco in Yunnan Province (2017YN07).
