鸡Toll样受体15的生物信息学分析及组织表达
2019-03-08邢波建李连艳刘玉芬
邢波建,于 淼,吴 迪,徐 笑,李连艳,刘玉芬
(哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150025)
Toll样受体(Toll-like receptors, TLRs)是一类Ⅰ型跨膜糖蛋白模式识别受体,能够通过识别保守的病原相关分子模式(Pathogen-associated molecular patterns, PAMPs)参与机体的天然免疫过程。TLRs分布十分广泛,在20多种细胞中均可检测到其存在信号,主要分布于单核-巨噬细胞、NK细胞、T细胞等免疫细胞中[1]。TLRs可以激活相关信号分子,同时也可以引起胞内炎性介质的转录和表达,进而激活非特异性和特异性免疫,共同清除抗原异物[2]。
近年来,有大量研究显示[3-5],TLRs与各种细菌感染导致的疾病发生有着密不可分的关系,这些研究对细菌感染的机制及疾病的预防、诊断和治疗具有重要意义。迄今为止,已在人体中发现11种TLRs,即TLR1~TLR10和TLR14,在动物体内发现15种TLRs[6-7],其中小鼠可表达TLR11~TLR13,但不表达TLR10。以往认为,TLR15为禽类所特有[8-9],但最新研究证实,在钉螺中也存在TLR15,其生物学功能是否与禽类的TLR15相同,目前尚不清楚[10]。
chTLR15作为鸡体内的一种天然免疫分子,在如何参与免疫应答、保护机体方面已经具有了一定的研究基础[11],但是对于不同品种鸡该因子详细的生物信息学分析和组织表达谱尚不够丰富。因此,本研究通过克隆海兰褐鸡TLR15全长基因,获得生物信息学特征,并对其胞外区进行原核表达,制备相应的多克隆抗体,检测TLR15在鸡体内的分布规律,旨在为进一步研究禽类TLR相关的免疫调节机制提供基础材料。
1 材料和方法
1.1 试验动物、菌种、质粒和试剂
海兰褐鸡购自哈尔滨市松北区兴旺养殖场;成年昆明鼠购自中国农业科学院哈尔滨兽医研究所实验动物中心。
大肠杆菌DH5α、BL21(DE3)、pGM-T载体均购自天根生化科技(北京)有限公司;pET32a表达载体由哈尔滨师范大学生物化学与分子生物学实验室保存。KpnⅠ、Hind Ⅲ和T4DNA连接酶购自全式金(TRANS)生物有限公司;鼠抗His标签单克隆抗体、HRP-羊抗鼠IgG二抗和DAB显色试剂盒购自博奥森生物技术(北京)有限公司;其他试剂为进口或者国产分析纯。
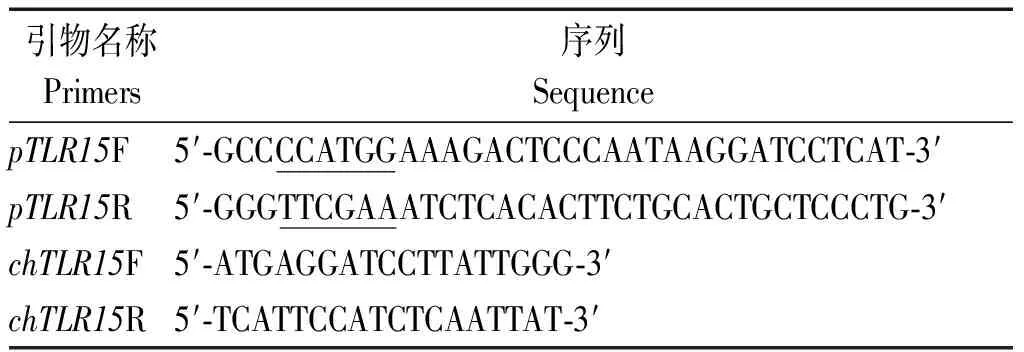
表1 chTLR15引物序列Tab.1 Primer pairs of chTLR15
注:pTLR15扩增序列为胞外区;chTLR15扩增区域为跨膜区和胞内区。
Note:The amplified sequence ofpTLR15 is extracellular region;The region ofchTLR15 amplification was transmembrane and intracellular.
1.2 引物设计
根据GenBank上已发表的三黄鸡chTLR15(登录号:JN112024.1)序列,利用Primer 5.0和Primer-Blast (https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计第1对特异性引物,用于扩增chTLR15的胞外区,分别在上游引物和下游引物引入KpnⅠ和Hind Ⅲ酶切位点。同时设计第2对引物,用于扩增跨膜区和胞内区序列(表1)。
1.3 chTLR15基因的RT-PCR扩增
从鸡脾脏中提取总RNA,依据TRIzol LS plus RNA Extraction Kit说明书进行操作,获得完整的RNA样品,再按照 Golden 1stcDNA Synthesis Kit(with gDNA Remover)说明书进行反转录操作,37 ℃孵育10 min去除gDNA,55 ℃孵育1 h后,85 ℃再孵育10 min,得到完整的cDNA。依照SuperTaqDNA Polymerase说明书进行PCR反应体系的配置,反应条件为94 ℃预变性5 min;94 ℃变性30 s,55~60 ℃退火30 s,72 ℃延伸3 min,72 ℃终延伸10 min。获得的PCR产物进行纯化回收后,委托博仕(哈尔滨)生物技术有限公司进行序列测定,获得序列后将进行全序列拼接。
1.4 chTLR15基因的生物信息学分析
使用Blast (basic local alignment search tool, http://blast.ncbi.nlm.nih.gov/Blast.cgi)对NCBI (National Center for Biotechnology Information, http://blast.ncbi.nlm.nih.gov/)上与海兰褐TLR15同源的数据进行分析;采用SMART (simple modular architecture research tool, http://smart.embl-heidelberg.de/)对蛋白质的结构域进行预测;SWISS-MODEL (http://www.swissmodel.expasy.org/)对蛋白质的三级结构进行预测,并利用MEGA 7.0以及DNAMAN 6.0,对核苷酸序列进行建树分析。
1.5 chTLR15胞外区原核表达载体的构建
以KpnⅠ和Hind Ⅲ分别双酶切胞外区PCR产物和pET32a载体,回收目的片段,以T4DNA连接酶构建重组表达载体pET32a-TLR15ER,转化大肠杆菌DH5α后进行鉴定,然后再转化BL21(DE3)感受态菌,提取质粒,进行酶切和测序鉴定出阳性菌株。
1.6 重组蛋白的诱导表达、检测及多克隆抗体的制备
将阳性菌株接种于2 mL LB培养基(Amp+, 100 μg/mL)中,37 ℃振荡培养过夜。取上述菌液以1/100的比例接种于50 mL新鲜的LB液体培养基(Amp+, 100 μg/mL)中,37 ℃摇床培养至OD600值达0.3~0.5,在超净工作台中取出1 mL菌液作为诱导前对照,在剩余菌液中加入IPTG至终浓度为0.5 mmol/L,37 ℃诱导,每隔1 h收集菌体,离心收获细菌沉淀。将收集的菌体用10 mmol/L的PBS (pH值8.0)悬浮进行超声破碎、蛋白纯化,进行SDS-PAGE分析,再转印到NC膜上,5%的脱脂奶封闭后,加入鼠抗His单克隆抗体孵育,PBS清洗后加入1∶4 000稀释的HRP-羊抗鼠IgG孵育,DAB显色至条带清洗,完成对表达产物的Western Blot检测。纯化的蛋白与等体积的弗氏完全佐剂进行充分混合,按照每只50 μg的剂量采用皮下多点注射法免疫四周龄昆明成年小鼠,对照组注射等剂量0.9%生理盐水。14 d后,再进行2次加强免疫。加强免疫14 d后,眼眶采全血分离血清,采用ELISA方法测定抗体效价后,于-20 ℃分装保存。
1.7 chTLR15的免疫组织化学检测
采用石蜡包埋法对脾、肝、肺进行处理,以约5 μm厚度进行切片。脱蜡复水后用10%山羊血清进行封闭后加入一抗,37 ℃湿盒孵育20 min,之后滴加生物素化二抗工作液,37 ℃孵育40 min,洗涤后滴加辣根过氧化物酶标记链霉卵白素工作液(S-A/HRP),室温湿盒中孵育40 min,用DAB进行显色。苏木精复染、梯度脱水透明并树胶封片。
2 结果与分析
2.1 chTLR15基因的PCR扩增
以提取的鸡脾脏组织中总RNA为模板,根据GenBank上发表的chTLR15基因的序列设计2对引物,PCR反应后经1%琼脂糖凝胶电泳检测,均得到清晰的目的条带(图1-2),全部基因长度约为2 607 bp,其中,胞外区目的基因片段大小约为1 980 bp,与预期相符。

M.DNA Marker DL2000;1,2.chTLR15基因胞外区的扩增。M.DNA Marker DL2000;1,2.Amplification of extracellular domain of chTLR15 gene.
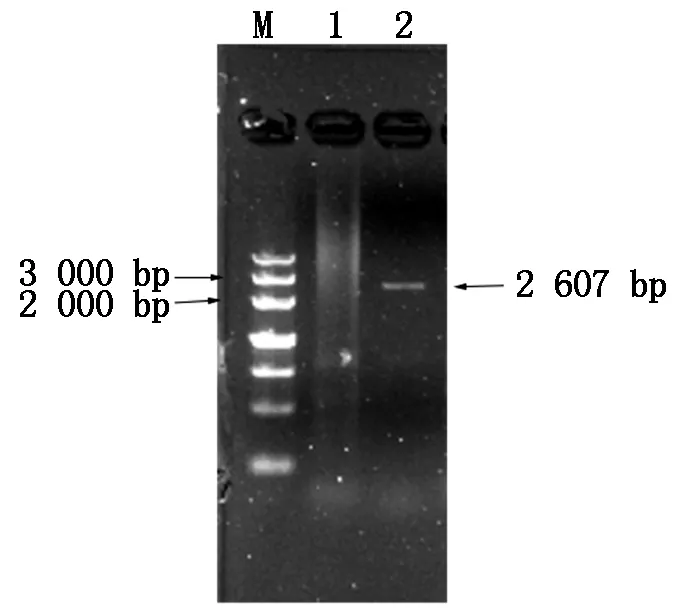
M.DNA Marker DL5000;1.阴性对照;2.chTLR15基因全长的RT-PCR产物。M.DNA Marker DL5000;1.Negative control;2.Full-length RT-PCR products of chTLR15 gene.
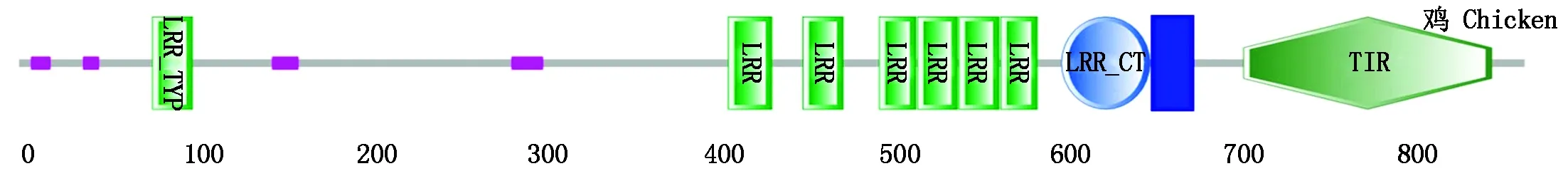
图3 chTLR15蛋白的结构域预测Fig.3 The prediction of chTLR15 domain structures
2.2 chTLR15基因的生物信息学分析
经序列拼接,获得的海兰褐鸡TLR15基因全长2 607 bp,编码868个氨基酸,其中,胞外区1 962 bp。该克隆序列已提交GenBank,登录号为:MH143572。使用SMART在线软件,模拟出chTLR15的功能区(图3)。chTLR15蛋白胞外区位于肽链的N端区,有1个典型亮氨酸富集亚家族区(Leucine-rich repeats, typical subfamily, LRR_TYP),6个明显的亮氨酸重复序列(Leucine-rich repeat, LRR),1个C端亮氨酸富集区(Leucine-rich repeat C-terminal domain, LRR_CT),1个跨膜结构区和胞内C端TIR结构域,符合TLR分子的典型结构特征[12]。应用SWISS-MODEL在线软件,模拟出chTLR15氨基酸的三级结构(图4),N端的胞外区呈现出2个马蹄形的折叠,中间的跨膜区由2个α螺旋组成,C端形成TIR结构域,通过三维模拟可以看出,该分子中α螺旋的含量较少,β折叠和β转角相对较多。
经DNAMAN 6.0的比对以及MEGA 7.0建立的核苷酸系统进化树分析发现(图5),与所选参考序列相比,三黄鸡和海兰褐鸡的同源性高达99.85%,仅有4处位点发生变化,分别是168,449,925和1 362位碱基发生变化,但氨基酸的序列没有变化;和草原松鸡略有差异,同源性为92.13%,和鸿雁差异较大同源性为84.77%,与白腰叉尾海燕、紫水鸡和其他物种差异较大。从图中可以发现,海兰褐鸡与家麻雀以及钉螺TLR15亲缘关系较远,序列差异也很大,与钉螺的核苷酸同源性是39.81%,氨基酸序列同源性仅有22.10%。
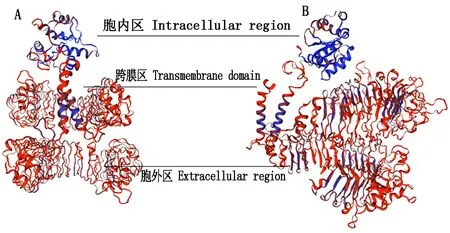
A图与B图是同一水平面,顺时针旋转90°。Figure A and Figure B are the same horizontal plane with clockwise rotation 90°.
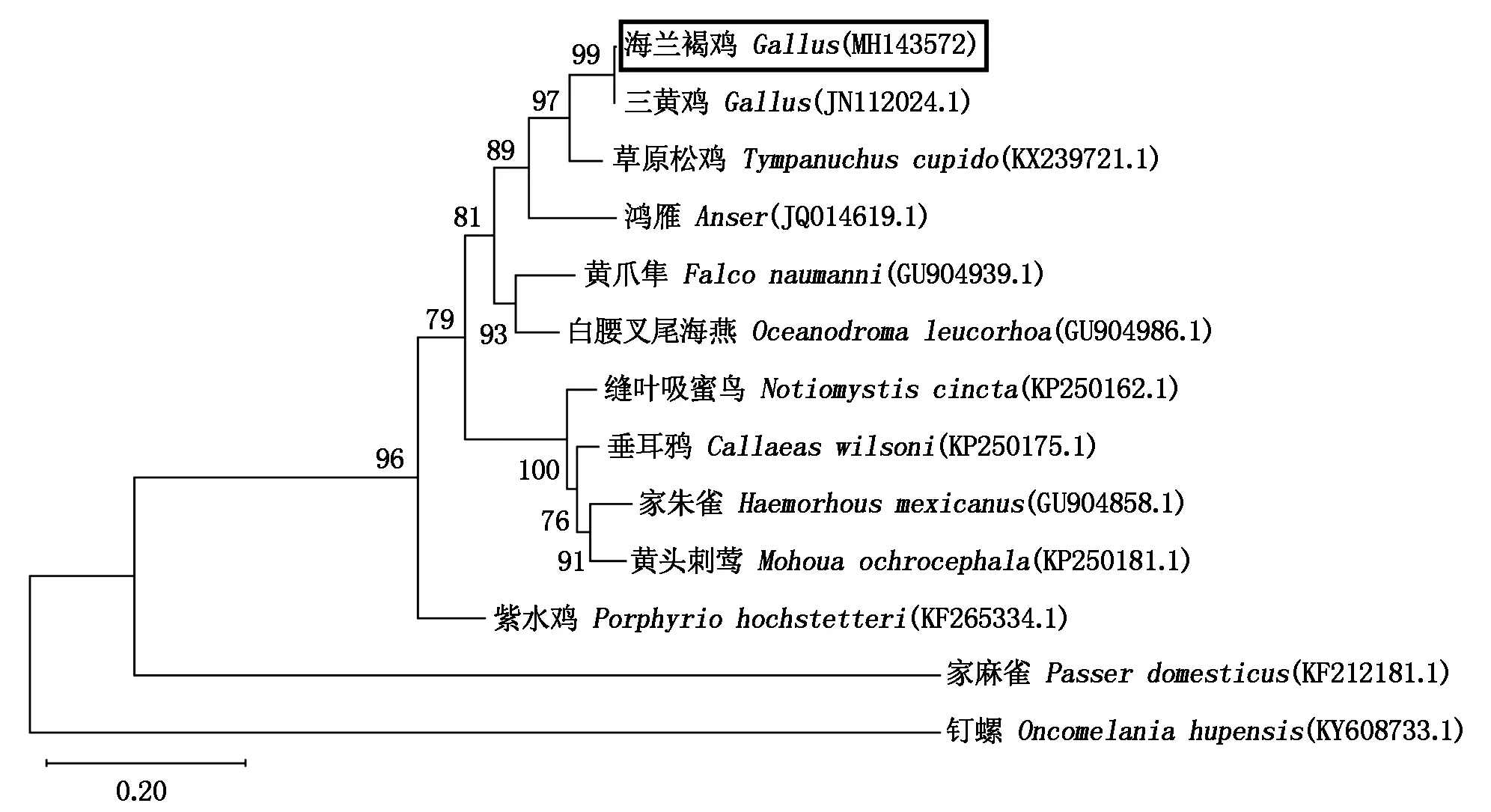
图5 基于不同物种TLR15的核苷酸序列进化树Fig.5 Phylogenetic tree based on the nucleotide sequences of TLR15 from different species
2.3 chTLR15胞外区重组表达载体的构建
以KpnⅠ和Hind Ⅲ分别双酶切胞外区PCR产物和pET32a表达载体,回收目的片段后连接。连接产物转化DH5α感受态细胞,进行双酶切鉴定和测序验证。琼脂糖凝胶电泳检测后,得到一条约5 900 bp的片段和一条约2 000 bp的片段,与预期片段大小相符(图6)。经最后测序表明,目的基因片段已经与表达载体相连接,并且正确插入到了表达载体的目的位点处,由此构建了重组表达质粒,命名为pET32a-TLR15ER。
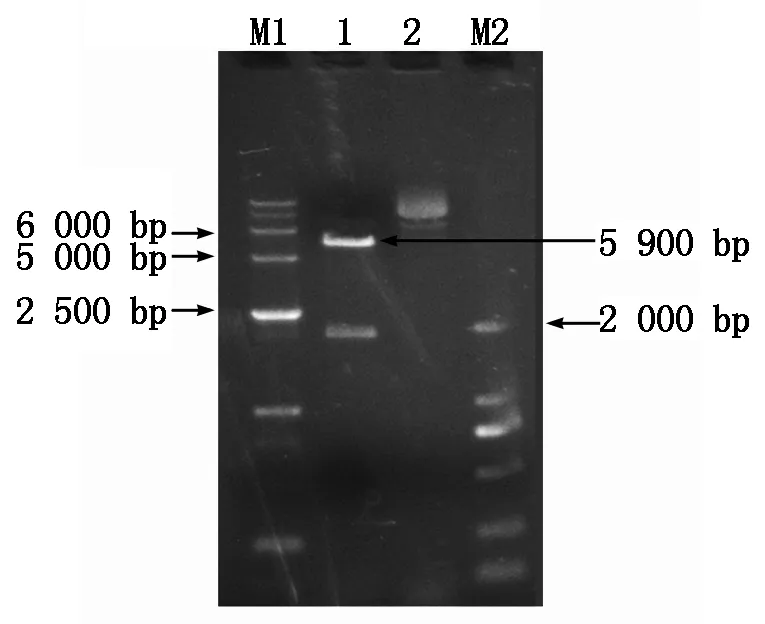
M1.DNA Marker DL15000;M2.DNA Marker DL2000;1.酶切产物;2.对照质粒。M1.DNA Marker DL15000;M2.DNA Marker DL2000;1.Enzyme-digested product;2.Control plasmid.
2.4 胞外区的诱导表达和多克隆抗体的制备
将重组质粒pET32a-TLR15ER转化大肠杆菌BL21(ED3)受体菌中,经过IPTG诱导后每隔1 h收集菌样,提取包涵体蛋白,进行SDS-PAGE电泳分析(图7),发现经IPTG诱导后,在5 h为最佳诱导条件,诱导菌在72 ku处增加了一条特异的诱导表达条带。取诱导后菌液,经超声波破碎后对收集的上清和沉淀进行SDS-PAGE电泳分析(图8),结果发现,在裂解沉淀物中有与目的蛋白大小相符的条带,而上清中无此条带,表明该表达产物主要以包涵体形式存在。经过3次免疫制备鼠抗鸡TLR15胞外区抗体,经ELISA 检测,抗体效价为1∶10 000。采用Western Blot方法检测重组蛋白的特异性(图9),抗His单克隆抗体与pET32a-TLR15ER重组蛋白发生反应,在分子量约为72 ku处出现一条特异性条带。
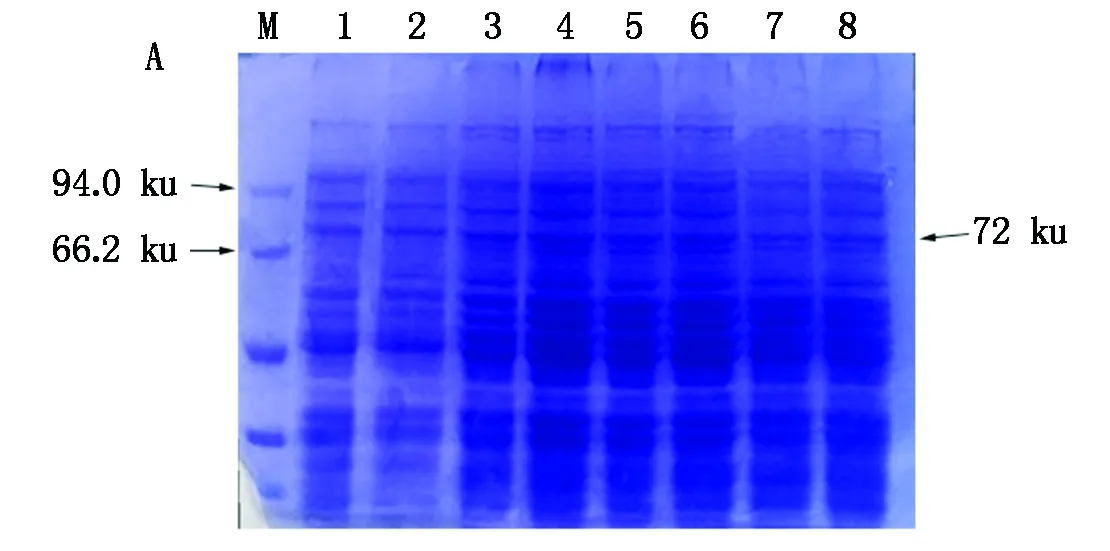
M.蛋白分子量标准;1.细菌无诱导对照;2-8.诱导不同时间的表达产物。M.Protein Marker;1.Bacteria without induction control;2-8. Induction of expression products at different times.

M.蛋白分子量标准;1-3.菌体裂解的沉淀;4-6.菌体裂解的上清。M.Protein Marker;1-3.Precipitation of cell cleavage;4-6.Supernatant of cell cleavage.
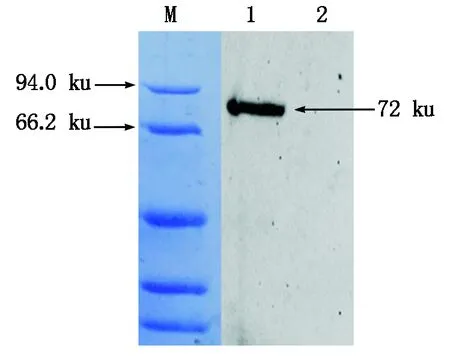
M.蛋白分子量标准;1.蛋白样品的杂交条带;2.未诱导重组菌。M.Protein Marker;1.Hybridization strip of protein sample;2.Uninduced recombinant bacteria.
2.5 chTLR15的免疫组织化学检测
取海兰褐鸡脾脏、肝脏、肺的组织材料,经免疫组织化学检测(图10),A图为脾脏,B图为肝脏,C图为肺。A、B、C组中1组为对照组,2组为试验组。结果表明,对照组无阳性染色,在试验组中,脾脏、肝脏、肺均有阳性染色,阳性染色细胞呈深黄色,脾脏染色最深;肝脏和肺染色较浅,少数阳性染色细胞呈浅黄色,表明脾脏是主要产生TLR15的部位且主要分布在细胞质中。
3 讨论
众所周知,早期对TLR的研究显示,该基因可以参与果蝇背腹侧极性的形成,所以命名为Toll受体[13]。随后,Hashimoto等[14]研究发现,该基因编码1种跨膜蛋白,进而阐述了该蛋白的结构。而在1996年,研究人员又发现该基因能够激起成年果蝇的免疫反应,其表达产物在抗感染方面发挥重要作用[15-16]。chTLR15作为天然免疫的重要组成部分,在禽类感染性疾病中的作用已经具有了一定的研究基础。已有研究表明,chTLR15主要在鸡抗细菌感染过程中发挥重要作用[17],但Chen等[18]研究发现TLR15也能够识别病毒和细菌的非甲基化的CpG-DNA序列,激活机体的抗病毒反应。而且,以往研究认为TLR15为禽类所特有,但在2018年,有报道称,在钉螺中发现TLR15[10], 但对该分子在细胞中的定位、配体的诱导和传导的信号通路都尚未明确,故不能确定二者是同系物。由于物种的亲缘关系,可以看出海兰褐鸡与三黄鸡的核苷酸同源性高达99.85%,氨基酸完全一致。这与Ruan等[19]研究发现,在不同地方品种鸡chTLR15的胞外区会存在某些多态性位点的报道不一致。海兰褐鸡与其他鸟类之间相比亲缘关系也较近,和贝类的亲缘关系相对较远[20]。
有研究表明,在受到细菌感染时chTLR15的表达量会上调[21]。王燕等[22]在用白痢沙门氏菌刺激雏鸡时也得到了相同的结论。还有一些研究者通过免疫组化实验也发现,chTLR15可以在脾脏中大量表达,说明脾脏在TLR15的表达中占有十分重要的地位,作为外周免疫器官,脾脏受到细菌感染之后,chTLR15的表达量会出现上调[23]。一些研究还揭示出禽类特异性的TLR15在功能上和TLR2相似[24],这在鸡感染沙门氏菌后,脾脏中TLR15和TLR2的mRNA表达量都会增加中得到证实[17]。本研究发现,未受感染的状态下,海兰褐鸡TLR15在脾脏中表达量也是最高,与前述研究具有一致性。
TLR15在发挥作用时,主要通过其胞外区识别病原微生物的PAMPS,故本研究选用胞外区进行原核表达,得到了与预计相符的重组目的蛋白,免疫动物后获得了相关抗体。在验证chTLR15组织分布谱时该抗体可以进行有效的结合,表明该重组蛋白属于有活性的有功能的TLR15分子,可以用于今后进一步观察分析TLR15的功能特征,并为开发出新型的生物制剂奠定了基础,也为后续的相关领域的研究提供了充足的分子基础。
