人DNase I的表达、纯化及降解NETs活性研究
2019-03-08梁艺璇
梁艺璇,吴 洁
(中国药科大学生命科学与技术学院酶工程实验室,南京 210009)
中性粒细胞在捕获和杀灭病原体过程中发挥重要作用,是人体免疫防御的第一道防线[1]。活化的中性粒细胞会释放自身线粒体和核内染色质DNA到胞外,以DNA为骨架包裹各种颗粒蛋白酶形成纤维网状结构,称为中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)[2]。NETs的诱捕作用能使机体有效地防御病原体感染[3]。尽管NETs具有杀菌活性,然而越来越多的证据表明,过量的NETs具有促炎特性并导致宿主细胞损伤[4-6]。因此,NETs过量形成或清除受阻是许多疾病的潜在基础,包括系统性红斑狼疮、血管炎、糖尿病、血栓和肺损伤等[7-11]。
NETs只有在自身结构完整的情况下才能维持其抗原性[12],因其主要结构成分是DNA,所以可通过破坏NETs的DNA骨架降解NETs[13]。人脱氧核糖核酸酶Ⅰ(deoxyribonuclease I,DNase I)是一种酸性糖蛋白,具有核酸内切酶活性。在Ca2+和Mg2+等二价金属离子存在的条件下,作用于单链或者双链DNA的磷酸二酯键,通过水解生成单核苷酸或者5′端为磷酸基团,3′端为羟基的寡核苷酸[14]。DNase I不仅可以降解外源DNA,还在细胞凋亡、降解坏死细胞的染色质方面起到很大作用,并在小鼠乳腺癌、胰腺癌模型[15-17]、肺损伤[18]和系统性红斑狼疮[19]中被证实可发挥一定的功效。
为深入研究DNase I与NETs相关疾病的关系,本实验成功构建了原核表达质粒pET32a-His-DNase I并转化至E.coliRosetta(DE3)中,建立了纯化His-DNase I的简要工艺。
1 材 料
1.1 菌种、质粒及实验动物
宿主菌为大肠埃希菌Rosetta(DE3),克隆质粒pGEM-DNASEI购自北京义翘神州科技有限公司;表达质粒为pET-32a(+),含氨苄青霉素(Amp)抗型基因,由华安生物技术有限公司提供。SPF级BALB/c雌性小鼠(4~6周龄)自扬州大学购买,合格证号:SCXK(苏)2017-0007,动物实验符合动物伦理委员会批准。
1.2 试 剂
NcoⅠ、XhoⅠ限制性内切酶、T4 DNA连接酶(美国赛默飞世尔公司);Ni Sepharose High performance(美国通用医疗公司);质粒小量制备试剂盒(上海生物工程有限公司);PCR产物纯化试剂盒、琼脂糖凝胶切胶回收试剂盒(北京天根生物科技有限公司);引物(南京金斯瑞生物科技有限公司);DNA Marker、蛋白预染Marker(北京全式金生物科技有限公司);氨苄青霉素(上海源叶生物科技有限公司);中性粒细胞提取试剂盒(天津灏洋生物制品科技有限责任公司);细胞爬片(上海晶安生物科技有限公司);4′,6-二脒基-2-苯基吲哚(DAPI,南京凯基生物科技发展有限公司);RPMI-1640培养基、胎牛血清(美国Gibco公司);佛波酯(PMA,美国Sigma-Aldrich公司);BCA试剂盒(上海碧云天生物技术有限公司);其他试剂均为国产分析纯。
2 方 法
2.1 His-DNase I融合蛋白表达载体的构建
按照人DNase I的氨基酸序列,采用大肠埃希菌偏爱密码子获得人DNase I的DNA序列。利用引物设计软件Oligo分别设计上游引物P1和下游引物P2,P1:5′-CATGCCATGGGCAGCAGCCATCATCATCATCATCACAGCAGCGGCATGCGTGGTAT GAAAC-3′,P2:5′-CCGCTCGAGTTATTTCAGCATAACTTCCACC-3′。
通过引物设计上游引物P1,即在该扩增的DNase I基因的5′端加入6个组氨酸(His)标签,同时在连接处加入2个连续的丝氨酸作为柔性肽,引入酶切位点NcoⅠ,下游引物P2引入XhoⅠ酶切位点。采用PCR技术,获得His-DNase I基因序列。
扩增条件为98 ℃预变性5 min;98 ℃变性1 min,60 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃延伸5 min。
分别用NcoⅠ、XhoⅠ将PCR产物与pET32a载体质粒双酶切,纯化后加T4 DNA连接酶4 ℃连接过夜,将酶连产物转化至Rosetta(DE3)感受态细胞。将重组菌的感受态细胞用无抗性的LB液体培养基重悬,于摇床37 ℃,50 r/min培养1小时后涂布在含氨苄抗性的固体平板中,倒置培养12 h,次日挑取单克隆于LB培养基中继续培养,保存菌种后抽提质粒,PCR方法验证,质粒信息由南京金斯瑞生物科技有限公司测定。
2.2 融合蛋白的诱导表达及纯化
将鉴定成功的重组菌接种于LB液体培养基5 mL中(含50 μg/mL的氨苄青霉素),37 ℃过夜活化。次日转接于LB液体培养基50 mL中培养,每1小时取样测定A600,绘制生长曲线。
根据生长曲线,将重组菌培养3 h后,加入乳糖(终浓度5 mmol/L)后继续37 ℃培养,分别在培养0,1,2,3,4,5,6 h取样,离心收取菌体沉淀,进行12% SDS-PAGE分析,观察目的蛋白的位置及表达量。按每克湿菌体加入菌体裂解缓冲液20 mL的比例重悬菌体,充分混匀,超声破碎后,于4 ℃、12 000 r/min离心20 min,分别收集上清液和沉淀,用12% SDS-PAGE蛋白电泳检测分析,确定融合蛋白的表达形式。
按每克菌体沉淀湿重加入洗涤液Ⅰ(20 mmol/L Tris-HCl缓冲液,pH 8.0)20 mL的比例溶解包涵体,充分混匀后,12 000 r/min,4 ℃,离心20 min,弃上清液;沉淀再依次用洗涤液Ⅱ(以20 mmol/L Tris-HCl缓冲液溶解的含2 mol/L的尿素溶液)、洗涤液Ⅲ(以20 mmol/L Tris-HCl缓冲液溶解的含1% Triton X-100的溶液)、洗涤液Ⅰ、蒸馏水按同样的方法洗涤,弃上清液,留沉淀,取部分沉淀用12% SDS-PAGE检测。
洗涤后的包涵体沉淀,每克湿重加入含8 mol/L尿素的包涵体溶解液40 mL,4 ℃搅拌6 h以上,使沉淀变性溶解。12 000 r/min离心20 min,弃沉淀,收集上清液。
将溶解后的目的蛋白上清液用0.45 μm滤膜过滤,过滤后进行镍离子亲和柱纯化,分别用30和300 mmol/L咪唑进行洗脱,收集各峰的洗脱液,12% SDS-PAGE分析目的蛋白的洗脱峰。收集的含高纯度目的蛋白的上清液在不断搅拌的情况下缓慢滴加到分别含6、4、3、2、1、0 mol/L尿素的复性缓冲液(5%甘油,1% L型精氨酸,2%甘氨酸,尿素,使用1×PBS溶解)中进行透析复性。
将复性蛋白溶液4 ℃,12 000 r/min离心20 min,弃沉淀,收集上清液。上清液用4 ℃预冷的蒸馏水透析,每隔4小时换一次液,4 ℃条件下透析24~48 h,用AgNO3溶液检测透析液,直至无白色沉淀方可确定透析完毕。除盐后的蛋白溶液冻干保存。
2.3 中性粒细胞提取
采用眼眶静脉丛取血法于抗凝管中各采集新鲜小鼠外周血3 mL,上下颠倒以防凝血。将中性粒细胞分离液3 mL加至干净的离心管,再加入80%浓度的细胞分离液1.5 mL,形成梯度界面。沿离心管壁缓慢地将等体积已加入红细胞沉降液的抗凝血小心加至分离液的上层。室温条件下,水平离心机离心,1 690 r/min离心30 min。离心后可见不同的分层,小心吸去离心后的上两层(血浆层和单个核细胞层),并将第3层(含中性粒细胞的混浊分离层与少量红细胞层)转移至另一干净的离心管中。于新离心管中加入不含Ca2+、Mg2+的HBSS(D-Hank′s)液10 mL,上下颠倒数次,轻吹悬浮细胞。1 690 r/min离心5 min后弃上清液,在管底加入红细胞裂解液3 mL裂解残余的红细胞,上下吹打混匀,裂解1 min,1 690 r/min离心10 min。直至裂解完全后,加入PBS及基础培养基2 mL,重悬沉淀,1 690 r/min离心5 min洗涤。离心后用完全培养基重悬细胞,将提取后的中性粒细胞瑞氏染色,显微镜下观察并计数不同视野中中性粒细胞,统计分析其纯度。
2.4 佛波酯(PMA)诱导NETs形成
调整分离所得的外周血中性粒细胞浓度至每毫升1×106个细胞。将细胞重悬后转至无菌全黑96孔酶标板,每孔200 μL。在 37 ℃,5% CO2培养箱中培养0.5~1 h静置处理细胞,空白组加DMSO 10 μL,各实验组加PMA(终浓度80 μmol/L)10 μL,37 ℃、5% CO2培养箱中培养3 h。
2.5 融合蛋白降解NETs活性
诱导NETs形成后,将DNase I溶液(终浓度为50,100,200 μg/mL)或NaCl溶液(DNase I的溶剂)加入到PMA刺激后的中性粒细胞孔中,DMSO对照组中加入同等体积的NaCl溶液,每个梯度重复3个复孔。加入SytoxGreen 0.2 μL,避光反应15 min 后,荧光酶标仪检测荧光强度(RFU,Ex:485/20,Em:528/20)。根据荧光强度检测融合蛋白对NETs的降解活性。
同时,提取的中性粒细胞用含10%胎牛血清的RPMI-1640培养基稀释,细胞按每孔5×105个细胞接种至预先置入多聚赖氨酸处理的无菌玻璃片的24孔板。加入PMA诱导NETs形成,再加入终浓度为200 μg/mL的融合蛋白,轻微摇动混匀后置于培养箱中培养20 min。培养结束后取出细胞爬片,DAPI避光染色5 min,荧光显微镜观察融合蛋白降解NETs情况。
2.6 数据分析
采用SPSS 19.0软件进行数据分析和统计,采用单因素方差分析组间差异,P<0.05时差异具有统计学意义。
3 结 果
3.1 E.coli Rosetta(DE3)/pET32a-His-DNase I的构建
如图1所示构建pET32a-His-DNase I质粒。提取pGEM:DNase I质粒后采用PCR方法获得含有NcoⅠ及XhoⅠ双酶切位点的His-DNase I基因,将其与pET-32a(+)用NcoⅠ及XhoⅠ双酶切,如图2。T4 DNA连接酶过夜连接两片段后转化至E.coliRosetta(DE3)感受态中,挑选单克隆。将含有质粒的阳性克隆培养于含氨苄青霉素的LB培养基中,37 ℃过夜培养12 h,采用质粒提取试剂盒提取质粒,经0.8%琼脂糖凝胶电泳,于紫外光下观察电泳结果,与预计大小基本一致。将挑选的阳性克隆菌的质粒进行双酶切,酶切片段与预计大小一致,如图3。将挑选的阳性克隆进行测序验证,经比对后所有碱基均与设计的相一致,证实成功构建包含重组质粒pET32a-His-DNase I基因工程菌。

Figure 1 Schematic diagram of the plasmid pET32a-His-DNase I

Figure 2 0.8% Agarose electrophoresis analysis of the vector plasmid pGEM:DNase I (A),PCR products (B) and restriction enzyme digestion of plasmid pET-32a(+) (C)
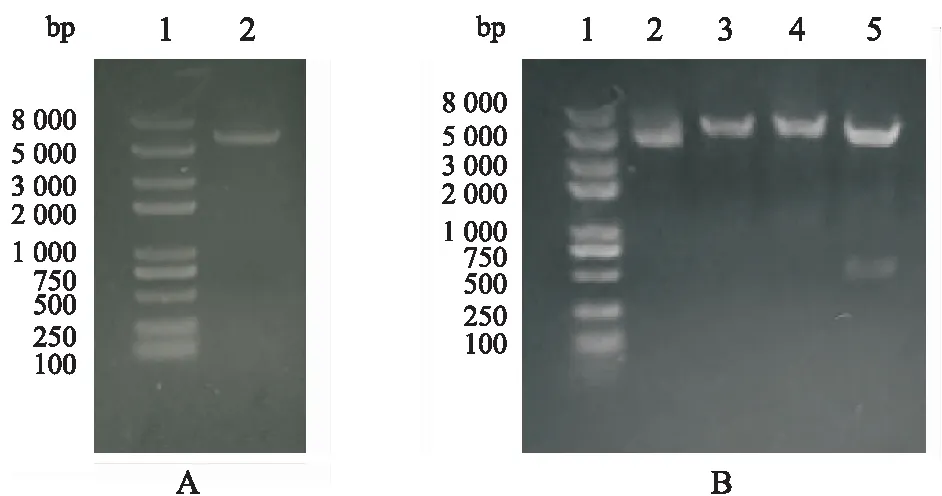
Figure 3 0.8% Agarose electrophoresis analysis of plasmid pET32a-His-DNase I
3.2 His-DNase I融合蛋白的表达与纯化
根据测定的A600,绘制工程菌的生长曲线(图4)。乳糖诱导表达融合蛋白,经12% SDS-PAGE分析,目的蛋白条带在50 kD附近,且在诱导4 h时表达量最高,通过Bandscan软件分析融合蛋白的表达量可达菌体总蛋白量的50%(图5-A)。诱导表达后的菌体经超声破碎裂解后,分别取上清液和沉淀进行12% SDS-PAGE 分析。结果表明,重组蛋白His-DNase I绝大部分是以包涵体形式存在于沉淀中(图5-B)。将超声破碎后的菌体沉淀用8 mol/L尿素溶解,经镍柱亲和色谱,对洗脱液进行分析,结果表明融合蛋白在咪唑浓度为300 mmol/L时被洗脱(图5-C)。经复性后,该蛋白于50 kD处有明显条带(图5-D)。

Figure 4 Growth curve of E. coli Rosetta(DE3)/pET32a-His-DNase I
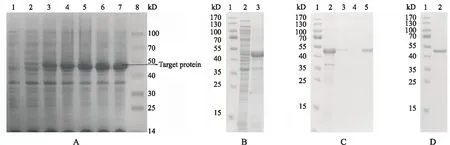
Figure 5 12% SDS-PAGE analysis of the fusion protein His-DNase I
3.3 His-DNase I融合蛋白降解NETs活性
NETs形成过程中,会释放出大量胞内染色质,因此可以通过DNA荧光强度来检测NETs水平。
提取小鼠外周血中性粒细胞,分析其纯度为90%,经PMA刺激形成NETs。如图6所示,中性粒细胞在PMA刺激后产生的游离DNA水平显著高于溶剂DMSO组,加入不同浓度梯度的His-DNase I,DNA荧光强度降低,说明PMA有效诱导中性粒细胞体外形成NETs,His-DNase I能以浓度依赖性的方式降解NETs的DNA骨架。
提取的中性粒细胞接种于24孔板制备细胞爬片。加入PMA诱导NETs形成,再加入His-DNase I融合蛋白,DAPI染色后荧光显微镜观察,可以明显看到经PMA刺激形成的NETs网状结构能够有效地被His-DNase I降解(图7)。

Figure 6 Degradation activity of His-DNase I on neutrophil extracellular traps (NETs) in vitro detected by SytoxGreen

Figure 7 Degradation activity of His-DNase I on NETs in vitro detected with fluorescence microscopy
4 讨 论
NETs相关自身免疫性疾病的病理研究表明,在炎性反应期内,体液中NETs水平升高[20]。DNA是NETs的主要结构成分,且NETs中的DNA能以游离状态存在于人体外周血中,表现形式为cf-DNA/NETs (neutrophil-derived circulating free DNA)。在各种炎性病理学中观察到NETs与血浆和血清等体液中cf-DNA水平具有相关性[21-23]。因此,cf-DNA可用作NETs的替代标记物,而DNA水平的测定可有助于监测疾病活动和评估治疗策略的有效性。Margraf等[24]建立了血浆cf-DNA/NETs快速定量的检测方法(Quant-iT PicoGreen dsDNA assay),能够特异性地检测血浆中来自中性粒细胞的cf-DNA/NETs。Cf-DNA能通过多种机制介导炎症反应[25],但可被DNase降解[22]。鉴于NETs在多种免疫疾病的发病机制中发挥作用,DNase I作为NETs的负性调节因子,为研究自身免疫性疾病的病理生理机制、预防或延缓炎性期组织病理性损伤提供了新思路。
由于天然提取法原料来源的限制以及产品品质的批间差异较大,因此利用工程菌或工程动植物细胞高效表达hDNase I具有很大的优势。大肠埃希菌表达系统具有成本低、遗传背景清楚、表达量高和表达产物分离纯化相对简单等优点[26]。本实验采用大肠埃希菌表达系统,通过分子生物学方法设计和构建含有DNase I基因的表达载体pET32a-His-DNase I,经过乳糖诱导,融合蛋白以包涵体的形式表达,表达量较高。本次实验通过添加组氨酸标签进行蛋白的纯化,充分利用了组氨酸标签系统缩短蛋白分离纯化时间、增强融合蛋白稳定性的优势,经镍柱亲和色谱纯化后,融合蛋白的纯度也较高。
生理性的DNase I在降解坏死细胞的染色质方面起到关键作用[27]。高浓度DNase I(5 mg/mL)可以完全降解NETs,但这个浓度远远高于生理性DNase I浓度(20 ng/mL)[28]。本研究通过分离小鼠外周血中性粒细胞在体外刺激形成NETs,加入DNase I后检测游离DNA水平的方法判断其活性。结果表明,融合蛋白DNase I在高于20 μg/mL浓度时能显著地在体外降解NETs的DNA骨架,表现出较高的酶活性。可见在生理环境下DNase I活性不足时通过补充外源性的DNase I具有一定可行性。但由于大肠埃希菌表达的蛋白是未糖基化的,虽然具有降解活性,但是未明确糖基化及活性之间的关系。此外,有研究表明目的蛋白添加组氨酸标签可能会影响到其生物活性[29],因此后续的研究将验证此标签对DNase I活性的影响。
本研究为进一步探究DNase I用于NETs相关自身免疫疾病的研究奠定了基础。
