SRT1720抗老年大鼠骨髓间充质干细胞衰老的作用及机制研究
2019-03-08朱美飞江荣林雷澍吴建浓
朱美飞 江荣林 雷澍 吴建浓
骨髓间充质干细胞(mesenchymal stem cells,MSCs)移植在心肌梗死治疗中的安全性和有效性已得到初步证实[1]。但是,移植后的MSCs在心肌组织中的定植率和存活率很低,其中一个重要的原因是年龄问题。有报道证实老年供体来源的MSCs在动物模型中对心肌损伤的修复作用减弱[2],其增殖、分化潜能及应激抵抗能力等均下降[3-4]。然而临床上需要接受MSCs治疗者仍以老年患者为主[5],因而提高老年个体来源的MSCs功能是MSCs移植治疗未来临床应用需要解决的重要科学问题。沉默信息调节因子(silent information regulator type 1,SIRT1)是一种尼克酰胺腺嘌呤二核苷酸依赖的组蛋白去乙酰化酶,已被证实在代谢和年龄相关的疾病以及细胞存活、凋亡和应激抵抗等方面扮演着重要角色[6-9]。而SIRT1在个体中的表达随着年龄增加而降低,因此有研究者曾用基因工程方法在老年大鼠MSCs中过表达SIRT1,证明SIRT1对于MSCs的衰老表型有积极的改善作用,对MSCs在心肌梗死中的治疗作用也有提升[10-11]。然而基因工程方法由于其伦理及安全性问题,不能在临床治疗中应用。近年来,大量小分子化合物被开发出来用于增强SIRT1活性,其中效果和特异性最强的是SRT1720[12-13]。有研究证明SRT1720喂养对正常饮食和高脂饮食的小鼠均有延长寿命的作用,并可延缓血流动力学不稳定所导致的内皮细胞衰老[14-16]。因此,笔者推测SRT1720在老年来源的MSCs中可能同样发挥积极作用,可改善其衰老表型及功能,并试图通过动物实验来进一步证实。
1 材料和方法
1.1 实验动物 老年雄性SD大鼠20只(18月龄)购自浙江省医学科学院,所有处理程序均经过医院实验动物伦理委员会批准并符合美国国立卫生院颁布的《实验动物照护及使用指南》。
1.2 试剂和仪器 SRT1720(美国Selleck Chemicals公司),DMEM 培养基、FBS、BSA、DMSO、SYBR Green Reaction Mix试剂盒、逆转录试剂盒(美国Life Technologies公司),CCK-8试剂盒(日本同仁化学),酶标仪(美国Bio-Rad公司),衰老相关的β半乳糖苷酶染色试剂盒、RIPA裂解液、活性氧检测试剂盒、PBS、0.25%胰酶(上海碧云天生物技术有限公司),Marker、Gel Doc EZ Imaging System、Nanodrop分光光度计、ABI 7500 Fast聚合酶链反应系统(美国Thermo Fisher公司),PVDF膜(美国Merck Millipore公司),ECL液(德国Merck Millipore公司),兔抗大鼠p16单克隆抗体、兔抗大鼠p21单克隆抗体(英国Abcam公司),小鼠抗大鼠 γ-H2A.X单克隆抗体、HRP标记的抗小鼠和抗兔荧光二抗(美国Cell Signaling Technology公司),HRP标记的β-actin小鼠单克隆抗体、孵育羊抗大鼠γ-H2A.X荧光标记二抗(美国BD Biosciences公司),6孔板、96孔板、50ml离心管、15ml离心管(美国 Corning公司),2.5~1 000μl移液器(德国Eppendorf公司),荧光显微镜(德国莱卡公司)。
1.3 MSCs的收集、分离和培养 大鼠MSCs的收集和分离步骤参照Chen等[10]所使用的方法。获取老年雄性SD大鼠双侧股骨和胫骨,并用DMEM培养基反复冲洗骨髓腔,将冲洗液离心后收集细胞沉淀。用含10%FBS的DMEM培养基重悬细胞后,置于含5%CO2的37℃恒温培养箱中培养。次日,将贴壁细胞同样条件下继续培养,每3d更换细胞培养液。直至细胞铺满70%~80%底面积时,以含0.2%EDTA的0.25%胰酶溶液消化细胞,使其脱壁,离心并重悬后以1∶3的比例分配至新的培养皿,恒温培养箱中继续传代扩增,第3~5代的细胞用于后续实验。
1.4 细胞应激模型的建立和细胞生存率分析 根据心肌梗死后缺血缺氧微环境特点,本研究建立了过氧化应激模型。将老年大鼠MSCs以2 000个/孔的密度分别接种至96孔细胞培养板,培养1d待生长稳定后分别予以含不同浓度(0、125、250、500和1 000μM)过氧化氢(H2O2)的无血清培养基培养不同时间(12、24h),移除培养基,每孔更换含10μl CCK-8的DMEM 100μl。培育2.5h后,将培养板置于酶标仪上读取450nm处吸光度(OD)值。细胞生存率=各处理组OD值/正常培养基对照组OD值×100%。
1.5 MSCs药物处理 SRT1720溶解于有机溶剂DMSO中备用。为避免DMSO对细胞的毒性影响,DMSO在细胞培养液中的浓度均低于0.1%体积分数。各组细胞暴露于含不同浓度(0、0.2、0.5、1、2 和 5μM)SRT1720 的正常细胞培养基以及同浓度SRT1720经不同时间(0、3、6、12、24和48h)培养后,置于上述1.4的过氧化应激模型下,采用CCK-8法检测细胞生存率。
1.6 衰老相关的β半乳糖苷酶染色 相同代次(第3代)的老年大鼠MSCs以200 000个/孔的密度分别接种于6孔板中,分为两组,分别经SRT1720和溶剂对照DMSO预处理后,分别以3孔细胞用于直接染色,另外3孔更换含10%FBS的DMEM培养基继续培养2d后染色。染色方法如下,移除细胞培养基,以4%甲醛固定15min。PBS洗涤后,采用衰老相关的β半乳糖苷酶染色试剂盒进行染色。37℃恒温培育箱培育过夜后,在倒置显微镜下观察拍照。
1.7 衰老相关的p16、p21 mRNA表达水平检测 采用荧光定量PCR法。以Trizol法提取RNA,按照说明书进行操作,沉淀的RNA溶解于20μl DEPC水,用Nanodrop分光光度计检测RNA浓度。参照说明书以逆转录试剂盒进行逆转录,得到的cDNA存放于-20℃备用。应用荧光定量PCR法检测目的基因表达。以GAPDH为内参,以逆转录而来的cDNA为模板,按照SYBR Green Reaction Mix试剂盒说明添加反应体系,在ABI 7500Fast系统上检测基因表达强度。反应体系为20μl(含SYBR Green 10μl,Rox 0.4μl,cDNA 2μl,ddH2O 6.8μl,Primer F 0.4μl和 Primer R 0.4μl),反应条件为 95℃预热 15min,随后 95℃解链 5s,62℃反应 30s,72℃延长 5s,40个循环。引物序列用Primer 3在线软件设计,由Invitrogen公司上海引物合成部合成,见表1。基因相对表达丰度用ΔΔCt法计算分析。

表1 引物序列
1.8 衰老相关的p16、p21蛋白表达水平检测 采用Western blot法。分别经SRT1720和溶剂对照DMSO预处理的老年MSCs移除细胞培养基,用含蛋白酶抑制剂的RIPA裂解液使细胞充分裂解25min。之后12 000g,4℃离心25min,留取上清液,用BCA法蛋白定量检测试剂盒进行蛋白定量,冻存于-80℃冰箱备用。蛋白样品上样前先予100℃煮沸5min以使之变性,随后以SDS-PAGA凝胶在30mA下电泳至分子量Marker到达凝胶底部,后将凝胶中的蛋白质在300mA下湿转移至PVDF膜上。以5%BSA封闭1h后,将蛋白膜孵育于目标蛋白特异性第一抗体(1∶1 000稀释)中,4℃下孵育过夜。次日取出,以含0.1%Tween的PBST振荡洗涤3次。以HRP偶联的第一抗体特异性第二抗体(1∶3 000稀释)孵育PVDF膜1h后再次PBST洗涤3次。洗涤后的蛋白膜用ECL液按照说明书在暗室孵育3min,采用Gel Doc EZ Imaging System成像并用Image Lab软件分析条带。
1.9 管腔形成试验 将老年MSCs接种于6孔板,分为两组,分别以SRT1720和溶剂对照DMSO预处理24h,更换为含2%FBS培养基,1d后留取上清液。用两组预处理的细胞上清液重悬人脐静脉内皮细胞(HUVEC),接种至预铺好 Matrigel的 96 孔板中,分别于 1、2、3、4、5h 在光学显微镜下观察HUVEC管腔形成情况并拍摄照片。以Image-Pro Plus软件测量每个视野的管腔长度,代表血管新生能力。
1.10 活性氧类物质含量检测 将老年MSCs接种于6孔板,经SRT1720和相同体积分数溶剂对照DMSO预件。计量资料以表示,两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 SRT1720预处理对老年MSCs生存率的影响 当细胞处于含250μM H2O2的无血清培养基中24h后,细胞生存率为50%左右(图1a),当SRT1720浓度达到5μM时表现出细胞毒性(图1b),因此选取不超过5μM的 SRT1720进一步研究。细胞生存率随着SRT1720浓度的升高而增加,当浓度为1μM时达到最高(图1c),预处理24h的生存率较预处理12h明显增加,但与预处理48h比较无明显差异(图1d)。
2.2 SRT1720预处理对老年MSCs β-半乳糖苷酶染色阳性细胞率和衰老相关蛋白的影响 经SRT1720预处理后的老年MSCs β-半乳糖苷酶染色阳性细胞率与DMSO对照比较差异无统计学意义(P>0.05),而继续生长48h后染色阳性细胞率较DMSO对照明显下降,差异有统计学意义(P<0.01),见图 2(插页)和图3a。经SRT1720预处理的老年MSCs生长48h后p16、p21mRNA和蛋白表达水平均明显下降,以p21下降为主,见图3b-d。
2.3 SRT1720预处理老年MSCs对HUVEC管腔形成的影响 通过管腔形成试验发现,经SRT1720预处理的老年MSCs其外分泌液使得HUVEC管腔形成数量及长度明显增加,提示促血管新生能力明显增强,见图4处理,置于上述1.4的过氧化应激模型下24h,采用活性氧检测试剂盒检测活性氧类物质含量。简述如下,移除培养基后每个孔加入200μl以1∶1 000稀释的DCFHDA,37℃细胞培养箱内孵育20min。用无血清培养液洗涤细胞3次,在荧光显微镜下观察并拍照。
1.11 细胞内DNA损伤免疫荧光法检测 将老年MSCs接种于24孔板,经SRT1720和相同体积分数溶剂对照DMSO预处理后,置于上述1.4的过氧化应激模型下。移除细胞培养基,用4%甲醛固定15min,洗涤后以0.2%的Triton X-100破膜20min。用5%BSA室温封闭1h,之后孵育小鼠抗大鼠γ-H2A.X单克隆抗体(1∶500稀释),4℃孵育过夜。洗涤后孵育羊抗大鼠γ-H2A.X荧光标记二抗(1∶2 000稀释),室温1h。用含DAPI(标记细胞核)的荧光封片剂封片。在荧光显微镜下观察,随机选取5个高倍镜视野拍照,并计算γ-H2A.X阳性细胞数占总细胞数比例。
1.12 统计学处理 采用GraphPad Prism 6.01统计软(插页)和图5。

图1 SRT1720预处理对老年MSCs生存率的影响(a:老年MSCs在含H2O2无血清培养基中处理12和24h后的细胞生存率;b:老年MSCs经不同浓度SRT1720和DMSO处理24h后的细胞生存率;c:经SRT1720处理的老年MSCs在无血清+H2O2环境中的细胞生存率;d:经1μM SRT1720预处理不同时间后的老年MSCs在无血清+H2O2环境中的细胞生存率;与预处理0μM或0h组比较,*P<0.05,**P<0.01;横线下两组比较,△△P<0.01)

图2 β-半乳糖苷酶染色显示老年MSCs衰老情况(绿色为染色阳性)
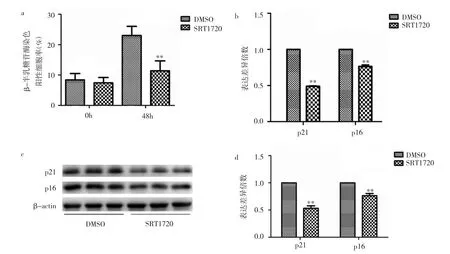
图3 SRT1720预处理对老年MSCs β-半乳糖苷酶染色阳性细胞率和衰老相关蛋白的影响(a:SRT1720预处理对老年MSCsβ-半乳糖苷酶染色阳性细胞率的影响;b:荧光定量PCR法检测细胞内衰老相关的p16、p21 mRNA表达水平;c:衰老相关的p16、p21蛋白表达的电泳图;d:Western blot法检测衰老相关的p16、p21蛋白表达水平;与DMSO比较,**P<0.01)
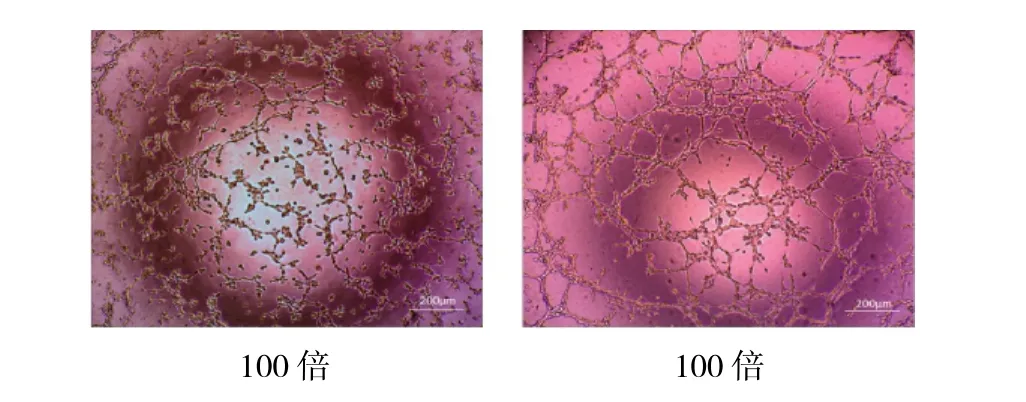
图4 经SRT1720预处理的老年MSCs HUVEC细胞连接形成管腔情况
2.4 SRT1720预处理对活性氧类物质产生和γ-H2A.X表达的影响 经SRT1720预处理的老年MSCs内活性氧类物质水平较DMSO对照明显下降(图6a,见插页)。同时,反映DNA损伤水平的γ-H2A.X在未经SRT1720预处理的老年MSCs细胞核内表达明显增多,表明其DNA损伤程度较重(图6b,见插页)。经SRT1720预处理的老年MSCs γ-H2A.X蛋白表达水平明显低于DMSO对照,差异有统计学意义(P<0.01),见图7。

图5 经SRT1720预处理的老年MSCs HUVEC管腔长度比较(与DMSO比较,**P<0.01)

图6 SRT1720预处理对活性氧类物质产生和γ-H2A.X表达的影响[a:老年MSCs内活性氧类物质水平(绿色荧光);b:γ-H2A.X在老年MSCs细胞核内表达情况(红色为γ-H2A.X,蓝色为细胞核)]
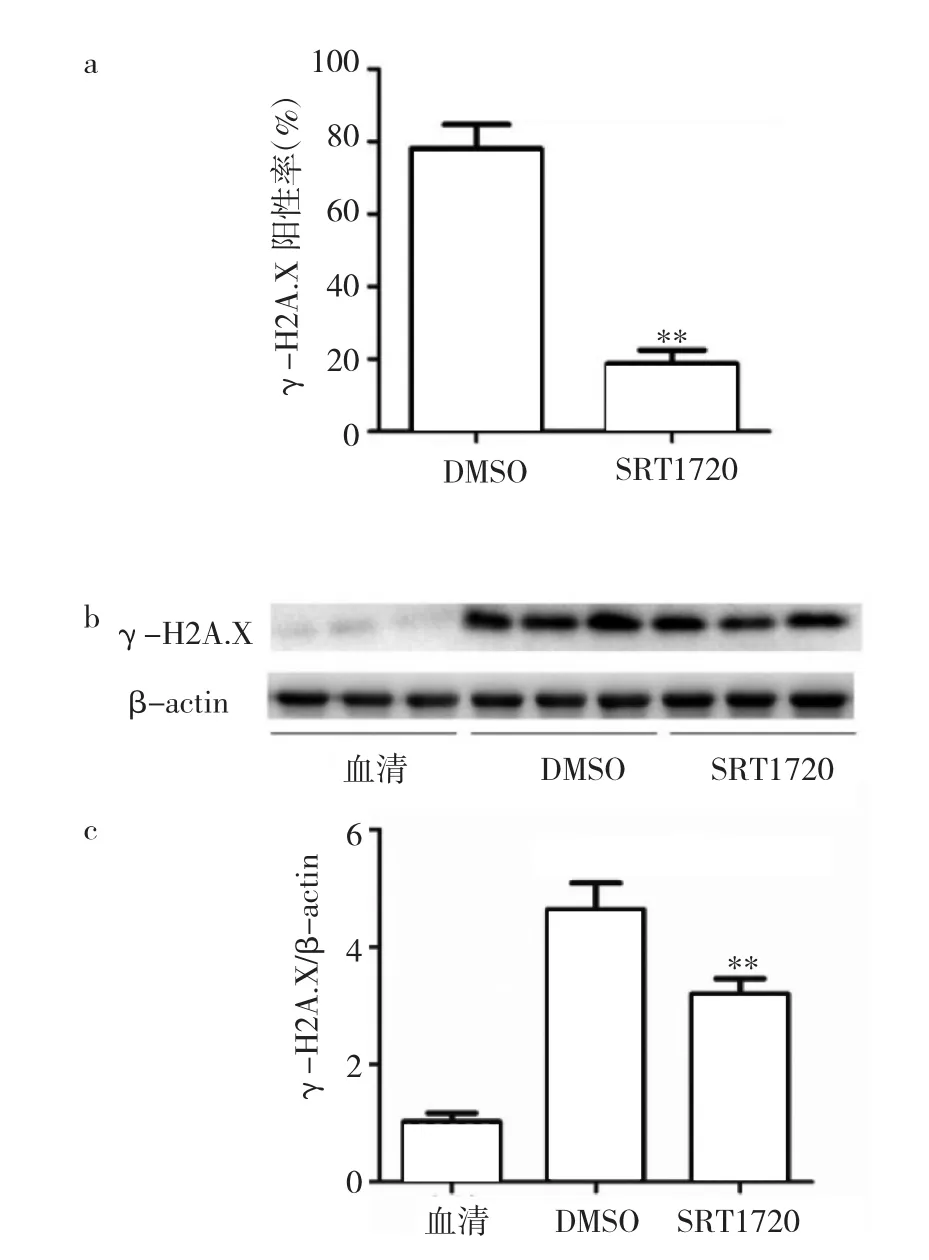
图7 SRT1720预处理对γ-H2A.X表达的影响(a:经SRT1720预处理的老年MSCsγ-H2A.X阳性率;b:经SRT1720预处理的老年MSCsγ-H2A.X蛋白表达的电泳图;c:经SRT1720预处理的老年MSCsγ-H2A.X蛋白表达水平比较;与DMSO比较,**P<0.01)
3 讨论
MSCs移植治疗已成为心血管领域的研究热点,随着越来越多的临床试验的开展和结果公布,其疗效逐渐被肯定,但同时也暴露出一些问题,比如用于移植的细胞可得性低、存在免疫排斥反应等。MSCs因其容易大量获得、分化和增殖潜能较高、免疫豁免等优点被广泛应用,但其疗效仍不能达到理想水平。原因是多方面的,比如低生存率和低定植率,而老年患者群体因老龄化的特点变得尤为突出。已有研究证明,相对于年轻个体来源的MSCs,老年供体来源的MSCs疗效进一步减弱[17]。究其原因,一方面随着个体的衰老,MSCs也表现出衰老相关分泌特征,导致促炎和促衰老相关的细胞因子分泌增多[18-19];另一方面,老年供体来源的MSCs增殖和抗恶劣环境应激的能力也相应减弱[20-21]。因此,改善MSCs衰老成为提高其疗效的关键因素。而目前针对老年供体来源的MSCs处理方法较少,除了基因工程方法以外,尚缺乏切实可行的方案。
基于SIRT1过表达的老年MSCs其衰老表型改善及治疗心肌梗死的疗效增强的结论[10-11],以及小分子化合物在MSCs预处理中的可行性[22],本研究试图通过小分子化合物来改善老年MSCs中SIRT1的表达或活性,进而起到与基因过表达相似的效果。用于增强SIRT1活性的小分子化合物有多种,包括天然的如白芦藜醇,以及人工合成的如SRT1720、SRT2140等[23],其中以SRT1720效果及特异性最强[24]。因此,SRT1720被选定为本研究中用来提高SIRT1活性的小分子化合物。本研究中,笔者通过模拟心肌梗死后局部内环境缺血缺氧以及再灌注后过氧化损伤的特点,建立过氧化应激模型,通过反映细胞生存情况的CCK-8试剂探索出SRT1720用于预处理的最佳条件。由于存在时间与浓度的双重条件,而浓度条件易于得到,因此,本研究采取先易后难的策略,分别取得最适宜的处理浓度和时间。在此条件下,经SRT1720预处理的老年MSCs,反映其衰老表型的β-半乳糖苷酶表达明显降低,而随衰老程度逐渐增加的p16、p21表达明显下降,意味着细胞衰老表型明显改善。那么这是否影响了其功能呢?众所周知,MSCs移植治疗心肌梗死效果的发挥主要依赖于旁分泌作用,通过旁分泌因子起到促血管增生、抗心肌细胞凋亡等作用[25]。因此笔者通过管腔形成试验证实SRT1720预处理不仅改善老年MSCs衰老表型,并能明显增加HUVEC连接形成管腔的数量和总长度,这表明提高其促血管新生的功能。由于实验条件及技术成熟度的不足,本研究尚未探究其外分泌液对心肌细胞凋亡的影响,望后续研究者弥补这一不足之处。
鉴于过氧化应激和DNA损伤在促进细胞衰老机制中的重要地位及其相互作用[26-27],以及SIRT1抗氧化应激的作用,在对SRT1720作用机制的研究中,笔者将过
氧化应激与DNA损伤同时进行检测。结果表明,SRT1720预处理减少了细胞内活性氧类物质的产生,同时反映DNA损伤的组蛋白γ-H2A.X细胞内含量明显减少。表明在应激条件下,SRT1720预处理致过氧化物产生减少的同时,DNA损伤也减轻,揭示SRT1720似乎通过减少过氧化物的产生而间接减弱DNA损伤反应,从而延缓细胞衰老。但由于技术限制,本研究未能证实两者之间的确切关系,在今后的研究中有望突破这一关键环节。
