STAT3在高能X射线照射诱*导肺腺癌早衰中的作用研究
2019-03-07丁春燕刘青杰封江彬
丁春燕 刘青杰 封江彬 田 梅 陆 雪 李 爽 高 玲*
早熟衰老或早衰(premature senescence)是指细胞在非端粒信号刺激下发生增殖能力和生理功能下降,是细胞在生长和发育的过程中,形态和功能发生变化,提前出现退行性改变,这种形式的衰老与端粒缩短无关,也与细胞增殖代数无关联,属于病理性衰老。能诱导细胞早衰的刺激因素包括DNA受损、氧化应激和一些致癌基因的表达变化等。电离辐射诱导癌细胞早衰的相关研究结果表明:电离辐射可诱导乳腺癌MCF-7细胞和人间充质干细胞等发生早衰[1-2]。电离辐射诱导细胞早衰的信号通路较为复杂,不同研究者在不同的癌症上进行了初步探讨。如Wang等[3]的研究表明,8 Gy的γ射线可诱导骨髓基质细胞经由p53/p21通路诱导细胞早衰;Kim等[4]发现,在肝癌细胞HepG2存在不依赖于p53/p21通路,而是由p16介导的辐射诱导的细胞早衰。2013-2014年陆续有课题报道,辐射可诱发肺癌细胞发生早熟衰老[5-7]。然而,其研究仅限于揭示早衰现象及检测下游早衰相关分子p53和p16等,而对其更上游的与放射损伤早期反应密切关联的调节机制还有待更深入的研究阐述。
STAT3是一种将细胞外信号传递至细胞核的转录因子,位于羧基端第705位的酪氨酸磷酸化使其激活,并从细胞质转位到细胞核,调控靶基因的表达,将受体激发的短暂的胞浆信号转化为长期的基因表达的改变,其参与细胞生长、恶性转化、凋亡等生理功能的调控,并在多种肿瘤中的表达持续性升高[8]。有研究表明,STAT3是导致衰老的早期和晚期事件所必需的,包括引起活性氧(reactive oxygen species,ROS)簇早期增加和衰老相关分泌表型(senescenceassociated secretory phenotype,SASP)的产生,涉及白介素6(interleukin-6,IL-6)-STAT3-IGFBP5信号通路[9]。
STAT3是目前得到广泛认可的辐射诱导表达基因,本研究的前期研究结果发现,2 Gy剂量电离辐射可以激活肺腺癌细胞内STAT3,继而促进肿瘤细胞的侵袭和迁移[10-11]。通过抑制剂阻断辐射诱导的STAT3活化,可以有效逆转辐射诱导的A549细胞侵袭和迁移[12]。同时,本研究发现,不同剂量X射线可诱导A549细胞出现剂量依赖性早衰[13]。目前STAT3介导的抗早衰影响肺腺癌细胞辐射抗性的机制目前还不明确。因此,本研究进一步探讨STAT3在X射线诱导A549细胞早衰中的作用。
1 材料与方法
1.1 设备材料与试剂
(1)直线加速器(瑞典Elekta公司Precise);Thermo Forma培养箱(美国Thermofisher公司);DT5-2型低速台式离心机(北京时代北利)。
(2)人肺腺癌A549细胞购自北京协和医学院细胞库;胎牛血清(fetal bovine serum,FBS)和最低需求(minimum essential medium,MEM)培养基购自美国HyClone;青霉素-链霉素溶液、β-半乳糖苷酶细胞染色试剂盒、RIPA细胞裂解液和BCA蛋白定量测定试剂盒以及增强化学发光液均购自江苏碧云天;细胞在37 ℃、5% CO2、饱和湿度培养箱中培养;Lip2000转染试剂盒购自美国invitrogen;罗氏磷酸酶抑制剂及蛋白酶抑制剂,1∶1000稀释的STAT3(美国CST),1∶1000稀释的p-STAT3抗体(英国Abcam),1∶2000稀释的β-actin抗体、1∶3000稀释的二抗山羊抗兔抗体和1∶3000稀释的山羊抗小鼠抗体(北京中杉金桥生物公司)。
1.2 细胞照射
取对数生长期A549细胞,火箭军总医院放射治疗中心直线加速器(瑞典Elekta公司Precise)照射,源皮距离(source skin distance,SSD)为100 cm,X射线能量为6 MV,剂量率为400 cGy/min,用电离室对6 MV高能X射线(简称X射线)在水模体内进行剂量校准,细胞用75 cm2培养瓶培养,照射时培养瓶内含10 ml的10%FBS的培养液,A549细胞为贴壁细胞,瓶底中心点吸收剂量分别为0 Gy、2 Gy、4 Gy以及8 Gy,照后各剂量均分为对照组、α-氰基-(3,4-羟基)N-苄苯乙烯胺(AG490)组和雷帕霉素(Rapamycin,RAPA)组共3组。
1.3 细胞处理
A549细胞照射后均分的对照组、AG490组和RAPA组,每组以105/ml铺于6孔板中,每孔加入2 ml的细胞培养液,对照组不做处理,AG490组加入终浓度为20 μM/ml的AG490抑制剂,RAPA组加入终浓度为1μM/ml的RAPA抑制剂,于24 h、48 h及72 h进行β-半乳糖苷酶细胞染色实验并计数;4 Gy剂量X射线照射的A549细胞于24 h、48 h及72 h收取细胞,同时将4 Gy照射的3组细胞,4 Gy组、4 Gy+AG490组加入终浓度为20 μM/ml的AG490抑制剂、4 Gy+RAPA组加入终浓度为1 μM/ml的RAPA抑制剂,对照组为0 Gy照射,于72 h收取细胞,全部提取蛋白用于蛋白免疫印迹实验。
1.4 β-半乳糖苷酶细胞染色检测细胞衰老
将A549细胞铺于24孔板中培养1 d,吸除细胞培养液,PBS洗涤1次,加入250 μl的β-半乳糖苷酶染色固定液,室温固定15 min后,吸除细胞固定液,PBS洗涤细胞3次,每次3 min。加入250 μl染色工作液,避光用保鲜膜封住24孔板防止蒸发。37 ℃温箱孵育过夜后,加入0.5 ml的PBS,普通光学显微镜下观察染色结果并计数,显微镜下(100×)5个随机视野中计数阳性(细胞体积一半以上蓝色)和总细胞的数目,统计β-半乳糖苷酶阳性细胞的百分比。
1.5 细胞转染
A549细胞培养至对数期后,以106/ml种植于6孔板中,每孔加入2 ml的细胞培养液,待培养细胞融合度到70%时,进行细胞转染。转染步骤参照Lip2000转染说明书。将空载pcDNA3.0和STAT3过表达(pcDNA3.0-STAT3)质粒转染至细胞,分别命名为pcDNA3.0和pcDNA3.0-STAT3组,于转染后36 h收取细胞,用于蛋白免疫印迹实验检测蛋白表达。
1.6 蛋白质印迹
RIPA细胞裂解液裂解A549细胞,加入磷酸酶抑制剂及蛋白酶抑制剂,冰浴振荡30 min,12000 r/min离心10 min取上清,使用BCA蛋白定量试剂盒进行蛋白定量。加入5×上样缓冲液,煮沸10 min后以12000 r/min,离心3 min。取上清加入制备好的10%的分离胶与5%的浓缩胶,调整各上样量至50 μg,浓缩胶以80 V电压,分离胶以120 V的电压电泳。使用PVDF膜,以18 V电压半干转转膜120 min。5%脱脂奶粉室温封闭60 min,一抗孵育4 ℃摇床过夜。TBST洗膜3次,每次15 min,加入二抗孵育60 min,使用增强化学发光法显色,用BIO-RAD公司ChemiDoc多功能成像系统曝光成像,采集图像数据后,以β-actin为内参,Image Lab分析软件分析目的蛋白的表达水平。
1.7 统计学方法
使用SPSS 12.0统计软件进行数据处理,两组比较采用独立样本,每个处理组均与对照组或0 Gy组比较,采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 STAT3参与A549细胞早衰调控
为验证STAT3是否参与A549细胞早衰的调节,使用过表达质粒pcDNA3.0-STAT3转染使STAT3活化,利用STAT3信号通路抑制剂AG490和雷帕霉素(RAPA)阻断A549细胞中的STAT3活化,观察A549细胞的早衰变化,其结果如图1所示。
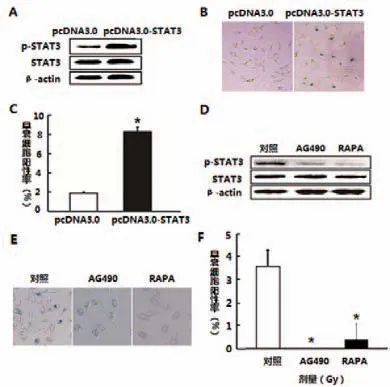
图1 过表达和抑制STAT3对A549细胞早衰的影响结果示图
图1A中pc DNA-3.0和pc DNA3.0-STAT3组p-STAT3蛋白水平依次为:1、1.413;STAT3蛋白水平依次为:1、0.983。过表达STAT3后,A549细胞内的磷酸化STAT3(p-STAT3)水平显著升高。图1D加入AG490和RAPA后,对照组、AG490组和RAPA组p-STAT3蛋白水平依次为:1、0.545和0.397;STAT3蛋白水平依次为:1、0.966、1.076。A549细胞内的磷酸化STAT3(p-STAT3)水平显著降低,表明所用两种抑制剂均能显著抑制A549细胞中的STAT3活化;进一步利用β-半乳糖苷酶细胞染色检测细胞衰老结果显示,过表达STAT3可引起A549细胞早衰增加(图1A、B及C所示),其差异有统计学意义(t=22.32,P<0.05)。STAT3抑制剂AG490和RAPA处理均能显著抑制A549细胞早衰(图1D、E及F所示),其差异有统计学意义(AG490组t=8.5,RAPA组t=5.5,P<0.05),表明STAT3参与A549细胞早衰调控过程。
2.2 AG490和RAPA抑制剂对X射线诱导的A549细胞内STAT3激活的抑制
在前期的研究中已经证实,X射线照射可引起A549细胞中STAT3磷酸化水平升高,在本研究中进一步检测AG490和RAPA是否能抑制X射线照射诱导的A549细胞内STAT3激活,其结果如图2所示。
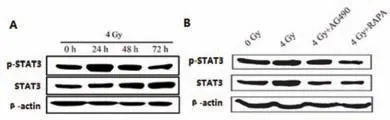
图2 不同处理A549细胞蛋白表达电泳图
图2A显示,4 Gy的X射线照射后0 h、24 h、48 h以及72 h p-STAT3蛋白水平依次为1、1.822、1.597和1.287;STAT3蛋白水平依次为:1、1.376、1.92和2.093。图3B显示,0 Gy、4 Gy、4 Gy+AG490以及4Gy+RAPA p-STAT3蛋白水平依次为1、1.379、1.230和0.710;STAT3蛋白水平依次为1、1.880、0.986和0.992。A549细胞内p-STAT3水平显著升高,加入AG490和RAPA后,4 Gy的X射线照射诱导的p-STAT3升高被显著抑制。
2.3 AG490和RAPA对抑制剂X射线照射引起的细胞早衰的抑制
利用β-半乳糖苷酶细胞染色实验观察AG490和RAPA对X射线诱导的A549细胞早衰的影响,X射线照射可显著促进A549细胞早衰,加入AG490和RAPA后,X射线照射诱导的A549细胞早衰被显著抑制,差异有统计学意义,表明X射线照射通过激活STAT3信号通路促进A549细胞早衰。AG490组2 Gy,4 Gy和8 Gy与对照组比较,差异有统计学意义(t=27.7,t=3.1,t=5.8;P<0.05);RAPA组2 Gy、4 Gy和8 Gy与对照组比较,差异有统计学意义(t=10.2,t=12.8,t=8.4;P<0.05),如图3所示。
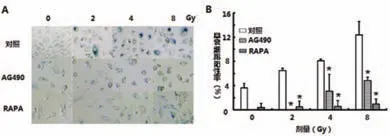
图3 X射线照射引起的A549细胞早衰示图
3 讨论
本研究发现STAT3参与A549细胞早衰调控,同时发现STAT3抑制剂可抑制X射线诱导的A549细胞内STAT3激活,进而抑制X射线照射引起的细胞早衰。
Kojima等[9]研究表明,STAT3在人原代成纤维细胞中参与诱导细胞早衰,而本研究结果与此一致。同时,其他的课题组以及本研究均发现电离辐射在杀伤肿瘤细胞的同时,还会激活肺腺癌细胞内STAT3的表达[14-15]并促进肺腺癌细胞的转移[16]且转移能力的增加依赖于STAT3活性的增加。AG490和RAPA分别是JAK2和JAK-STAT通路的抑制剂,均可以抑制STAT3的表达。电离辐射可能是通过激活JAK2或JAK-STAT途径激活STAT3的表达,从而影响细胞早衰的发生。使用AG490和RAPA处理后,电离辐射诱导的STAT3的活性增加和细胞早衰的发生均受到抑制,这提示电离辐射诱发的细胞早衰部分依赖于STAT3的激活。
已知辐射可诱发肺癌细胞发生早熟衰老[5-7]。但目前的研究仅限于揭示早衰现象及检测下游早衰相关分子p53和p16等,而对其更上游的与放射损伤早期反应密切关联的调节机制,以及下游激活早衰蛋白的机制还有待更深入的研究阐述,这也是下一步的工作重点。
