腺病毒载体介导C/ebp delta改善小鼠心脏缺血性损伤
2019-03-07王丹丹陶贵周黄建华刘华
王丹丹,陶贵周△,黄建华,刘华
目前缺血性心脏病常用的治疗方法为药物和手术治疗(包括介入手术),均能改善大多数患者的症状和体征。但是对一些终末期的缺血性心脏病,传统疗法治疗效果差,预后不良[1]。目前,血管新生基因治疗是缺血性心脏病治疗的热点探索领域之一[2]。C/ebp delta作为一种转录因子,可以调节多个基因表达[3]。研究发现C/ebp delta通过自分泌调节淋巴管内皮细胞VEGF-C的信号通路,影响肿瘤淋巴血管新生[4],提示其可以作为缺血性心脏病治疗的一个重要的潜在靶点。本研究通过腺病毒载体介导C/ebp delta基因,观察其对缺血性心脏的保护效果,并探讨C/ebp delta对缺血心脏的保护作用及机制。
1 材料与方法
1.1 实验动物 普通C57BL/6小鼠40只,体质量20~25 g,12周龄,雄性,购于北京维通利华实验动物技术有限公司。
1.2 主要试剂 DMEM培养基、胎牛血清(FBS)、胰蛋白酶均购于美国invitrogen公司;Polyfectine、JM109感受态细胞购于深圳百恩维生物科技有限公司;小量质粒抽提试剂盒EM101、Trans2K PlusⅡDNA Marker BM121购于北京全式金生物公司;琼脂糖凝胶回收试剂盒D2500购于Omega;T4 DNA Ligase M0202L购于美国NEB公司;大规模质粒抽提试剂盒购于德国Qiagen公司;ViraBind腺病毒纯化试剂盒购于美国Cell Biolabs公司;Anti-C/ebp delta抗体购于Cell Signaling公司;DNA引物合成及测序由美国invitrogen公司完成。
1.3 pDC316-mCMV-C/ebp delta-EGFP腺病毒载体构建 全基因合成C/ebp delta(810 bp,GenBank登录号:NM_005195.3)并插入pUC57载体。(1)酶切:载体质粒pDC316-mCMV-EGFP及模板质粒pUC57-C/ebp delta经NheⅠ+HindⅢ双酶切(37℃水浴反应2 h),将pDC316-mCMV-EGFP酶切大片段产物和C/ebp delta回收。(2)连接:将回收产物于22℃反应2 h。(3)连接产物转化:将上述产物与感受态细胞混匀后,冰浴25 min,42℃ 45 s,冰浴2 min,加入LB培养基37℃1 h,离心,弃部分上清,将剩余液体涂抹于含氨苄西林(Ampicillin)抗性的LB培养皿上,37℃恒温培养箱倒置培养过夜。挑选阳性克隆进行PCR鉴定。
1.4 pDC316-mCMV-C/ebp delta-EGFP和病毒包装 铺种293T细胞,用转染复合物(DNA悬液与Polyfectine)转染48 h后收集病毒原液,进行PCR鉴定。引物:上游5′-ATGAGCGCCGCGCTCTTCAGCC-3′,下 游 5′-TTACCGGCAGTCTGCTGTCCCGG-3′。并按照逐级稀释法计算出病毒滴度。具体方法如下:(1)在滴度测定前1 d取48孔板,加入3×104/孔293T细胞。(2)取96孔板,每孔加入90 μL培养基,然后在第1横排孔每孔加入10 μL待测病毒原液,混匀后吸取10 μL混合液至第2横排孔,如此稀释至第8横排孔。(3)吸10 μL病毒混合液加入到相对应的48孔板中。(4)经48 h感染,用荧光显微镜计数荧光细胞情况。一般情况下,在最高稀释梯度m的孔数出N个带荧光的细胞,则病毒滴度为N×10m/mL(m为稀释梯度)。
1.5 局部注射腺病毒C/ebp delta载体对心肌细胞的转染效率及C/ebp delta的表达检测 取C57BL/6雄性小鼠,分为实验组和对照组,每组各5只。秤量小鼠体质量,以20 mg/kg体质量腹腔注射戊巴比妥钠,待其麻醉后脱毛,进行呼吸机插管。开胸暴露心脏,在实验组和对照组小鼠左心室前壁分别注射腺病毒C/ebp delta载体和腺病毒空载体(1×109OPU溶于20 μL生理盐水)后缝合关胸。4 d后将小鼠无痛苦处死,获取心脏样本,行免疫组织化学染色和免疫印迹检测腺病毒载体介导C/ebp delta在心肌细胞的表达情况。
1.6 局部注射腺病毒C/ebp delta载体对小鼠心脏心功能影响 采用1.5方法获取腺病毒C/ebpdelta载体,局部注射于小鼠心脏前壁,用8-0聚丙烯涤纶线结扎冠状动脉左前降支(left anterior descending branch,LAD)[5],左室前壁在结扎时瞬间变灰白为成功标志。以4-0丝线缝合肋间隙,排气后用6-0缝线分层关胸。苏醒后正常饲养4周后,用小鼠麻醉机异氟烷面罩麻醉小鼠,氧气流量为0.2 L/min,异氟烷与氧气的混合比例为0.2。麻醉生效后平卧位,保持平台温度37℃,在小鼠胸部抹超声胶,运用小鼠超声探头(50 Hz)在心脏乳头肌处取心脏横截面,运用B mode和M mode模式行心脏功能检测,检测指标包括左室短轴缩短分数(Left ventricular fractional shortening,LVFS)、左室射血分数(Left ventricular ejection fraction,LVEF)等[5]。
1.7 免疫组织化学染色检测血管密度及TUNEL染色检测细胞凋亡情况 冠状动脉结扎1周后,无痛苦处死小鼠,实验组和对照组各5只,收获心脏,行CD31免疫组织化学染色和TUNEL染色检测。
1.8 免疫印迹法(Western blot)检测相关蛋白的表达情况 冠状动脉结扎1周后,无痛苦处死小鼠,实验组和对照组各5只,收获心脏,免疫印迹检测C/ebp delta对心肌梗死后心脏低氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)及血红素加氧酶-1(heme oxygenase-1,HO-1)蛋白表达的影响。
1.9 统计学方法 采用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 腺病毒载体的构建及鉴定 根据基因库序列,运用合成法合成人C/ebp delta基因序列,与p-DC316-mCMV-EGFP进行基因重组,经双酶切鉴定,p-DC316-mCMV-C/ebp delta-EGFP构建成功,见图1A;转染293T细胞后获得较强的EGFP表达,见图1B;经PCR进一步证明腺病毒C/ebp delta-EGFP转染293T细胞后C/ebp delta有效表达,见图1C。
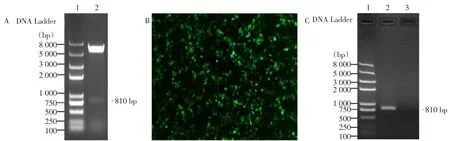
Fig.1 The construction and identification of adenoviral vector图1 腺病毒载体的构建及鉴定
2.2 心肌局部注射腺病毒C/ebp delta-EGFP对心肌细胞的转染效率及C/ebp delta的表达检测 免疫组化染色结果显示实验组小鼠在局部注射部位心肌细胞显著表达C/ebp delta,见图2A。同时,免疫印迹结果显示,实验组的C/ebp delta蛋白表达明显高于对照组(n=5,t=17.462,P<0.01),见图2B、C。
2.3 心肌局部注射Ad C/ebp delta-EGFP对心肌梗死后心功能的影响 小动物超声结果显示,与对照组相比,实验组小鼠显著改善心肌梗死后的心脏功能指数LVFS和LVEF(n=5,t分别为6.777、2.841,均P<0.05),见图3。
2.4 心肌局部注射Ad C/ebp delta-EGFP对心肌细胞凋亡的影响 TUNEL染色结果显示,与对照组相比,实验组小鼠心肌细胞凋亡率显著减少(n=5,t=7.818,P<0.01),见图4。
2.5 心肌局部注射Ad C/ebp delta-EGFP对心脏血管新生的影响 毛细血管密度(CD31)免疫组化染色结果见图5A。与对照组相比,实验组小鼠在心肌梗死交界区的血管密度显著增加(n=5,t=7.866,P<0.01),见图5B。
2.6 心肌局部注射Ad C/ebp delta-EGFP对HIF-1、HO-1和VEGF蛋白表达的影响 免疫印迹结果显示,与对照组相比,实验组HIF-1、HO-1和VEGF蛋白的表达显著增加(n=5,t分别为13.520、71.650、15.725,均P<0.01),见图6。
3 讨论
3.1 腺病毒介导的C/ebp delta改善小鼠缺血性心脏的功能 通过结扎小鼠心脏冠状动脉前降支制作心肌梗死模型发现,在心肌细胞过表达C/ebp delta可以改善心肌梗死后的心脏功能,减小心肌梗死面积。进一步研究发现C/ebp delta既减少缺血后心肌细胞的凋亡又可增加心肌梗死区周围的血管密度,提示C/ebp delta可能通过减少心肌凋亡和促进血管新生双重作用来改善缺血心脏的功能。
3.2 HIF-1对缺血性心脏的作用 研究表明,HIF-1可以有效影响心肌细胞的存活。Lee等[6]发现经历冠状动脉搭桥手术患者的心肌活检标本中HIF-1在mRNA和蛋白水平表达增加。暴露于全身性缺氧环境后,在大鼠心脏中观察到HIF-1α的广泛表达;而结扎大鼠冠状动脉后,HIF-1α局部表达增加,主要发生在梗死组织的边界并持续4周[7]。Kido等[8]采用在心肌中过表达HIF-1的转基因小鼠,发现这些小鼠在冠状动脉闭塞后4周时表现出心肌细胞凋亡的减少和心脏功能的改善。除了心肌保护作用外,HIF-1还可影响心脏的血管新生[9]。HIF-1α由缺氧激活,靶向引起广泛的基因表达,其中包括促血管新生基因VEGF[9]。心肌梗死早期,HIF-1α在心肌细胞、血管内皮细胞中均有表达[7]。在心肌细胞中持续表达HIF-1α的小鼠在心肌梗死后表现出心脏功能的改善,此情况与心肌中VEGF表达增加和血管新生有关[10]。
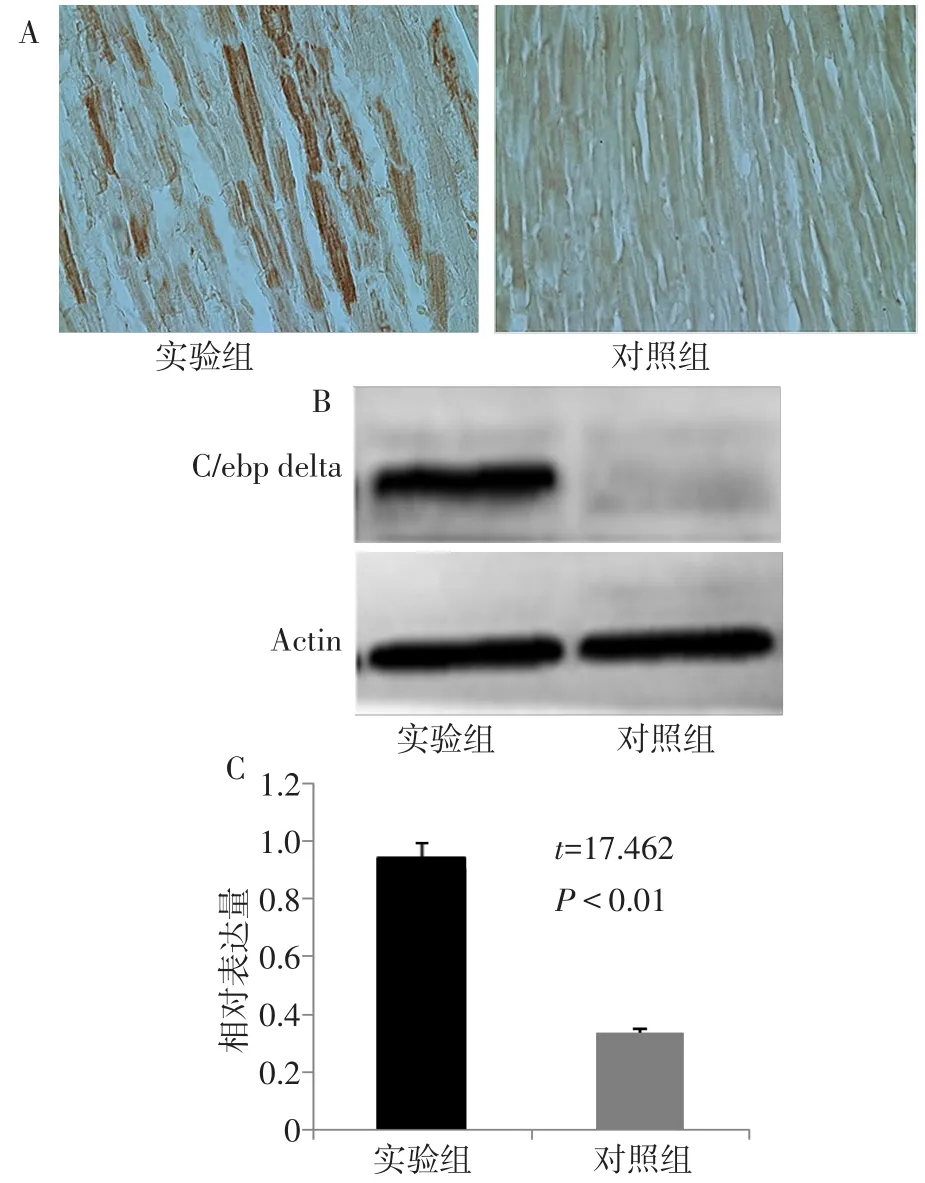
Fig.2 The transfection efficiency and expression detection of Ad C/ebp delta-EGF in cardiomyocytes(IHC,×200)图2 Ad C/ebp delta-EGFP在心肌细胞中的转染效率及表达检测(免疫组化,×200)

Fig.3 Effects of Ad C/ebp delta-EGFP on cardiac function after myocardial infarction图3 Ad C/ebp delta-EGFP对心肌梗死后心功能的影响
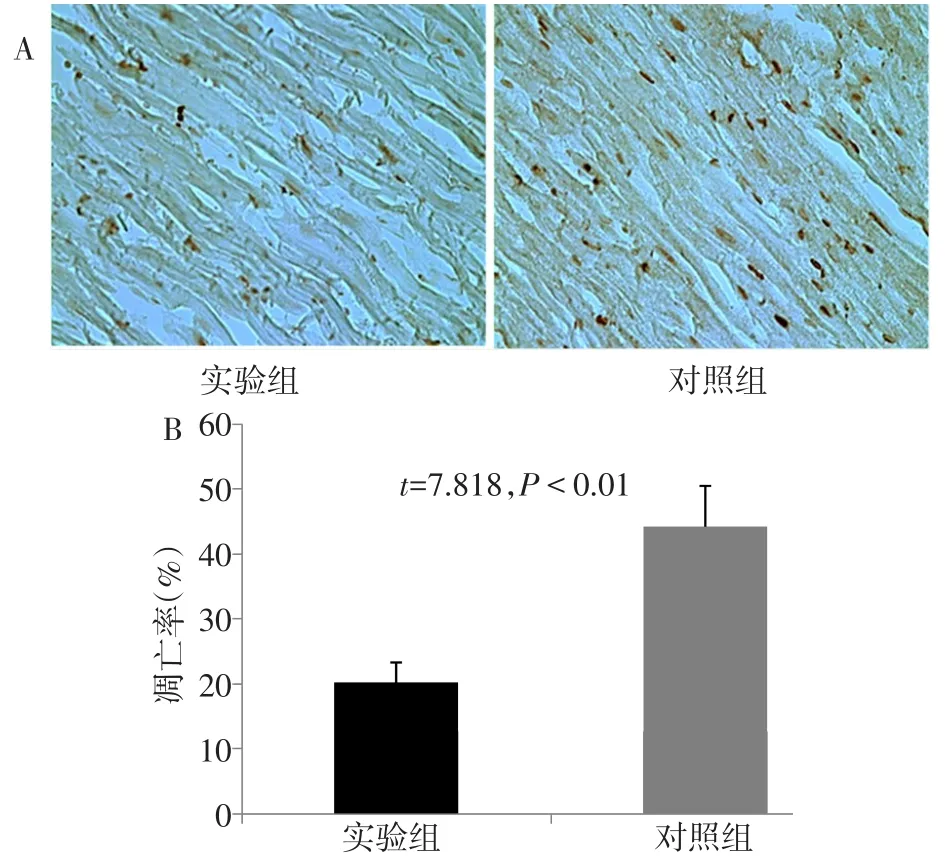
Fig.4 Effects of Ad C/ebp delta-EGFP on apoptosis of myocardial cells(TUNEL staining,×200)图4 Ad C/ebp delta-EGFP对心肌细胞凋亡的影响(TUNEL染色,×200)
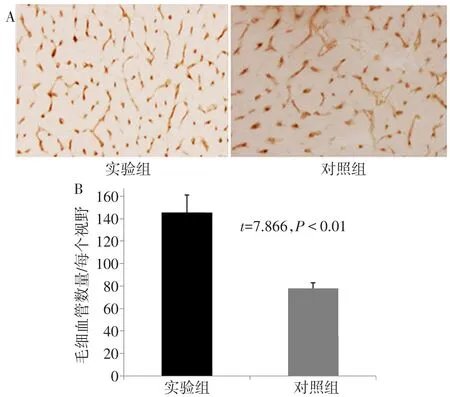
Fig.5 Effects of Ad C/ebp delta-EGFP on cardiac angiogenesis(IHC,×200)图5 Ad C/ebp delta-EGFP对心脏血管新生的影响(免疫组化,×200)
3.3 C/ebp delta通过HIF对缺血性心脏的保护作用 C/ebp delta是属于C/ebp家族的一种转录因子,在肝脏、肺、脂肪、小肠等组织上表达,参与细胞的增殖和分化[11]。C/ebp delta一个重要功能是调节基因的表达,包括肿瘤髓样抑制细胞的血管内皮生长因子受体 2(VEGFR2)[3]、成骨细胞的胰岛素样受体Ⅰ[12]、肝癌细胞的LC3B和ATG3基因[13]及乳腺癌细胞的CDC27/APC3基因[14]。研究表明,HIF-1能促进血管内皮细胞的C/ebp delta表达,反过来,C/ebp delta促进HIF-1的升高[4]。本研究发现,在心肌缺血后过表达C/ebp delta,HIF-1、HO-1和VEGF蛋白表达量明显升高,说明C/ebp delta通过HIF-1,在改善缺血心脏功能中起重要作用。在心肌细胞过表达C/ebp delta后既减少心肌细胞的凋亡,又增加心肌的血管新生,提示HIF-1在其中起着重要的桥连作用。可能的机制为心肌细胞过表达C/ebp delta后引起HIF-1的升高,HIF-1引起一系列细胞因子,如HO-1、VEGF等升高,减少心肌缺血后心肌细胞凋亡的发生及促进心脏的血管新生。而C/ebp delta如何调节HIF-1,有待进一步研究。
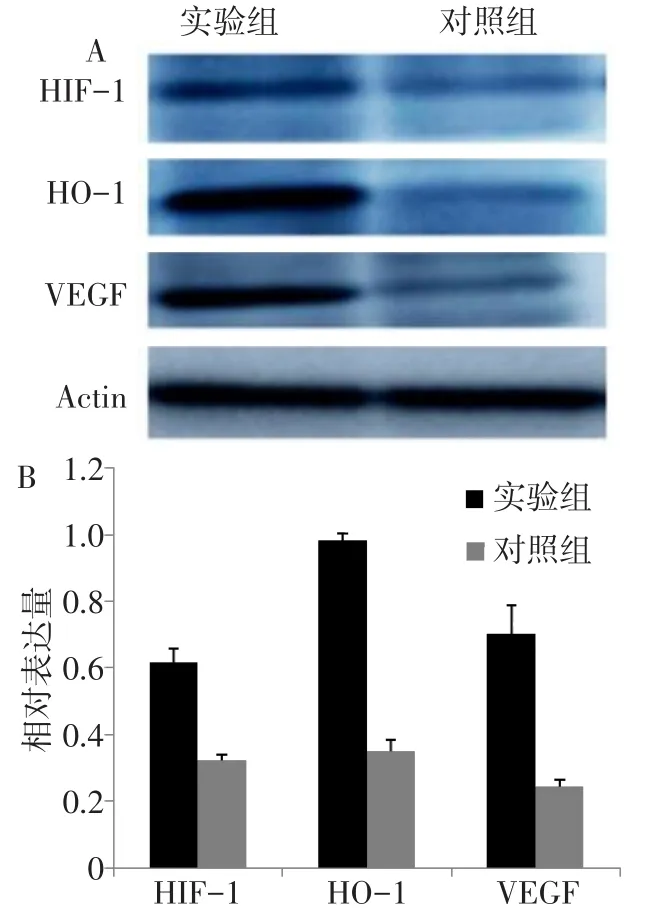
Fig.6 Effects of Ad C/ebp delta-EGFP on HIF-1,HO-1 and VEGF proteins in myocardial cells图6 Ad C/ebp delta-EGFP对心肌细胞中HIF-1、HO-1和VEGF蛋白的影响
综上所述,在本研究中,腺病毒载体介导的C/ebp delta在心肌局部注射后获得较高的转染效率及C/ebp delta蛋白表达。心肌局部注射携带C/ebp delta的腺病毒载体可改善心肌梗死后心脏功能,减少心肌细胞的凋亡,增加心肌梗死交界区的血管密度。其机制可能是通过上调HIF-1,从而激活HIF-1的转录信号通路,增加HO-1和VEGF的表达,促进心脏功能的改善。本研究为腺病毒介导C/ebp delta治疗缺血性心脏病提供了实验理论依据。
