2型糖尿病患者周围神经病变与糖尿病视网膜病变的关系
2019-03-06邱丽君高方邹梦晨何飞英孙丹薛耀明曹瑛
邱丽君,高方,邹梦晨,何飞英,孙丹,薛耀明,曹瑛
(南方医科大学南方医院,广州 510515)
糖尿病周围神经病变(DPN)和糖尿病视网膜病变(DR)都是糖尿病最常见的微血管并发症[1]。DPN可引起患者下肢感觉缺失、远端肌肉萎缩和运动障碍,进而导致足溃疡、感染和坏疽;而DR进展可引起玻璃体积血、视网膜脱离及黄斑水肿,是成人后天性致盲的主要原因,在失明的糖尿病患者中,85%是有DR引起;两者临床上都表现为渐进过程,均可对糖尿病患者造成难以挽回的器质性损害,如截肢与失明[2,3]。既往有研究[4,5]表明,DPN与DR存在一定的相关性,且具有共同的致病危险因素[6]。然而,目前少有文献探讨DPN患者不同程度损害与DR患者眼底成像定量改变之间的关系。本研究对208例2型糖尿病患者进行神经传导功能检查及眼底渗出、出血图像定量分析,并分析DPN与DR的关系。
1 资料与方法
1.1 临床资料 收集2015年1月~2017年9月南方医科大学南方医院收治的T2DM患者208例,男138例,女70例;年龄(51.2±10.8)岁;病程(6.0±5.0)a。均符合WHO制定的糖尿病诊断标准。排除标准:①严重脏器功能障碍者;②糖尿病急性并发症(糖尿病高渗性昏迷、糖尿病酮症酸中毒、糖尿病乳酸酸中毒、低血糖昏迷)、妊娠、恶性肿瘤、合并急慢性炎症疾病(足溃疡、感染)、精神疾病患者。所有患者按照2010年美国糖尿病学会(ADA)诊断标准[7]分为糖尿病无周围神经病变(NDPN)69例、糖尿病亚临床神经病变(SDPN)67例、确诊DPN 72例。
1.2 眼底出血总面积、单个出血点最大面积、渗出总面积、单个渗出点最大面积计算 参照文献[8]方法。所有研究对象均由同一位医师使用免散瞳TRC-NW2000型眼底照相机(日本Topcon)进行双眼拍片。确保每位受检者至少有6张清晰的眼底图像,采用人工智能图片识别技术(FACT),计算眼底出血总面积、单个出血点最大面积、渗出总面积、单个渗出点最大面积。
1.3 一般资料及相关生化指标收集 收集研究对象的性别、年龄,糖尿病病程、糖化血红蛋白(HbA1c)、空腹血糖、C肽、血压、吸烟史、饮酒史、甘油三酯、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、体质量指数(BMI)等。
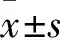
2 结果
NDPN、SDPN、DPN患者DR患病率分别为13.0%、22.4%、41.7%,两两比较,P均<0.05。NDPN、SDPN、DPN患者眼底出血总面积分别为(0.9±0.4)、(2.3±1.4)、(6.4±4.2)mm2,单个出血点最大面积分别为(0.6±0.3)、(1.0±0.4)、(2.2±2.1)mm2,眼底渗出总面积分别为(1.6±0.3)、(2.5±0.7)、(9.6±2.9)mm2,单个渗出点最大面积分别为(0.6±0.2)、(1.2±0.7)、(4.9±1.6)mm2,两两比较,P均<0.05。Spearman相关分析显示,DPN严重程度与眼底出血总面积(rs=0.669,P<0.05)、单个出血点最大面积(rs=0.546,P<0.05)、渗出总面积(rs=0.887,P<0.05)、单个渗出点最大面积(rs=0.845,P<0.05)均存在正相关。
三者临床资料和生化指标比较见表1。由表1可知,三者HbA1c、舒张压、HDL、BMI两两比较有统计学差异(P均<0.05)。以是否合并DPN为因变量,以NDPN与DPN间有统计学差异的因素(DR、HbA1c、BMI<24)为自变量进行二分类Logistic回归分析。结果显示,DR(OR=4.743,95%CI1.691~13.301,P=0.003)、BMI<24(OR=7.000,95%CI2.932~16.710,P=0.001)是DPN发生的危险因素(详见表2)。
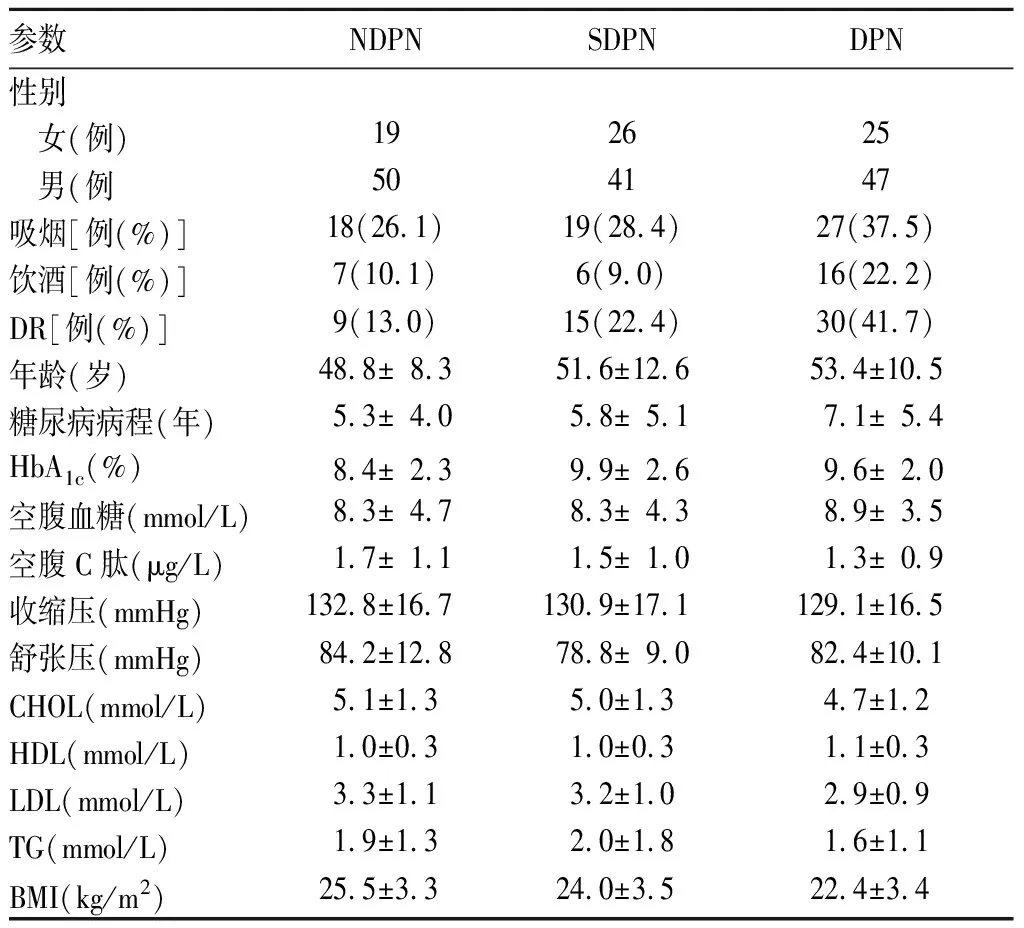
表1 三者临床资料和生化指标比较

表2 DPN的多因素Logistic回归分析结果
3 讨论
DPN与DR均为糖尿病常见的微血管并发症,严重影响糖尿病患者的生活质量。目前已有临床研究表明,DPN与DR存在明显的相关性[9]。Chung等[10]发现,DPN患者合并DR的比率更高。Barr等[11]发现,DPN患者发生DR的风险比无合并神经病变的糖尿病患者高4倍。
本研究发现,糖尿病神经病变组DR患病率高于糖尿病无神经病变组,这一结果与既往研究一致[12]。DPN在临床上呈现渐进性的病变过程,已有研究表明[13],神经损伤早在糖尿病神经病变亚临床阶段就已出现。糖尿病亚临床神经病变阶段表现为仅有神经传导功能异常,而无神经病变的症状或体征,当进展至糖尿病神经病变阶段时,则出现如麻木、疼痛、感觉减退、踝反射消失等神经病变的症状或体征。本研究中,从糖尿病无神经病变组、到糖尿病亚临床神经病变组、再到糖尿病神经病变组,DR患病率依次增高。这提示可能随着DPN的进展,DR患病风险随之增高。因此,在临床工作中,应同时对DPN及DR进行积极筛查,以便对并存的微血管并发症早期进行干预,从而遏制并发症的进展。我们通过人工智能图片识别技术对眼底渗出及出血病变进行定量分析,进一步发现,从糖尿病无神经病变组、到糖尿病亚临床神经病变组、再到糖尿病神经病变组,眼底出血总面积及单个出血点最大面积、眼底渗出总面积及单个渗出点最大面积均依次增大。眼底出血及渗出是DR的常见表现,对出血点及渗出点进行病变面积的量化在一定意义上可以反映DR的严重程度。本研究中,眼底渗出及出血病变随着DPN的进展而加重。这可能与DPN及DR有共同的病理机制有关。目前已有基础研究表明[14,15],DPN与DR的病理基础均与微血管病变、微循环障碍及代谢途径有关。代谢途径包括多元醇途径、己糖胺途径、蛋白激酶C途径的激活以及糖基化终末产物的形成等[16]。微血管病变主要表现为内皮细胞增生肥大、血管壁增厚、管腔狭窄、透明变性、毛细血管数目减少和小血管闭塞[17]。亦有研究表明[18],DPN受神经病变过程影响,从一定程度上可认为DR与DPN的病变过程相平行。在本研究中,DPN严重程度与眼底渗出及出血病变存在一定的相关性,随着DPN病变的出现和进展,眼底渗出及出血病变亦明显加重,提示在临床工作中,可以通过对DPN的评估推测眼底病变的严重程度,进而有效指导临床诊疗;同时,也可以结合人工智能图片识别技术对眼底渗出及出血病变进行量化检查,有助于评估DR病变严重程度及监测治疗效果。本研究结果显示,DR为DPN的独立风险因素,合并DR的2型糖尿病患者发生DPN的可能性增加,这一结果与既往研究一致[19,20]。尽管DR与DPN的病理生理机制不完全相同,但两者发病机制都与微血管病变、微循环障碍及糖代谢紊乱有关,因此,这可以解释为何DR的存在增加了DPN的患病风险。同时发现,BMI< 24亦是DPN的发病危险因素。
总之,DPN严重程度与眼底出血总面积、单个出血点最大面积、渗出总面积、单个渗出点最大面积均具有相关性。定量分析眼底出血及渗出病变有助于判断视网膜病变的严重程度及辅助判断DPN的进展程度。DR及BMI<24是DPN的危险因素。早期眼底改变对于亚临床周围神经病变阶段的2型糖尿病患者有提示意义。需要指出的是,本研究虽然初步观察到DPN患者不同程度损害与DR患者眼底成像定量改变之间的相关关系,但本研究为回顾性研究,样本量小,故还需要大量的临床数据进一步证实。
