脂联素对人髓核细胞增殖凋亡的调控作用
2019-03-06黎裕明雷爱枫王春梅戴海庞俊峰刘会江黄宗贵
黎裕明,雷爱枫,王春梅,戴海,庞俊峰,刘会江,黄宗贵*
(1.南宁市第一人民医院骨科,广西 南宁 530001;2.中山大学附属第一医院麻醉手术科,广东 广州 510080;3.中山大学附属第一医院东院麻醉手术科,广东 广州 510700)
腰背痛(low back pain,LBP)一直是困扰人类生活与工作的常见疾患之一,流行病学调查证实超过80%的人在其一生中会经历长达4周以上的腰痛[1],目前公认腰痛的主要病因为椎间盘退变(intervertebral disc degeneration,IVDD)及其继发的一系列疾病[2]。椎间盘退变的病理生理学主要表现为髓核细胞(nucleus pulposus cells,NPCs)的减少、细胞外基质的改变以及炎性细胞的浸润[3]。髓核细胞参与合成、分泌细胞外基质,是维持椎间盘正常生理功能的关键细胞。[4-5]。如何维持髓核细胞数量及分泌细胞外基质功能是治疗椎间盘退变的根本措施。脂联素(adiponectin,Apn)是由脂肪细胞分泌的一种激素蛋白,研究证实Apn除具有抗炎、抗氧化等功能外,还能调控细胞增殖和细胞凋亡[6-7]。椎间盘退变进程中,髓核细胞增殖下降、凋亡增加,Apn能否调控髓核细胞增殖凋亡进程尚未清楚。本研究拟通过体外实验,检测Apn对人髓核细胞的调控作用及分子机制。
1 材料与方法
1.1 髓核组织获取及细胞培养 人髓核细胞购自上海康朗生物科技有限公司(货号4800 sciencell),培养方法依照Risbud等[8]文献报道,细胞传代至3~5代用于后续试验。
1.2 试剂耗材 人全长Apn(Catalog no.1065-AP;R&D公司),MEM培养基(Gibco公司),Adipo R1抗体(ab189446 44 kDa,Abacm公司)、Adipo R2抗体(ab126611 43 kDa,Abacm公司),β-Tubulin Antibody抗体(#2146,CST公司),CCK8试剂盒(Catalog no.C0038;碧云天公司),TUNNEL试剂盒(Catalog no.12 156 792 910;Roche公司),慢病毒LV-sh Adipo R1和LV-sh Adipo R2(购自百恩维生物)。
1.3 细胞处理 培养人髓核细胞,使用肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)(50 μg/mL)刺激髓核细胞,刺激0、12、24、48及72 h后中断反应,CCK8检测TNF-α对髓核细胞增殖的影响,TUNEL和流式细胞仪检测TNF-α对髓核细胞凋亡的影响。
离体培养人髓核细胞,使用不同浓度Apn联合TNF-α处理细胞,分为四组:Ctr(对照组)、TNF-α(50μg/mL)组、TNF-α(50μg/mL)+Apn(1μg/mL)组和TNF-α(50 μg/mL)+Apn(5 μg/mL)组处理细胞,处理0、12、24、48及72 h后中断反应,CCK8检测TNF-α对髓核细胞增殖的影响,TUNEL和流式细胞仪检测TNF-α对髓核细胞凋亡的影响。
为了进一步明确脂联素受体在Apn调控髓核细胞增殖凋亡中的作用,构建慢病毒Adipo R1、Adipo R2基因沉默载体Lv-sh-Adipo R1/R2。采用实时荧光定量PCR方法检测髓核细胞中Adipo R1、Adipo R2的基因沉默情况以确保Adipo R1、Adipo R2表达下降80%以上;检测人髓核细胞中Adipo R1、Adipo R2基因沉默后,TNF-α对髓核细胞增殖凋亡的诱导情况:病毒转染人髓核细胞5d后加入TNF-α诱导,处理0、12、24、48及72 h后中断反应,CCK8检测TNF-α对髓核细胞增殖的影响,TUNNEL和流式细胞仪检测TNF-α对髓核细胞凋亡的影响。
1.4 Western blot检测 微量二辛可宁酸(bicinchoninic acid,BCA)法检测蛋白浓度。取20 μg蛋白样本、配置10% SDS聚丙烯酰胺凝胶电泳分离蛋白质,PVDF膜将分离后蛋白转印纸膜上,3% BSA室温封闭1 h,cleaved-Caspase-3/8(1︰2 000)一抗4℃摇床孵育过夜,室温二抗孵育1 h,增强化学发光法(enhanced chemiluminescence)发光液孵育并曝光。
1.5 TUNEL实验 消化生长对数期的细胞,依据说明书将人髓核细胞以1×105/mL加入96孔板,分别给予不同分组刺激后,移除上清液并无菌磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗,配置TUNEL孵育液并加入髓核细胞中孵育1 h,弃去TUNEL并PBS清洗一遍,加入DAPI(1 μg/mL)避光孵育15min,加入抗荧光淬灭液。最后荧光显微镜下观察荧光并拍照。
1.6 流式细胞实验 依据说明书将人髓核细胞以1×106/孔接种于6孔板,分别给予不同分组刺激后,移除上清液并PBS清洗,胰酶消化细胞、血清终止,离心后重新悬浮清洗细胞,调整细胞密度为5×105~1×106/mL。取100 μL细胞悬液于5 mL流式细胞管中,加入Annexin V-FITC 5μL和10 mg/L碘化丙啶10 μL,混匀后室温避光孵育15 min,加入400 μL稀释好的结合缓冲液,流式细胞仪检测细胞凋亡率。

2 结 果
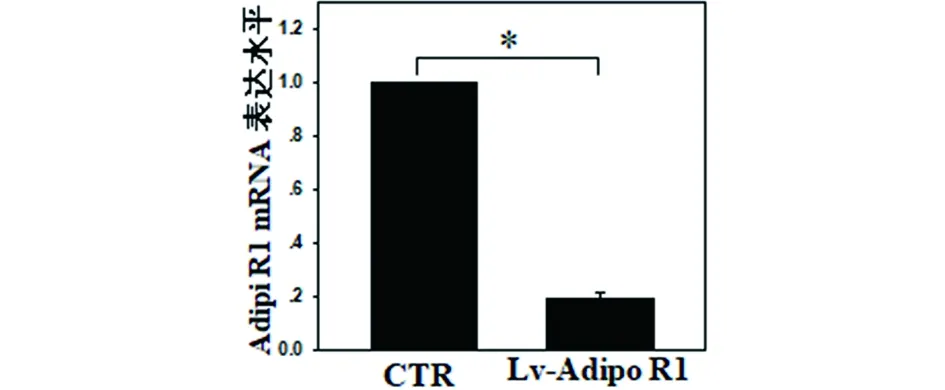
2.1 Lv-sh-Adipo R1/R2感染髓核细胞及验证 人髓核细胞感染Lv-sh-Adipo R1/R2慢病毒后,转染72 h后荧光显微镜显示髓核细胞激发出大量绿色荧光;RT-PCR及Western Blot检验结果显示髓核细胞内Adipo R1/R2 mRNA表达显著下降,提示基因沉默成功,见图1~6。
图1 Lv-sh-Adipo R1组髓核细胞激光共聚焦显微镜检测结果

注:*组间比较差异有统计学意义,P<0.05
注:*组间比较差异有统计学意义,P<0.05
图4 Lv-sh-AdipoR2组髓核细胞激光共聚焦显微镜检测结果

注:*组间比较差异有统计学意义,P<0.05
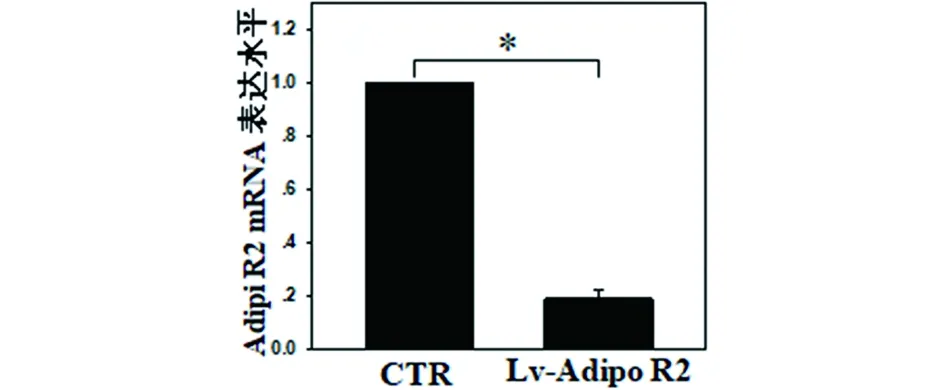
注:*组间比较差异有统计学意义,P<0.05
2.2 Apn对人髓核细胞增殖的影响 离体培养人髓核细胞,使用不同浓度Apn联合TNF-α处理细胞,处理0、24、48及72 h后中断反应,CCK8检测TNF-α对髓核细胞增殖的影响。结果发现TNF-α抑制人髓核细胞增殖,Apn能够拮抗TNF-α对人髓核细胞增殖的抑制作用,并且呈剂量效应(见图7)。
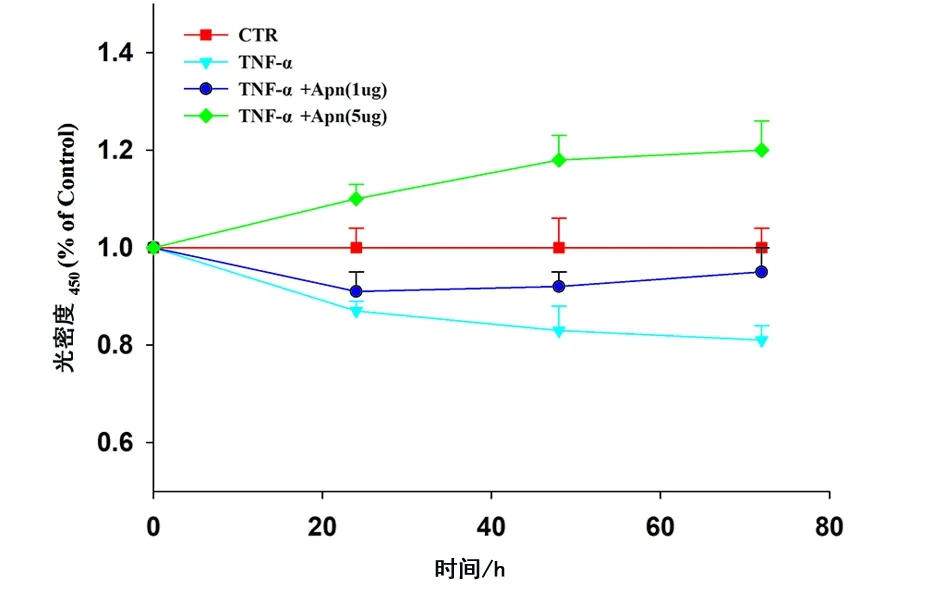
图7 Apn对人髓核细胞增殖的影响
2.3 Apn对人髓核细胞凋亡的影响 采用上述组别处理人髓核细胞,处理12h后收集细胞采用TUNEL检测细胞凋亡,另采用流式细胞仪检测细胞凋亡情况。结果显示TNF-α促进髓核细胞凋亡,Apn能够拮抗TNF-α对人髓核细胞的促凋亡作用(见图8)。
2.4 Adipo R1/R2对髓核细胞增殖凋亡的影响 应用慢病毒技术沉默髓核细胞内Adipo R1/R2后,再给予TNF-α刺激髓核细胞,CCK8检测Adipo R1/R2对髓核细胞增殖的影响,发现TNF-α抑制人髓核细胞增殖,沉默Adipo R1/R2能够增强TNF-α对人髓核细胞增殖的抑制作用(见图9)。

a TUNNEL检测结果
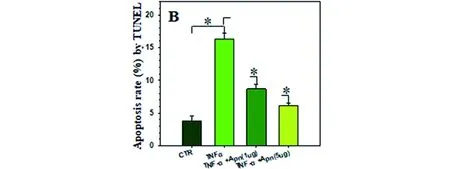
注:*组间比较差异有统计学意义,P<0.05
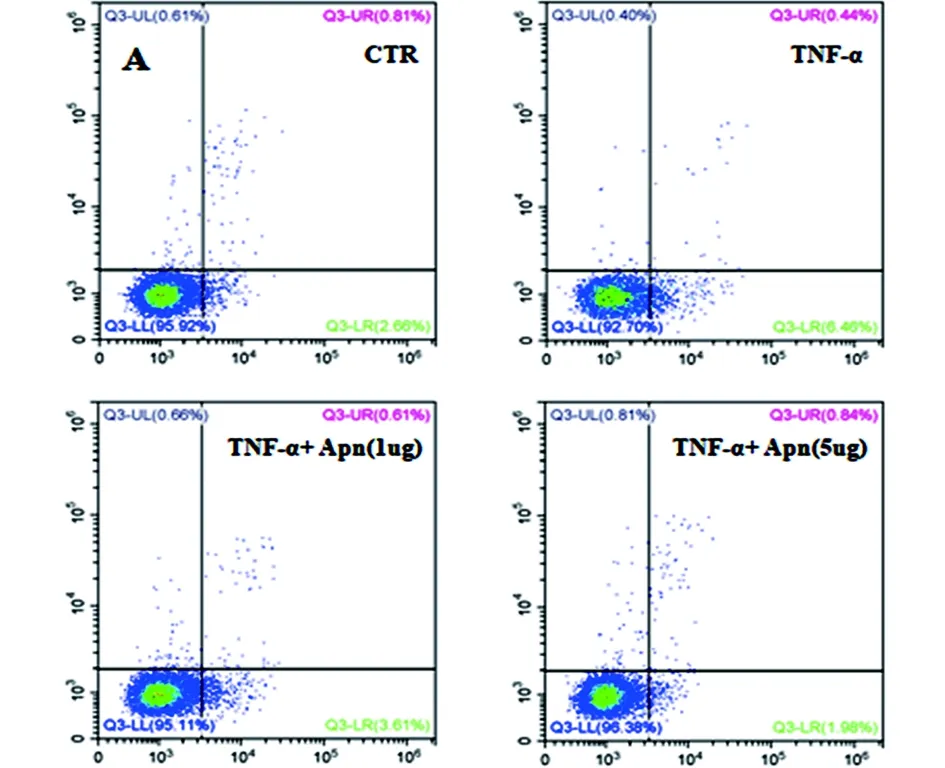
c 流式细胞仪检测结果

注:*组间比较差异有统计学意义,P<0.05

图9 Adipo R1/R2对髓核细胞增殖凋亡的影响
流式细胞仪检测Adipo R1/R2对髓核细胞凋亡的影响,结果显示TNF-α促进髓核细胞凋亡,沉默Adipo R1/R2能够增强TNF-α对人髓核细胞凋亡的促进作用(见图10)。

a 流式细胞仪检测结果
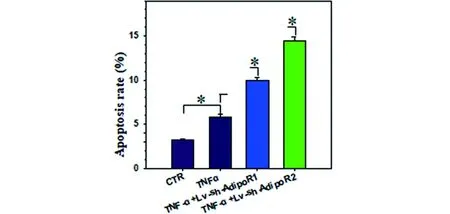
注:*组间比较差异有统计学意义,P<0.05
3 讨 论
椎间盘退变是一个与年龄密切相关的病理生理学过程,其典型特征为髓核组织正常结构丧失和进行性纤维化;髓核组织是椎间盘行使生物力学功能的中心,其形态及理化性质的改变是椎间盘退变的主要病理学改变[7]。导致以上病理改变的主要原因包括两大方面:髓核细胞数量减少和功能下降[8]。髓核细胞合成、分泌的细胞外基质是椎间盘髓核组织的主要组成部分。髓核细胞的数量减少(如NPCs凋亡及细胞增殖功能减低)与功能下降(如蛋白多糖、Ⅱ型胶原的合成减少)直接导致了髓核组织的各种病理学改变[9]。此外,退变椎间盘的髓核还产生多种炎性因子和参与细胞外基质降解的蛋白酶与水解酶,如白细胞介素-1β(interleukin-1β,IL-1β)、TNF-α、去整合素和金属蛋白酶、基质金属蛋白酶、氧自由基等,加速细胞外基质的分解代谢,最终导致椎间盘的退变[10-11]。
脂联素(adiponectin,Apn)是由脂肪细胞分泌的一种激素蛋白,多项研究证实Apn具有抗炎、抗氧化应激等功用[12]。研究发现Apn能够通过两个受体Adipo R1、Adipo R2抑制髓核细胞合成分泌疼痛介质前列腺素E2(prostaglandin E2,PGE-2),提示Apn可能为一个保护性因子,在椎间盘源性腰痛环境中发挥抗炎作用[13]。Terashima等[14]研究发现Adipo R1、Adipo R2在椎间盘退变进程中呈下降趋势,Apn能抑制IL-1β对髓核细胞合成分泌TNF-α的促进作用,提示Apn参与了椎间盘退变的进程。Yuan等[15]报道退变椎间盘内Apn表达下降,外源性Apn能抑制退变椎间盘髓核细胞合成分泌TNF-α、并且呈剂量时间依赖性,提示Apn通过下调髓核细胞合成分泌TNF-α从而发挥其抗炎作用。然而目前尚不清楚Apn能否调控髓核细胞增殖凋亡进程。
研究证实Apn除具有抗炎、抗氧化等功能外,还能调控细胞增殖和细胞凋亡,并且其功能具有细胞组织特异性[4-5]。Dieudonne等[16]研究发现Apn能通过促进细胞凋亡和抑制细胞周期从而抑制人乳腺癌细胞的增殖。Rakatzi等[17]发现Apn在胰岛B细胞中具有抗凋亡作用,能对抗炎症因子和脂肪酸对胰岛B细胞的凋亡诱导。DiMascio等[18]研究发现Apn和其受体Adipo R1/2在造血干细胞中均有表达,Apn能促进造血干细胞的增殖并抑制其凋亡。Zhang等[19]发现Adipo R1/2表达与海马神经干细胞,Apn能促进海马神经干细胞增殖、并呈时间剂量依赖性,却不影响神经干细胞的凋亡和分化功能。付宗杰等[20]研究发现Apn可以促进骨髓间充质干细胞增殖,并减少缺氧、缺糖损伤后骨髓间充质干细胞凋亡。以上研究证实Apn广泛参与了各个细胞系的增殖凋亡进程,并且具有细胞差异性。本研究发现TNF-α能抑制髓核细胞增殖并诱导髓核凋亡,脂联素能逆转TNF-α对髓核细胞增殖和凋亡的调控作用(P<0.05)。Adipo R1/2沉默后,髓核细胞增殖受到抑制、凋亡升高,其中以Adipo R2为著(P<0.05)。此外,Adipo R1/2沉默能增强TNF-α对髓核细胞cleaved-Caspase-3/8的诱导作用。
综上所述,本研究通过慢病毒基因沉默等试验手段发现Apn能够通过两个受体Adipo R1、Adipo R2参与髓核细胞增殖凋亡进程,Apn促进髓核细胞增殖和抑制髓核细胞凋亡,提示Apn可能作为一个保护性因子在椎间盘退变进程中发挥抗凋亡作用。因此,接下来可以通过体内外实验深入了解Apn在椎间盘退变中的作用及相关机制。
