联合性运动疗法对绝经后骨质疏松症患者骨代谢的影响
2019-03-04李蕊杨震韩伟田晓滨李奇帅胜斌刘亚斌
李蕊 杨震 韩伟 田晓滨 李奇 帅胜斌 刘亚斌
绝经后骨质疏松症(PMOP) 是一种好发于绝经后妇女的全身性骨代谢紊乱。绝经后妇女因卵巢功能减退和雌激素分泌迅速减少,可出现骨骼微环境紊乱和骨组织微观结构退化,继而发生骨量减少、骨脆性增加和骨密度(BMD)降低等病理改变[1]。随着全球老龄化社会的到来,该病发病率呈逐年上升趋势,绝经后女性中60~69岁人群的患病率高达50%~70%[2]。PMOP患者早期主要表现为全身疼痛,后期则出现身高降低、驼背及骨折等临床症状,严重影响生活质量[3]。以往治疗骨质疏松以药物为主,近年来越来越多的研究表明,运动疗法作为骨质疏松防治手段可明显改善和调节骨转化和骨吸收[4],且具方便、廉价、不良反应少的优势,因而越来越受到关注。本研究采用有氧运动加抗阻训练的联合性运动疗法,探讨运动疗法影响PMOP患者BMD及骨代谢的细胞学和分子生物学机制,为进一步研究PMOP临床治疗方法提供参考。
1 资料与方法
1.1 纳入和排除标准
纳入标准:①年龄50~65岁,原发型绝经时间≥2年;②符合中华医学会骨质疏松症诊疗指南(2011)[5]诊断标准,根据BMD检查结果计算T-score≤2.5标准差;③入组前半年未接受过骨代谢相关药物治疗;④患者知情自愿并签署相关知情同意书。
排除标准:①合并严重心肺系统疾病及肿瘤患者;②继发性及特发性骨质疏松症患者,如内分泌疾病、血液病、结缔组织病等;③慢性肝肾疾病、长期应用糖皮质激素等干扰骨代谢疾病患者;④活动性骨关节病及其它原因引起胸背或腰部疼痛者;⑤存在明显运动、认知及精神障碍者;⑥未按规定用药或接受运动治疗者。
1.2 一般资料
选取 2017年4月至 2018年4月在贵州省人民医院与天津医院骨外科和康复科的门诊及住院部就诊的PMOP患者52例。采用随机抽签法将其分为训练组和对照组,每组26例,两组患者年龄、身高、绝经时间及体质指数(BMI)等一般资料比较无统计学差异(P>0.05)(见表1 )。
1.3 研究方法
1.3.1 药物及运动治疗
所有患者均接受常规抗骨质疏松药物治疗,即连续口服碳酸钙 D3(600 mg,1次/d)、阿法骨化醇软胶囊(0.5 μg,1次/d)及阿伦膦酸钠(70 mg,1次/周)3个月。训练组在常规用药基础上再结合有氧运动与渐进性抗阻训练的联合运动治疗。
运动方案:①有氧运动,即户外快步行走(心率对应50% VO2max,30 min/次),每天1次,每周运动4 d;②抗阻训练,即利用弹力带进行渐进式抗阻练习(髋关节前屈、后伸、外展、内收;前腿肌伸展;小腿屈伸;腰部前屈、后伸、侧屈、旋转)。第1、2周每周完成1组(15次/组)训练,之后每2周增加1组。强度10个最大负荷值(RM),连续训练3个月[6]。
1.3.2 BMD和骨代谢生化标记物的测定
采用Lunar双能X线BMD仪分别测定治疗前和治疗后患者腰椎L1~4及左侧股骨颈的BMD,并于治疗前1天及治疗结束后第1天清晨分别采集患者空腹静脉血,测定血清中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、胰岛素样生长因子(IGF)-1、25-羟基维生素D(25-OH-D)、碱性磷酸酶(ALP)、Ⅰ型原胶原分子N-端前肽(PINP)及抗酒石酸酸性磷酸酶(TRACP)水平。
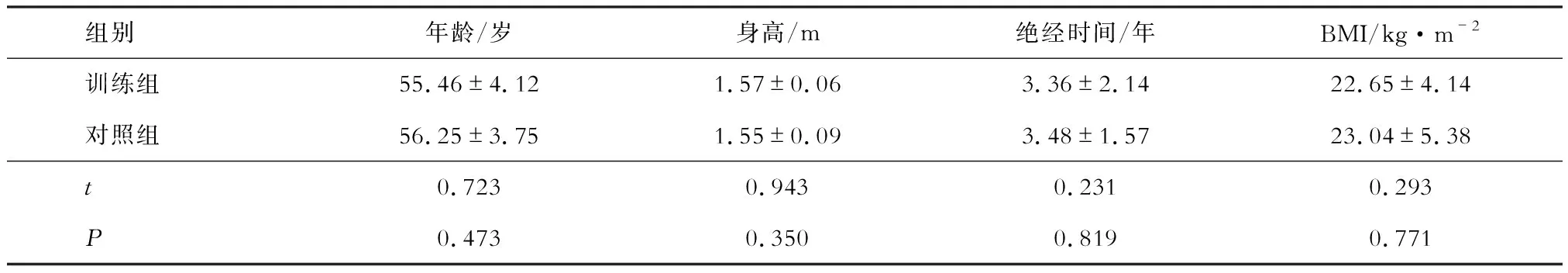
表1 两组患者的一般资料比较
1.3.3 疼痛程度评定
采用视觉模拟评分(VAS)评价疼痛程度。评价标准为:0 分,无痛;3 分以下,有轻微的疼痛,能忍受;4~6 分,患者疼痛并影响睡眠,尚能忍受;7~10 分,患者有渐强烈的疼痛,疼痛难忍,影响食欲,影响睡眠。
1.4 统计学处理
采用 SPSS 19.0 统计学软件进行数据分析,计量资料以均数±标准差表示,组内治疗前后比较采用配对样本t检验,组间比较采用独立样本t检验和χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 BMD变化
治疗后,两组患者腰椎(L1~4)及左侧股骨颈BMD较治疗前升高(P<0.05),与对照组相比,训练组BMD更高(P<0.05)(见表2)。
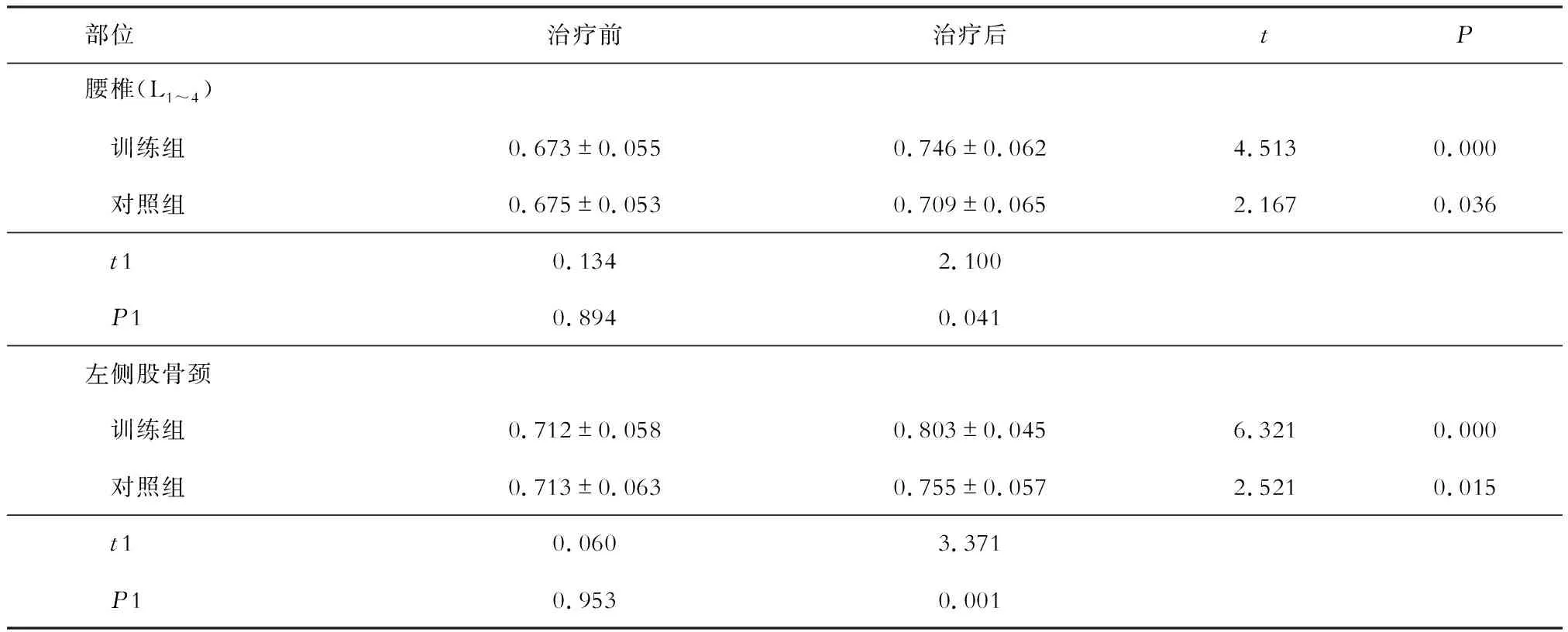
表2 两组患者治疗前后BMD变化(g/cm2)
注:t、P为组内治疗前、后比较,t1、P1为组间比较
2.2 疼痛评分变化
治疗前两组患者 VAS 评分差异无统计学意义(P>0.05 )。与治疗前相比,治疗3 个月后两组患者VAS 评分均降低 (P<0.05 ),且训练组 VAS评分低于对照组 (P<0.05)(见表3)。
2.3 骨代谢相关细胞因子和生化指标变化
治疗前两组患者血清TNF-α、IL-6、IGF-1和25-OH-D水平均无统计学差异(P>0.05)。治疗后,两组患者血清TNF-α和IL-6水平均较治疗前明显下降,且训练组血清中TNF-α和IL-6水平低于对照组(P<0.05);两组患者血清IGF-1和25-OH-D水平均较治疗前明显升高,且训练组血清IGF-1和25-OH-D水平高于对照组(P<0.05)(见表4)。
治疗前两组患者血清ALP、PINP和TRACP水平均无统计学差异(P>0.05)。治疗后,两组患者血清ALP、PINP和TRACP水平均较治疗前明显下降(P<0.05);两组间血清ALP、PINP水平比较差异无统计学意义(P>0.05);仅训练组血清TRACP水平低于对照组(P<0.05 )(见表5)。
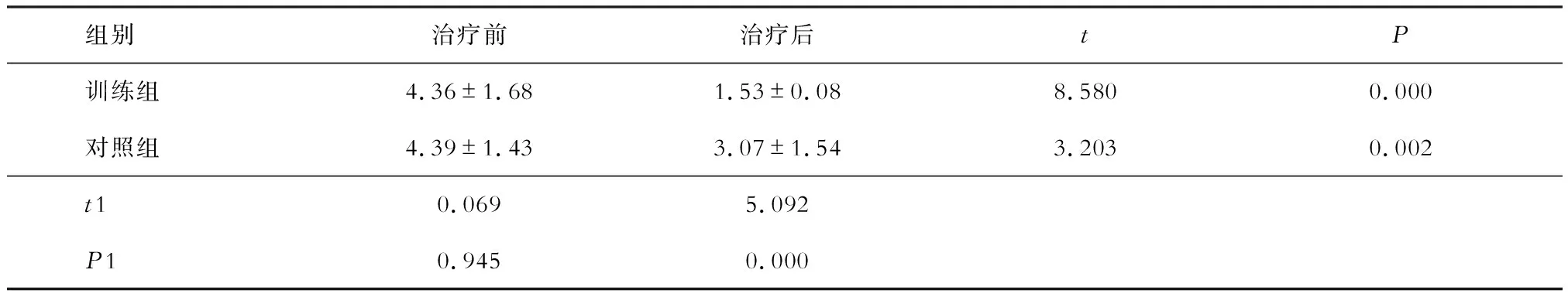
表3 两组患者治疗前后VAS评分变化(分)
注:t、P为组内治疗前、后比较,t1、P1为组间比较
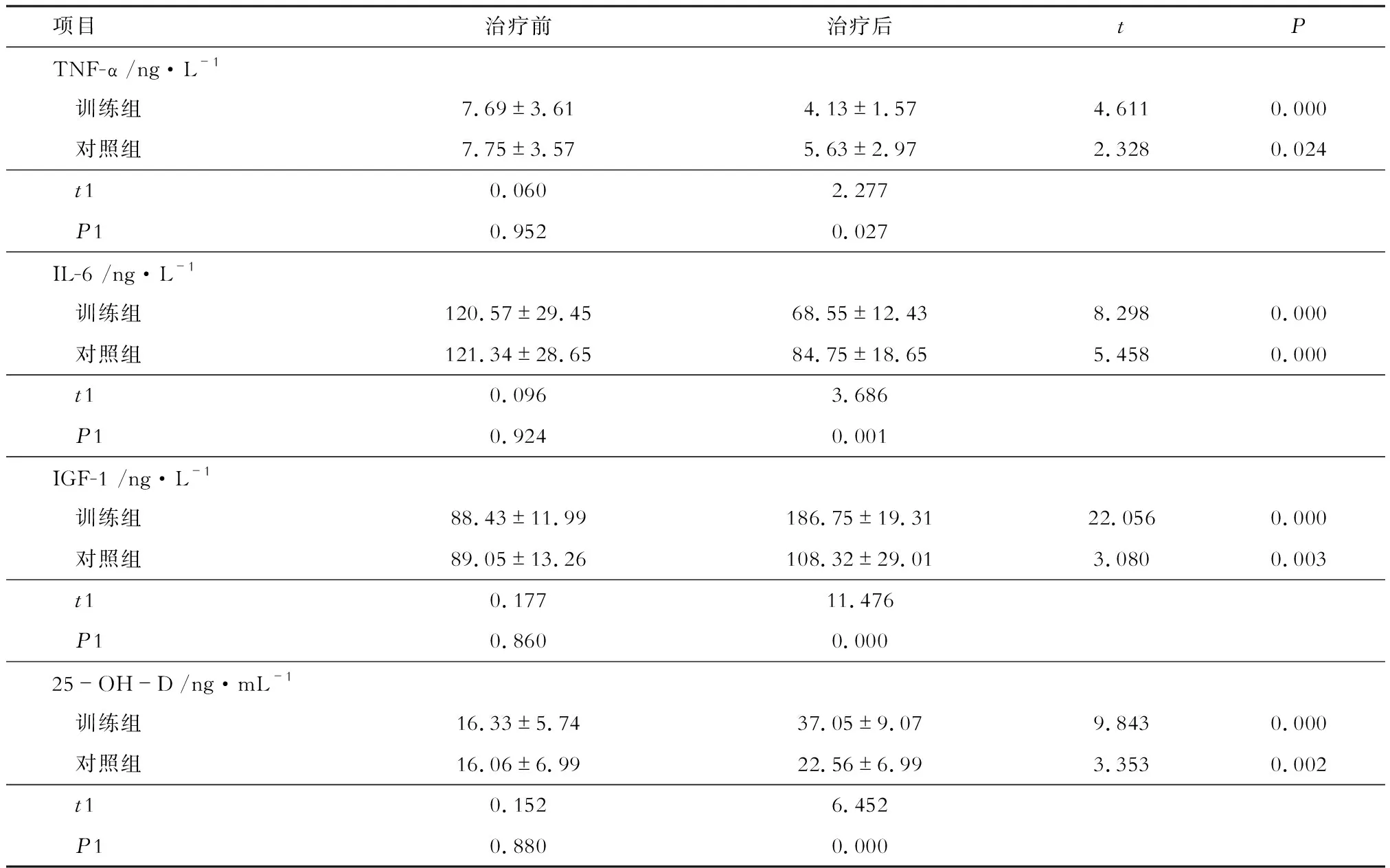
表4 两组患者治疗前后骨代谢相关细胞因子变化
注:t、P为组内治疗前、后比较,t1、P1为组间比较
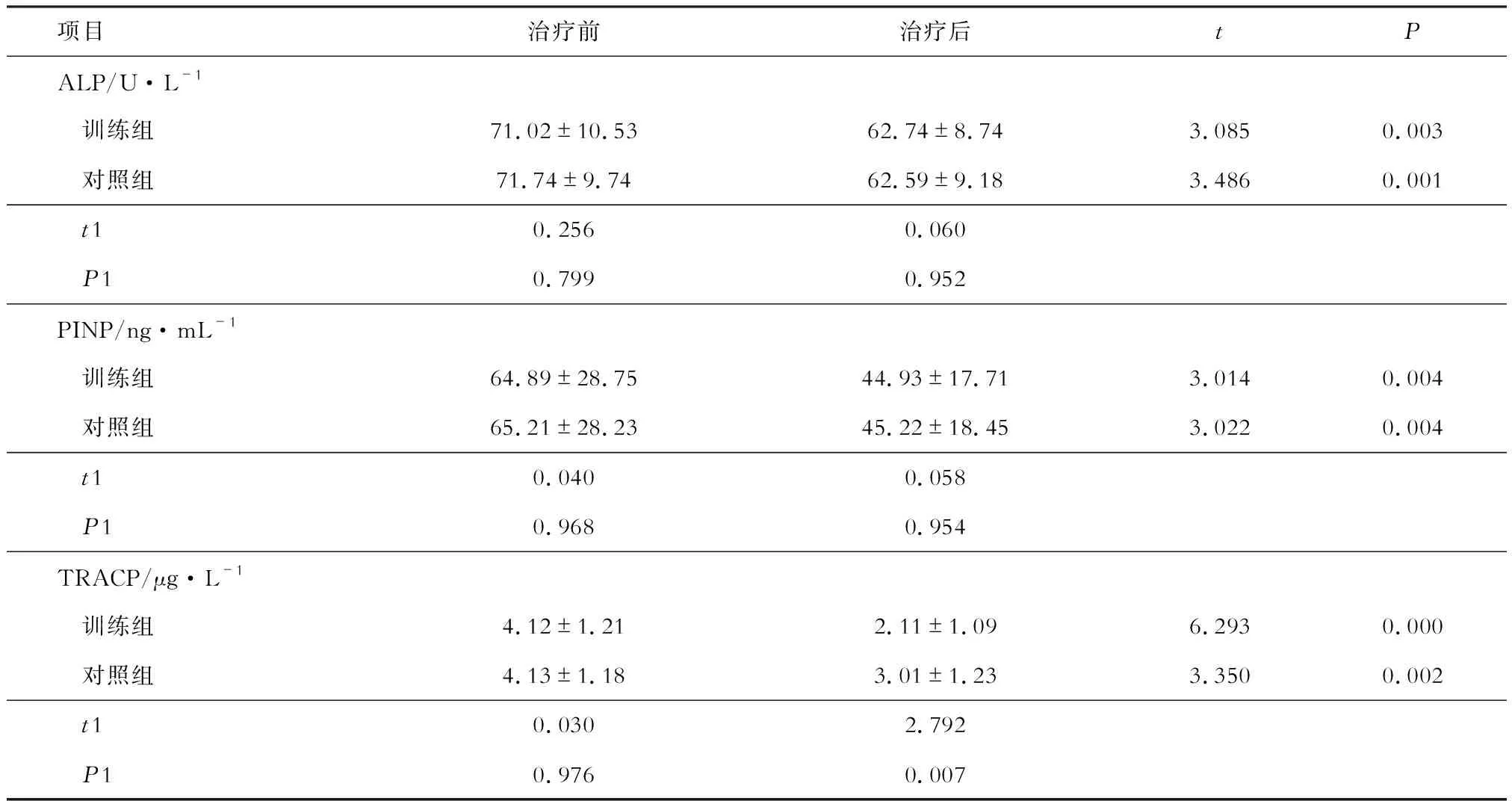
表5 两组患者治疗前后骨代谢生化指标变化
注:t、P为组内治疗前、后比较,t1、P1为组间比较
3 讨论
绝经后雌激素水平下降可造成破骨细胞活性增加及骨吸收和骨转换增速,从而导致骨量迅速流失,为中老年女性发生PMOP的主要原因。腰背酸痛、周身酸痛等PMOP伴随症状及因骨量丢失引发的骨折已成为严重危害绝经后女性生活质量的健康问题[7]。
运动疗法具有积极健康、低成本及无不良反应等优势,近年来在治疗骨质疏松领域越来越受到重视。有研究表明,运动治疗过程中肌肉和肌腱间相互作用时产生的机械应力不仅能提高BMD,增加骨强度,降低骨折风险[8],还能调节机体内分泌系统,提高机体雌激素水平,故可预防及治疗PMOP[9]。虽然不同类型的运动治疗对骨质疏松症患者骨变量的影响不尽相同,但运动治疗可提高骨质疏松症患者BMD已获得普遍认可[3,9-10]。国内外大量研究发现,联合性运动疗法既能全面促进机体的肌肉力量,平衡协调运动能力,又能针对性提高特定部位BMD。与单一运动疗法相比,联合性运动疗法更易于被患者接受并有利于完成下一阶段治疗方案,使运动的成骨效应最大化。Hara等[11]的研究发现,一定负荷范围内有氧运动预防骨质疏松的效果与运动强度及运动量成正比。
另有研究发现,在有氧运动基础上进行抗阻训练可对骨骼形成更大的机械刺激,从而显著提高受试者BMD[4]。本研究采用联合性运动治疗方案治疗3个月后发现,与对照组相比,训练组BMD较高且疼痛缓解程度更明显,其股骨颈BMD增加值较腰椎BMD增加值更大,该结果可能是由于抗阻运动提高了支撑相的躯体稳定性。与传统单一药物治疗相比,该治疗方案的优势在于患者依从性较好,所有治疗内容不受场地及时间限制,易于完成。
骨形成和骨吸收是人体内骨代谢的2种主要形式,二者紧密偶联可完成骨转换。骨代谢生化指标情况可充分反映骨代谢状态,因此测定骨代谢生化指标可用于评估骨代谢[12]。与BMD相比,骨代谢生化指标可更为迅速地反映骨量变化,对预防骨折及监测治疗效果具有重要意义。训练组治疗后TNF-α、IL-6及 IGF-1水平均较对照组明显降低,提示在常规抗骨质疏松药物基础上,联合性运动疗法可有效抑制PMOP患者细胞因子表达,从而有效改善其骨代谢及骨转换状态[13]。25-OH-D是重要的骨代谢调节激素,其生理功能主要有促进小肠的钙磷吸收,促进肾小管钙磷重吸收和促进骨矿物质动员。本研究中,虽然两组患者治疗后25-OH-D水平较治疗前升高,但对照组仍低于正常水平,而训练组明显高于对照组,处于正常水平。上述发现提示运动疗法中户外活动增加了患者接受日照的机会,较单一药物治疗对25-OH-D水平的提升作用更为明显,有进一步促进骨转化的作用。
另一方面,ALP和PINP作为骨形成标记物可反映成骨细胞活性,在PMOP患者中敏感性更高[14]。本研究发现,经过3个月的治疗后两组间ALP和PINP均无明显差异(P>0.05),说明抗骨质疏松药物治疗可调节患者骨吸收和骨形成过程,与既往研究结果一致[15-16]。TRACP 主要由破骨细胞释放,可反映破骨细胞活性和骨吸收状态。训练组血清 TRACP 水平低于对照组,说明运动疗法可有效抑制骨吸收过程,从而提高PMOP患者的BMD,但详细机制有待进一步研究。
综上所述,与单纯药物治疗相比,在抗骨质疏松药物治疗基础上增加联合性运动疗法,在增加PMOP患者BMD、调节骨代谢及骨转换状态、抑制骨吸收过程、减少骨量丢失及缓解不适症状等方面更有效,患者更易于坚持,且不良反应较小。联合性运动疗法为更安全、有效、可持续地治疗PMOP患者提供了新方向。
