穿心莲花粉活力测定及离体萌发特性研究
2019-02-28石志棉姬璇杜勤梁誉青苏雨苗刘潇晗
石志棉, 姬璇, 杜勤, 梁誉青, 苏雨苗, 刘潇晗
(广州中医药大学中药学院,广东广州 510006)
穿心莲来源于爵床科植物穿心莲Andrographis paniculata(Burm.f.)Nees,别名一见喜、斩蛇草、苦草、橄榄莲等,为广东道地药材,以地上部分入药[1]。味苦,性寒。具有清热、解毒、凉血、消肿的功效,用于感冒发热、咽喉肿痛、口舌生疮、顿咳劳嗽、泄泻痢疾、热淋涩痛、痈肿疮疡、蛇虫咬伤等病症的治疗[2]。主要化学成分为穿心莲内酯和脱水穿心莲内酯等[3]。穿心莲由于长期人工栽培,目前品种退化、产量下降、有效成分含量降低等现象严重[4,5]。有性繁殖是常规育种的主要方式之一,花粉作为雄配子体,它的萌发及花粉管的伸长直接影响育种成效[6];而且花粉管便于培养和离体操作,一直是研究细胞极性生长、细胞间相互作用以及信号传导等细胞学问题的理想模式系统[7-11]。因此,本研究以穿心莲花粉为实验材料,建立穿心莲花粉体外萌发适宜培养方法。现将研究结果报道如下。
1 材料与方法
1.1样品穿心莲花采自广州中医药大学药圃,经广州中医药大学药用植物教研室杜勤教授鉴定,为爵床科植物穿心莲Andrographis paniculata(Burm.f.)Nees。
1.2试剂与仪器碘(I2,广州化学试剂厂,批号:20151015);碘化钾(KI,天津市致远化学试剂有限公司,批号:20131021);红四氮唑(TTC,上海Macklin公司,批号:C10101070);蔗糖(天津市致远化学试剂有限公司,批号:2015032068);硼酸(天津市致远化学试剂有限公司,批号:2015604010);氯化钙(天津大茂化学试剂厂,批号:201501016);聚乙二醇6000(PEG6000,天津市致远化学试剂有限公司,批号:20171034);赤霉素(GA3,广州浩玛生物科技有限公司,批号:38035359)。YS100光学显微镜(日本Nikon公司);SM2 1000体视镜(日本Nikon公司)。
1.3实验方法
1.3.1 I2-KI染色法测定花粉活力 配制I2-KI溶液:称取2 g KI溶于20 mL蒸馏水中,加1 g I2全溶后,定容至300 mL。染色:剥取不同药丝比的花药,用小镊子轻轻挤压花药,制成花粉涂片,滴1~2滴I2-KI溶液,染色5 min,10倍镜镜检。染成紫色的为有活性的花粉,褐色的没有活性,统计100粒花粉,重复3次,记录结果。
1.3.2 TTC染色法测定花粉活力 0.5%TTC溶液的配制:精密称量0.1 g TTC,定容至20 mL,调pH至7.7左右,现用现配。染色:剥取不同药丝比的花药,用小镊子轻轻挤压花药,涂抹在凹形载玻片上,在花粉上滴1~2滴0.5%TTC溶液搅拌均匀;将玻片于35℃恒温箱中放置15 min,避光染色,10倍镜镜检。染成红色的为有活性的花粉,没有染色的没有活性,统计100粒花粉,重复3次,记录结果。
1.3.3 花粉管离体萌发法测定花粉活力
1.3.3.1 花粉萌发培养液优化 采用正交设计法[12],考察 100、150、200 g/L 蔗糖,0.1、0.3、0.5 g/L 氯化钙,0.5、1、2 g/L 硼酸,50、100、150 g/L PEG6000质量浓度梯度对穿心莲花粉萌发的影响。正交试验设计因素水平安排表及试验方案见表1、2。
按表2分别配制100 mL花粉萌发培养液。将配制好的培养液均匀滴在凹形载玻片中间备用。采集即将开放或已开放(即药丝比1∶6)的小花,用镊子挤压花药,使花粉均匀撒在培养液上,(25±2)℃配合2000 Lux光照(光照10 h,黑暗14 h)培养24h,在10倍镜下镜检。以花粉管长度超过花粉直径为萌发,统计100粒花粉的萌发情况,重复3次。
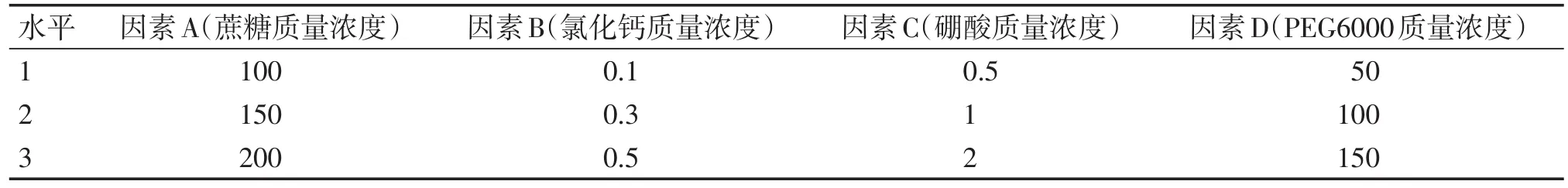
表1 花粉管萌发正交试验设计因素水平表Table 1Factors and levels of orthogonal test design for pollen tube germination[ρ/(g·L-1)]

表2 花粉管萌发正交试验方案Table 2Orthogonal test scheme for pollen tube germination[ρ/(g·L-1)]
1.3.3.2 GA3质量浓度对花粉管萌发的影响 以上述正交试验得出的最佳组合为基础培养液配方,分别加入0.001、0.01、0.1 g/L GA3,考察不同质量浓度GA3对花粉管萌发的影响。
1.3.3.3 预处理对花粉管萌发的影响 采用正交试验设计统计得出的最佳培养液组合,均匀滴在凹形载玻片中间。选取即将盛开或已盛开的小花,分别进行4℃冷预处理24、48 h,30℃热预处理24、48 h,不处理。剥去花药,用小镊子轻轻挤压花药,将花药均匀撒在培养液上,在27℃下培养24 h。在显微镜下观察花粉管萌发情况,每个视野统计100粒花粉,重复3次,记录结果。
1.3.3.4 光培养与暗培养对穿心莲花粉管萌发的影响 采用正交试验设计统计得出的最佳培养液组合,均匀滴在凹形载玻片中间。选取经最适预处理的即将盛开或已盛开的小花,剥去花药,用小镊子轻轻挤压花药,将花药均匀撒在培养液上,在光照及黑暗的条件下培养24 h。在显微镜下观察花粉管萌发情况,每个视野统计100粒花粉,重复3次,记录结果。
1.3.3.5 花粉管萌发法测定穿心莲花粉活性 采用正交试验设计统计得出的最佳培养液,均匀滴在凹形载玻片中间。分别在8:00、15:00 2个时间段采集药丝比为1∶1、1∶2、1∶4、1∶6 的4种小花,经最适预处理后备用。将完成预处理的小花,剥去花药,用小镊子轻轻挤压花药,将花药均匀撒在培养液上,在最适条件下培养24 h。在显微镜下观察花粉萌发情况,每个视野统计100粒花粉,重复3次,记录结果。
2 结果
2.1I2-KI染色法测定穿心莲花粉活力用I2-KI染色法测定穿心莲花粉活力,试验结果见表3、图1。
由表3、图1可知,15:00采集的药丝比为1∶4的花粉染色率最高,而8:00采集的药丝比为1∶6的花粉染色率最低,花粉活性随药丝比的减小呈先增高后下降的趋势,相同药丝比的小花,15:00采集的花粉活性比8:00采集的花粉高。
2.2TTC染色法测定穿心莲花粉活力用TTC染色法测定穿心莲花粉活力,试验结果见表4、图2。
由表4、图2可知,15:00采集的药丝比为1∶6的花粉染色率最高,而15:00采集的药丝比为1∶1的花粉染色率最低,花粉活性随药丝比的减小呈增高的趋势,相同药丝比的小花,15:00采集的花粉活性比8:00采集的花粉高。
2.3花粉管离体萌发法测定穿心莲花粉活力
2.3.1 花粉管离体萌发培养液优化 考察100、150、200 g/L蔗糖质量浓度梯度,0.1、0.3、0.5 g/L氯化钙质量浓度梯度,0.5、1、2 g/L硼酸质量浓度梯度,50、100、150 g/L PEG6000质量浓度梯度对穿心莲花粉萌发率的影响。试验结果及分析见表5。

表3 I2-KI染色法测定穿心莲花粉活力Table 3 The results for the vitality of Andrographis paniculata pollen determined by I2-KI staining method (n=3)
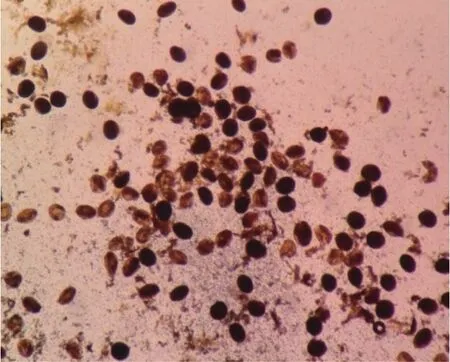
图1 穿心莲花粉I2-KI染色结果(×100)Figure 1 The I2-KI staining results for Andrographis paniculata pollen(×100)

表4 TTC法测定花粉活力Table 4 The results for the vitality of Andrographis paniculata pollen determined by TTC method(n=3)

图2 穿心莲花粉TTC染色结果(×100)Figure 2 The TTC staining results for Andrographis paniculata pollen(×100)
从直观分析可得,4个因素对穿心莲花粉管萌发率的影响从大到小的排列为:蔗糖质量浓度>硼酸质量浓度>氯化钙质量浓度>PEG6000质量浓度。试验得出的最佳组合是A1B2C2D3,即蔗糖100 g/L、氯化钙0.3 g/L、硼酸1.0 g/L、PEG6000 150 g/L。对最佳组合进行验证试验,穿心莲花粉萌发率为82.5%,高于上述9组试验的萌发率。对试验结果进行方差分析,结果见表6。
由表6可知,A因素(蔗糖)、B因素(氯化钙)、C因素(硼酸)对穿心莲花粉萌发有显著性意义(P<0.05),其中A因素(蔗糖)具有非常显著性意义(P<0.01)。
2.3.2 GA3质量浓度对花粉管离体萌发的影响 以上述正交试验得出的最佳组合(蔗糖100 g/L,氯化钙0.3 g/L,硼酸1.0 g/L,PEG6000 150 g/L)为基础培养液配方,分别加入 0.001、0.01、0.1 g/L GA3,考察不同质量浓度GA3对花粉管萌发的影响。试验结果见表7。
由表7可知,加入不同质量浓度GA3后,花粉管萌发率与对照组相比,花粉萌发率没有显著增高,但是通过观察,发现花粉萌发的时间大大缩短。加入GA3后,花粉管畸形化、弯曲化严重,不利于花粉管的观察与统计。
2.3.3 预处理对花粉管离体萌发的影响 采用正交试验设计统计得出的最佳培养液组合,均匀滴在凹形载玻片中间。选取即将盛开或已盛开的小花,分别进行4℃冷预处理24、48 h,30℃热预处理24、48 h,不做处理的为对照组,剥取花粉进行培养,试验结果见表8。
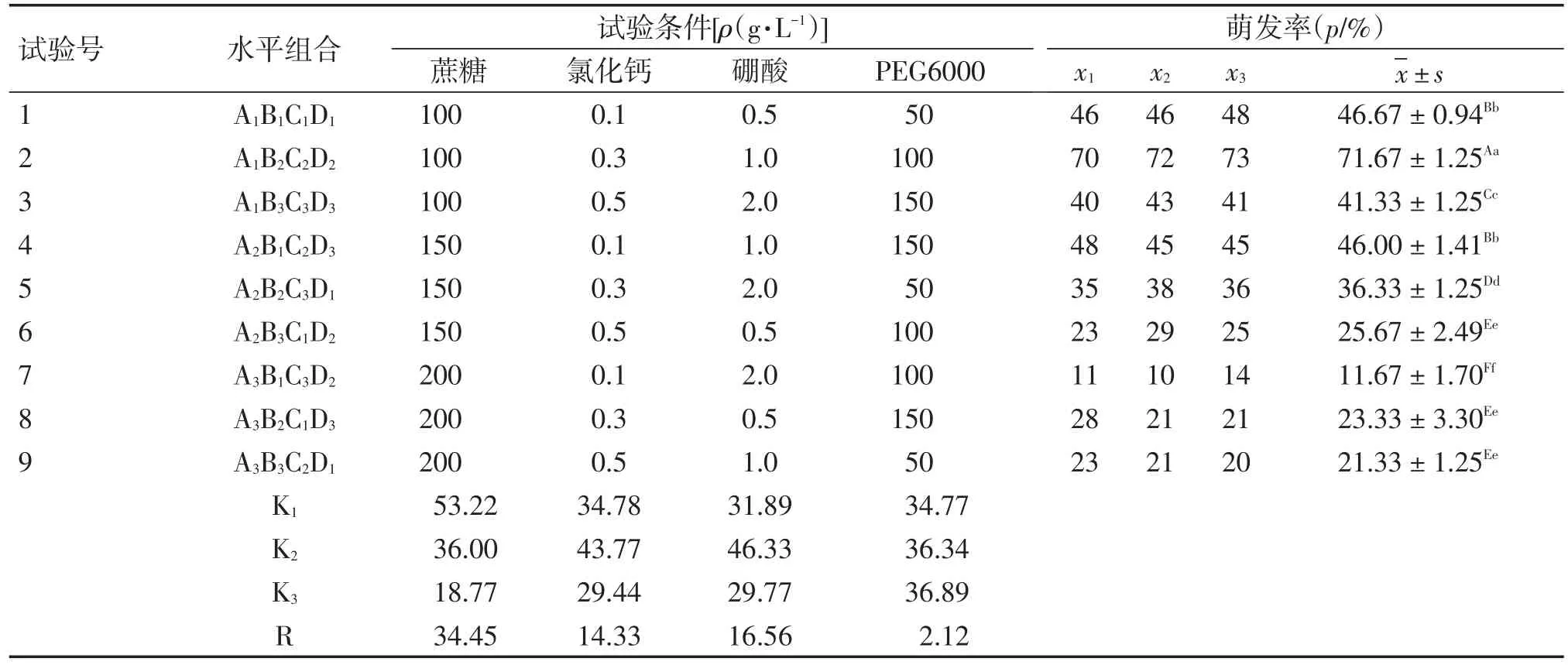
表5 穿心莲花粉管离体萌发试验结果Table 5 In-vitro test results for Andrographis paniculata pollen tube germination (n=5)
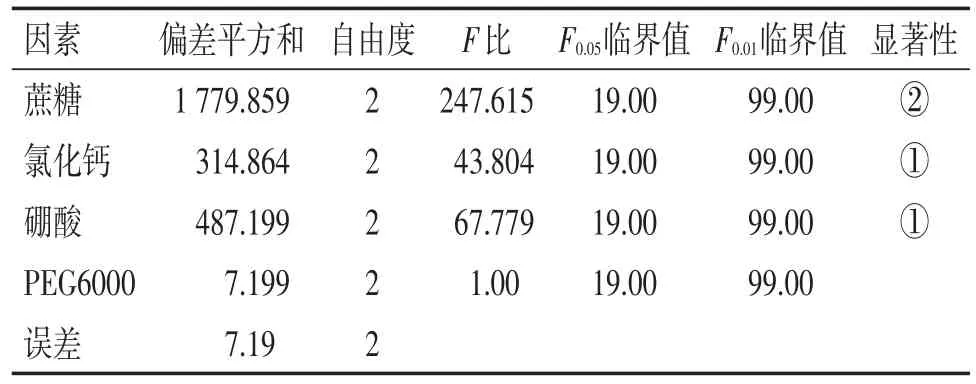
表6 花粉管离体萌发正交试验方差分析Table 6 Variance analysis for orthogonal test of in-vitro germination of pollen tube

表7 GA3质量浓度对花粉管离体萌发的影响Table 7 Effects of different GA3 concentrations on in-vitro pollen tube germination (n=3)
由表8可知,与对照组(不处理)比较,4℃冷处理24 h能显著提高花粉管萌发率。4℃冷处理48 h与30℃热处理24 h的穿心莲花粉管萌发率与对照组比较,无显著性差异。但通过30℃热处理48 h组可得出,随着热处理时间的增长,花粉管萌发率下降,花粉活力降低。

表8 预处理对花粉管离体萌发的影响Table 8 Effects of pretreatments on in-vitro pollen tube germination (n=3)
2.3.4 光培养与暗培养对穿心莲花粉管萌发的影响 采用正交试验设计统计得出的最佳培养液组合,均匀滴在凹形载玻片中间。选取经24 h 4℃预冷处理的即将盛开或已盛开的小花,剥取花粉,在(25±2)℃配合2 000 Lux光照(光照10 h,黑暗14 h)条件下培养24 h。在显微镜下观察花粉管萌发情况,试验结果见表9。对表9试验结果进行分析,光培养与暗培养对穿心莲花粉管萌发无显著影响(P>0.05)。
2.3.5 花粉管萌发法测定穿心莲花粉活性 采用正交试验设计统计得出的最佳培养液,均匀滴在凹形载玻片中间。分别在8:00、15:00 2个时间段采集药丝比为1∶1、1∶2、1∶4、1∶6 的4种小花。4℃预冷处理24 h后,剥取花粉,进行培养,在显微镜下观察花粉管离体萌发情况,试验结果见表10,图3、4。
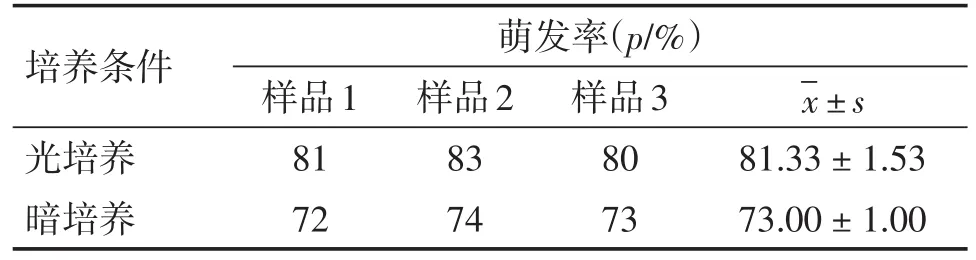
表9 光照条件对花粉管离体萌发的影响Table 9 Effects of lighting conditions on in-vitro pollen tube germination (n=3)

表10 花粉管萌发法测定穿心莲花粉活性Table 10 The results for Andrographis paniculata pollen activity determined by pollen tube germination method (n=3)
由表10可知,8:00与15:00 2个时间点采集的4个生长时期花粉统计结果均以药丝比为1∶6的花粉管离体萌发率最高,即该时期花粉活力最强;药丝比为1∶1时花粉管萌发率最低,即该时期花粉活力最低。花粉管离体萌发率均随着药丝比的减小而呈增高趋势。但是对2个采集时间比较显示,8:00采集的4种药丝比的小花的花粉管离体萌发率均比15:00时采集的高,所以在8:00采集药丝比为1∶6的小花即可获得花粉活力最高的小花。
3 讨论

图3 穿心莲花粉萌发过程(×400)Figure 3 The germination process of Andrographis paniculata pollen tube(×400)

图4 培养24 h后穿心莲花粉管形态(×100)Figure 4 The morphology feature of Andrographis paniculata pollen tube after 24-h culture(×100)
花粉体外萌发法是花粉活力鉴定常用的方法,其方法简便,萌发条件易控制[13-16]。花粉萌发一般需要碳水化合物,最常用的是蔗糖[17,18],一方面保持渗透压,另一方面作为新陈代谢的底物,提供能量。硼和钙对于花粉管的伸长和生长液具有明显的促进作用[19-21]。同时也可以使用PEG6000调节穿心莲花粉的渗透压[22-26],有助于穿心莲花粉管的萌发。
本研究中,TTC法测定的花粉活力趋势与花粉管离体萌发法测定的花粉活力趋势相同,均为花粉活力随着药丝比的减少而呈增高趋势。但在小花采集时间的测定上两者结果不一致,通过TTC法测定,最佳活力的小花为15:00采集的药丝比为1∶6的小花,但通过花粉管萌发法测定的结果则为8:00采集的药丝比为1∶6的小花。由于TTC法原理是通过测定脱氢酶活性从侧面反映花粉活性,所以试验结果可能会存在偏差[27-30],而花粉萌发法则是通过花粉管是否萌发直接反映花粉活力的,所以试验结果较TTC法可信。TTC法的检测时间较短,而花粉管萌发法则需要8~24 h的培养时间,检测时间较长,因此TTC法在快速检测花粉活性上具有优势,但是精确研究花粉活性仍应选择花粉管萌发法。
I2-KI染色法比起上述2种检测方法,其原理是通过对花粉内淀粉进行染色从而判定花粉活力,但是花粉内所含淀粉量与花粉活力之间的联系目前尚未明确[31-35],因此使用该方法测定花粉活性,可能会存在较大的偏差,不建议使用。
